как узнать г моль
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 8. Химическое количество вещества и моль
В уроке 8 «Химическое количество вещества и моль» из курса «Химия для чайников» выясним, что такое химическое количество вещества; рассмотрим моль в качестве единицы количества вещества, а также познакомимся с постоянной Авогадро. Напоминаю, что в прошлом уроке «Относительная молекулярная и относительная формульная массы» мы научились вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выяснили что такое массовая доля и привели формулу для ее вычисления.
Любое чистое вещество имеет свою химическую формулу, т. е. характеризуется определенным качественным и количественным составом.
Если необходима какая-то порция твердого вещества, то для этого следует взять нужную его массу, т. е. взвесить вещество (рис. 43). Нужный объем жидкого вещества обычно отмеряют с помощью мензурки или мерного цилиндра (рис. 44). Для отбора необходимой порции (объема) газообразных веществ применяют специальные емкости — газометры (рис. 45).
Следовательно, объем и масса — это величины, характеризующие данную порцию вещества.
Химическое количество вещества
В жизни мы часто не различаем понятия «масса» и «количество». А это разные понятия. Когда вы говорите: «Я купил 2 кг груш», то здесь речь идет о массе груш. Но если вы говорите: «Я купил 10 груш», то в этом случае речь идет о количестве груш. Массу вещества измеряют в граммах, килограммах, тоннах, а количество — в штуках.
Груши можно пересчитать поштучно, а если это, например, зерна? Тут уже посчитать каждое зернышко даже в небольшой емкости сложно. Поэтому зерно обычно продают мешками, т. е. определенными порциями. В каждой такой порции — мешке (если они равны по массе и все зерна одинаковы) — будет находиться практически одно и то же число зерен. Подобным образом продают многие товары. Например, яйца — десятками, спички — спичечными коробками, в каждом из которых находится по 45 спичек (рис. 46).
В химической практике, помимо массы или объема, необходимо знать число структурных единиц (атомов, молекул, формульных единиц), которые содержатся в данной порции вещества, поскольку именно они участвуют в химических реакциях. Поэтому в химии, как и в других естественных науках, используют физическую величину, характеризующую число частиц в рассматриваемой порции вещества. Эта физическая величина называется количеством вещества или, как следует называть ее при химических расчетах, — химическое количество вещества.
Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
Другими словами, химическое количество вещества — это порция данного вещества, содержащая определенное число его структурных единиц. Химическое количество вещества обозначают латинской буквой n . Это одна из семи основных физических величин Международной системы единиц (СИ).
Моль — единица химического количества вещества
Каждая из основных физических величин имеет свою единицу. Например, единица длины — метр (м), массы — килограмм (кг), времени — секунда (с). Единицей химического количества вещества является моль.
Моль — порция вещества (т. е. такое его химическое количество), которая содержит столько же структурных единиц, сколько атомов содержится в углероде массой 0,012 кг.
Сокращенное обозначение единицы химического количества записывается, как и полное, — моль. Поэтому, если слово «моль» стоит после числа, то оно не склоняется, так же, как и другие сокращенные единицы величин: 3 кг, 5 л, 8 моль. При чтении вслух и при записи числительного буквами слово «моль» склоняется: три килограмма, пять литров, восемь молей.
На заметку. Термины «молекула» и «моль», как нетрудно заметить, однокоренные. Они действительно произошли от одного и того же латинского слова «moles». Но это слово имеет, по крайней мере, два значения. Первое — «маленькая масса». Именно в этом смысле в XVII в. оно превратилось в термин «молекула». А понятие «моль» (в смысле кучка, порция) появилось значительно позже, в начале ХХ в. Автор этого термина известный немецкий химик и физик Оствальд толковал его смысл как «большая масса», как бы противопоставляя термину «молекула».
получила название постоянной Авогадро. Она является одной из важнейших универсальных постоянных и обозначается символом NA :
Единица в числителе дроби (1/моль) заменяет название структурной единицы.
если 1 моль вещества содержит 6,02·10 23 молекул, то n моль вещества содержат N(Х) молекул.
И наоборот, по числу структурных единиц можно рассчитать химическое количество вещества:
Пример 1. Определите число молекул, содержащихся в серной кислоте химическим количеством 3 моль.
Пример 2. Рассчитайте химическое количество CuSO4 в порции, содержащей 36,12·10 23 формульных единиц (ФЕ).
Краткие выводы урока:
Надеюсь урок 8 «Химическое количество вещества и моль» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Молярная масса
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.
Рис. 1. Формула числа Авогадро.
Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
где m – масса вещества, а v – количество вещества.
Рис. 2. Расчет молярной массы.
Как найти молярную массу вещества?
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H2 SO4. Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.
Рис. 3. Формула единицы атомной массы углерода.
Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.
Что мы узнали?
В 8 классе по химии важной темой является «молярная масса вещества». Молярная масса – важное физическое и химическое понятие. Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. измеряется она в кг/моль или грамм/моль.
 chva
chva
Виталий Чихарин
Вчера обещал объяснить это доступным языком. Вещь важная для понимания химии. Если один раз понять, то потом уже не забудешь.
Химия имеет свой язык, как и любая наука. 2H2 + O2 → 2H2O — на химическом языке запись реакции образования воды из простых веществ, водорода (H) и кислорода (O). Маленькие цифры относятся к количеству атомов (Они стоят после символа химического элемента), большие — к количеству молекул. Из уравнения видно что две молекулы водорода соединяются с одной молекулой кислорода и в результате выходит две молекулы воды. Внимание — это очень важно понять! Соединяются именно молекулы с молекулами, не «грамм с граммом», а молекула с молекулой.
Эта пропорция сохранится всегда:
| 2 молекулы водорода | соединятся с одной молекулой кислорода | и получится | 2 молекулы воды |
| 200 молекул водорода | соединятся с 100 молекул кислорода | и получится | 200 молекулы воды |
| 2000 молекул водорода | соединятся с 1000 молекул кислорода | и получится | 2000 молекулы воды |
| 2 миллиона молекул водорода | соединятся с миллионом молекул кислорода | и получится | 2 миллиона молекул воды |
Всё бы хорошо, но есть две проблемы. Первая — в реальной жизни мы не сможем отмерить один миллион молекул кислорода или водорода. Мы сможем отмерить один грамм или одну тонну реактивов. Вторая — молекулы очень маленькие. В одном стакане воды их 6,7·10 24 штук. Или, в обычной записи 6,7 триллионов триллионов (именно так — почти семь триллионов раз по триллиону молекул). Оперировать такими цифрами неудобно.
Какой же выход? Молекулы ведь тоже имеют массу, пускай очень маленькую. Мы просто берём массу одной молекулы, умножаем на количество молекул и получаем нужную нам массу. Договорились так — берём очень большое количество молекул (600 миллиардов триллионов штук) и изобретаем для этого количества специальную единицу измерения моль. Как для 12 штук чего-либо есть специальное название «дюжина», и когда говорят о «десяти дюжинах», то имеют в виду 120 штук. 5 дюжин яиц = 60 штук. Так и с молями. 1 моль — это 600 миллиардов триллионов молекул или, в математической нотации, 6,02·10 23 молекул. То есть когда нам говорят «1 моль» водорода, мы знаем что речь идёт о 600 миллиардах триллионов молекул водорода. Когда говорят о 0,2 молях воды, то мы понимаем что речь идёт 120 миллиардах триллионов молекул воды.
Ещё раз — моль это просто такая счётная единица, только специально для молекул. Как «десяток», «дюжина» или «миллион», только гораздо больше.
Продолжая таблицу выше, можно написать:
| 2 моля водорода | соединятся с одним молем кислорода | и получится | 2 моля воды |
| 20 молей водорода | соединятся с 10 молями кислорода | и получится | 20 молей воды |
| 1000 молей водорода | соединятся с 500 молями кислорода | и получится | 1000 молей воды |
Первую проблему мы решили, писать 1 моль или 2 моля гораздо удобнее чем 600 миллиардов триллионов молекул или 1,2 триллиона триллионов молекул. Но для одного удобства не стоило огород городить. Вторая проблема, как помним, переход от количества молекул (не считать же их поштучно!) к массе вещества, к тому что мы можем отмерить на весах. Такое количество молекул в одном моле (оно ведь немного странное, некруглое — 6,02·10 23 молекул) выбрано неспроста. Один моль молекул углерода весит ровно 12 грамм.
Понятно что все молекулы разные. Есть большие и тяжелые — в них может быть много атомов, или не очень много, но зато сами атомы тяжелые. А есть маленькие и легкие молекулы. Для каждого атома и для многих молекул есть в справочниках таблицы с их молярной массой. То есть с весом одного моля таких молекул (если нет, можно легко самим посчитать, сложив молярные массы всех атомов, из которых составлена молекула). Молярная масса измеряется в грамм/моль (сколько грамм весит один моль, то есть сколько грамм весят 6,02·10 23 молекул). Мы помним ведь что моль — просто счётная единица. Ну как если бы в справочнике писали — 1 дюжина куриных яиц весит 600 грамм, а 1 дюжина страусиных весит 19 килограмм. Дюжина — просто количество (12 штук), а сами яйца, куриное или страусиное, весят по-разному. И дюжина таких или других яиц тоже по-разному весит.
Так и с молекулами. 1 моль маленьких и лёгких молекул водорода весит 2 грамма, а 1 моль больших молекул серной кислоты — 98 грамм. 1 моль кислорода весит 32 грамма, 1 моль воды — 18 грамм. Вот картинка для примера, где видны маленькие молекулы водорода и большие молекулы кислорода. Эта картинка — графическое отображение реакции 2H2 + O2 → 2H2O.
Продолжаем заполнять таблицу:
| 2 моля водорода | соединятся с одним молем кислорода | и получится | 2 моля воды |
| 4 грамма водорода (т.к. 1 моль водорода весит два грамма) | соединятся с 32 граммами кислорода | и получится | 36 грамм воды |
Видите переход от количества молекул к их массе? Видите что выполняется закон сохранения вещества? 4 грамма + 32 грамма дали 36 грамм.
Теперь мы можем решать простые задачи по химии. Вот самая примитивная: Было 100 молекул кислорода и 100 молекул водорода. Что произойдёт в результате реакции? Мы знаем что на 1 молекулу кислорода нужно 2 молекулы водорода. Поэтому прореагируют все 100 молекул водорода (и образуется 100 молекул воды), а вот кислород прореагирует не весь, ещё 50 молекул останется. Кислород в избытке.
Молекулы штуками, как я уже сказал выше, никто не считает. Вещества обычно отмеряют граммами. Теперь задача из школьного учебника: есть 10 г. водорода и 64 г. кислорода, что будет если их смешать? Мы для начала должны перевести массы в моли (то есть в количество молекул или количество вещества, как говорят химики). 10 г. водорода — это 5 моль водорода (1 моль водорода весит 2 грамма). 64 г. кислорода — это 2 моля (1 моль весит 32 грамма). Мы знаем что на 1 моль кислорода при реакции уходит 2 моля водорода. Значит, в нашем случае прореагирует весь кислород (2 моля) и 4 моля водорода из пяти. Получится 4 моля воды и ещё останется один моль водорода.
Переведём ответ снова в граммы. Прореагирует весь кислород (64 грамма) и 8 грамм водорода (4 моля * 2 г/моль). 1 моль водорода останется не прореагировавшим (это 2 грамма) и получится 72 грамма воды (4 моля * 18 г/моль). Закон сохранения вещества опять выполняется — 64 + 10 = 72 + 2.
Думаю что теперь уже всем должно быть понятно. 1 моль — просто количество молекул. Молярная масса — это масса одного моля. Она нужна для того чтобы переходить от массы вещества (с которой мы работаем в реальном мире) к количеству молекул, или количеству вещества, нужному для реакций.
а) вещества реагирует в соотношении n молекул одного к m молекул другого. Это пропорция будет одинаковой и для 100 молекул исходного вещества, и для ста триллионов, или для ста триллионов триллионов.
б) для удобства, чтобы не считать молекулы штуками, придумали специальную счётную единицу — моль, то есть сразу 6,02·10 23 молекул. Количество этих молей называют обычном «количество вещества»
в) моль каждого вещества весит по-разному, т.к. молекулы и атомы, из которых состоит вещества, сами весят по-разному. Масса одного моля вещества называется его молярной массой. Ещё один пример — обычные и силикатные кирпичи весят по-разному. Если мы проведём аналогию, то «вес тысячи кирпичей» — это «молярная масса» (с тем отличием что молекул не 1000, а больше). Масса этой «тысячи кирпичей» разная для силикатных и обычных кирпичей.
г) весь этот огород городим для того чтобы легко можно было переходить от массы реактивов к количеству вещества (количеству молекул, количеству молей) и обратно. А переходить туда/обратно нужно потому что в реальном мире мы отмеряем реактивы граммами, а химические реакции идут пропорционально не массе, а количеству молекул.
Что мне не нравилось в учебниках — только формальное определение моля, без указания смысла этого понятия и для чего это нужно.









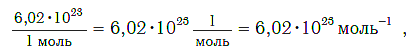
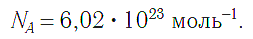
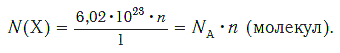
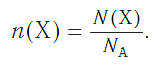






 chva
chva