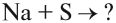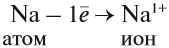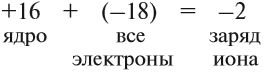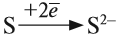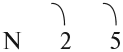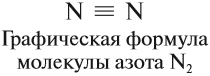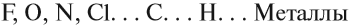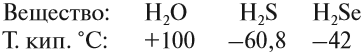как узнать ионную связь
Химические связи
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
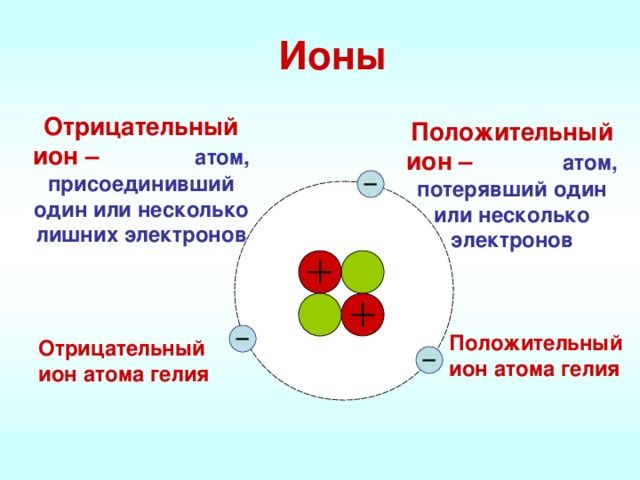
Ионная связь.
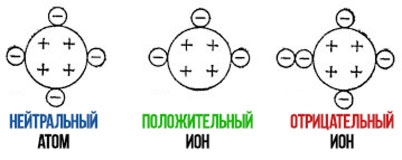
Ионная связь – химическая связь, образованная электростатическим притяжением между катионами и анионами.
Катионы – положительно заряженные ионы, образующийся в результате отдачи атомом электрона (например, K 



Анион – отрицательно заряженный ион, образующийся в результате приобретения атомом электрона (Cl 



По значению заряда ионы подразделяются на:
В образовании ионной связи участвуют атомы металлов и неметаллов. Образование таких соединений получается из атомов, резко отличающихся по значению электроотрицательности в результате перехода электронов от атомов одних элементов, к другим.
При образовании ионной связи атом неметалла принимает электроны на внешний энергетический уровень и достраивает его до устойчивой конфигурации с восьмью электронами (правило октета).
Рассмотрим механизм образования ионной связи на примере. Реакция образования хлорида натрия: атом щелочного металла теряет электрон (образуется катион натрия), а атом галогена – приобретает (образуется хлорид-ион). Ионы образуют соединение за счет электростатического притяжения между ними.
Для ионной связи характерно:
Пример. Схема образования ионного соединения:



Ионная химическая связь
Общая характеристика ионной химической связи
Ионы – это частицы, имеющие заряд, в которые превращаются атомы в процессе отдачи или принятия электронов. Притягиваются они друг к другу довольно сильно, именно по этой причине у веществ с таким типом связи высокие температуры кипения и плавления.
Ионная связь – химическая связь между разноименными ионами, обусловленная их электростатическим притяжением. Ее можно считать предельным случаем ковалентной связи, когда разность электроотрицательностей связанных атомов так велика, что происходит полное разделение зарядов.
Рис. 2. Ионная химическая связь.
Обычно считается, что связь приобретает электронный характер, если ЭО >1,7.
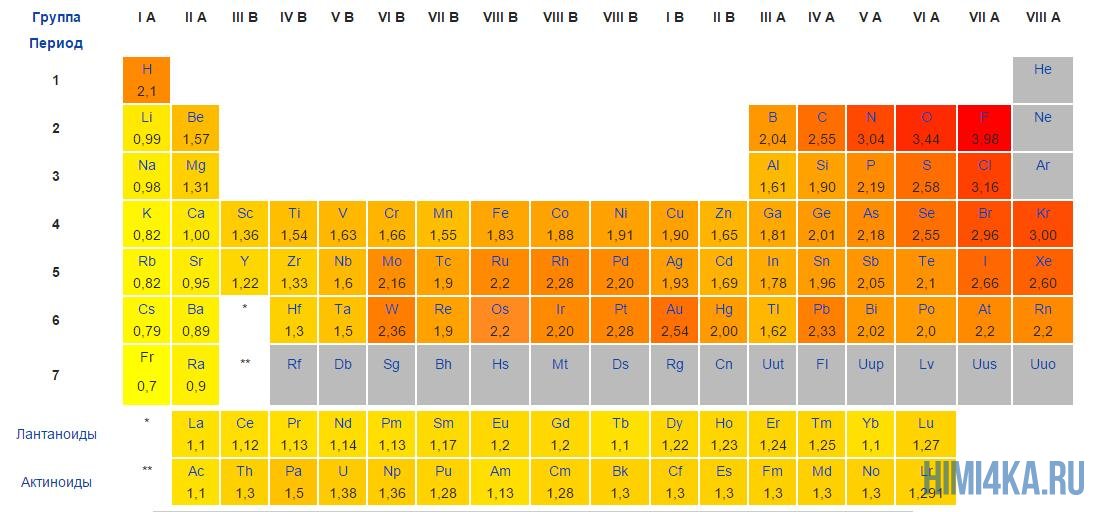
Различие в значении электроотрицательности тем больше, чем дальше элементы расположены друг от друга в периодической системе по периоду. Эта связь характерна для металлов и неметаллов, особенно расположенных в наиболее удаленных группах, например, I и VII.
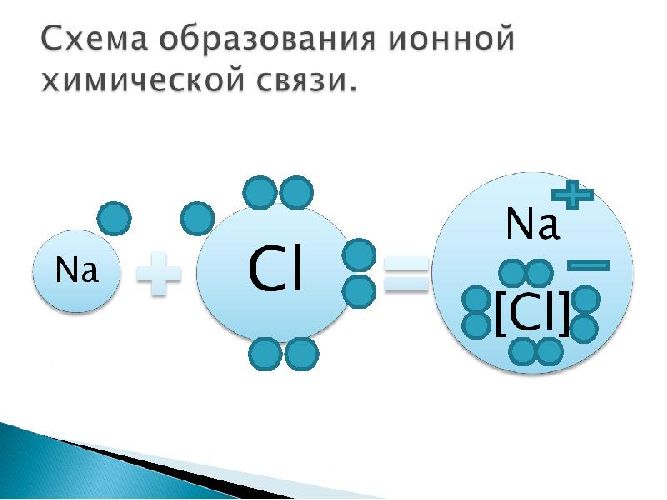
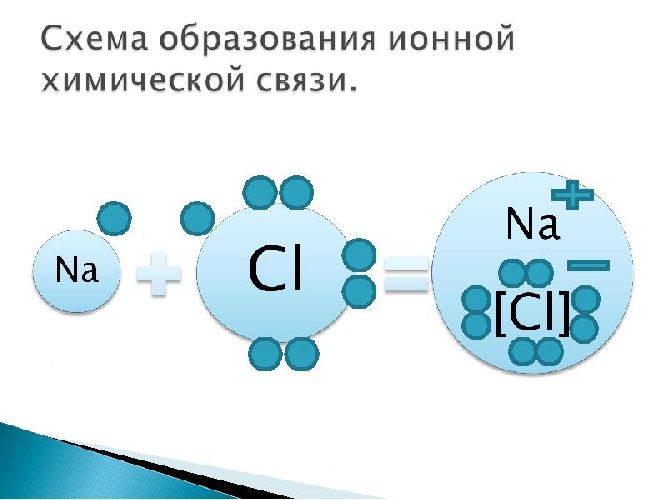
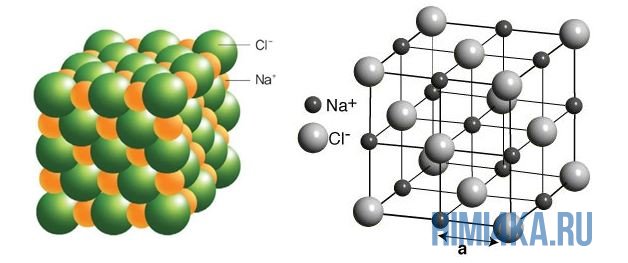
Пример: поваренная соль, хлорид натрия NaCl:
Рис. 3. Схема ионной химической связи хлорида натрия.
Ионная связь существует в кристаллах, она обладает прочностью, длиной, но не насыщена и не направлена. Ионная связь характерна только для сложных веществ, таких как соли, щелочи, некоторые оксиды металлов. В газообразном состоянии такие вещества существуют в виде ионных молекул.
Ионная химическая связь образуется между типичными металлами и неметаллами. Электроны в обязательном порядке от металла переходят к неметаллу, образуя ионы. В результате образуется электростатическое притяжение, которое называют ионной связью.
На самом деле полностью ионной связи не встречается. Так называемая ионная связь носит частично ионный, частично ковалентный характер. Однако связь сложных молекулярных ионов может считаться ионной.
Примеры образования ионной связи
Можно привести несколько примеров образования ионной связи:
– кальцию легче отдать два электрона, чем получить недостающие.
– фтору, наоборот, легче принять один электрон, чем отдать семь электронов.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2. Определим число атомов фтора, которые примут два электрона от атома кальция: 2 : 1 = 2. 4.
Составим формулу ионной химической связи:
– натрий находится в главной подгруппе первой группы. Он с легкостью может отдавать один электрон.
– кислород находится в главной подгруппе шестой группы. Естественно, что ему легче получить два электрона, чем отдать шесть.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2 : 1 = 2. Определим число атомов натрия, которые отдадут два электрона атому кислорода: 2. 4.
Составим схему образования ионной связи:
Что мы узнали?
Ионная связь и ионы изучаются в 11 классе. Ионная химическая связь – связь между положительными и отрицательными ионами, осуществляемая между металлами и неметаллами.
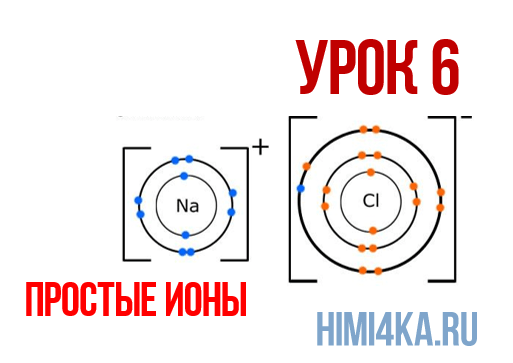
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
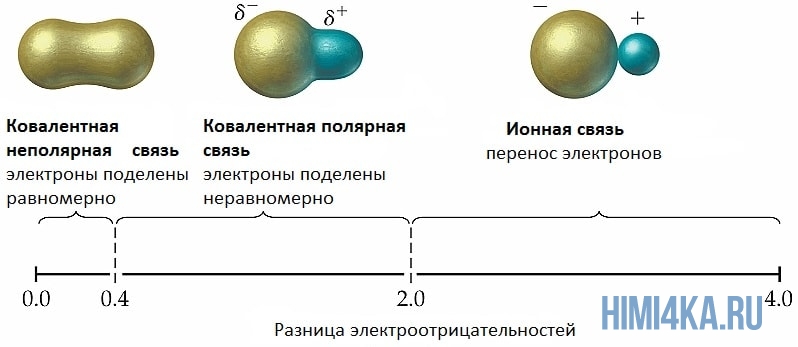
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 4. Понятие о химической связи
В предыдущих уроках данного курса есть много рассуждений о том, что вещество состоит из молекул, что молекулы состоят из атомов. А не возникал ли у вас вопрос: почему атомы, составляющие молекулу, не разлетаются в разные стороны? Что удерживает атомы в молекуле?
Их удерживает химическая связь.
Химическая связь — совокупность сил, которые удерживают атомы в молекуле или кристалле.
Для того чтобы понять природу химической связи, достаточно вспомнить простой физический опыт. Два шарика, висящие рядом на ниточках, никак не «реагируют» друг на друга. Но если придать одному шарику положительный заряд, а другому — отрицательный, они притянутся друг к другу. Не эта ли сила притягивает атомы друг к другу? Действительно, исследования показали, что химическая связь имеет электрическую природу.
Откуда же возникают заряды в нейтральных атомах?
Ионная связь
При описании строения атомов было показано, что все атомы, за исключением атомов благородных газов, стремятся присоединить или отдать электроны. Причина — образование устойчивого восьмиэлектронного внешнего уровня (как у благородных газов). При приёме или отдаче электронов возникают электрические заряды и, как следствие, электростатическое взаимодействие частиц. Так возникает ионная связь.
Ионная связь — это связь между ионами.
Ионы — это устойчивые заряженные частицы, которые образуются в результате приема или отдачи электронов.
Например, в реакции участвует атом активного металла и активного неметалла:
В этом процессе атом металла (натрия) отдаёт электроны (рис. 14).
Таким образом, в этом процессе образовалась устойчивая частица (8 электронов на внешнем уровне), которая имеет заряд, так как у ядра атома натрия заряд по-прежнему +11, а оставшиеся электроны имеют суммарный заряд –10. Поэтому заряд иона натрия +1. Кратко запись этого процесса выглядит так:
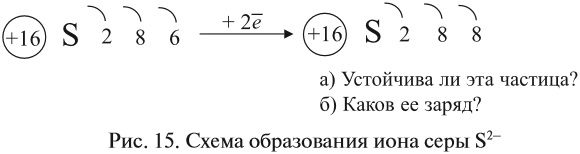
Что происходит с атомом серы? Этот атом принимает электроны до завершения внешнего уровня (рис. 15).
Простой подсчёт показывает, что эта частица имеет заряд:
Разноименно заряженные ионы притягиваются, в результате чего возникает ионная связь и «ионная молекула»:
Существуют и другие способы образования ионов (см. урок 6).
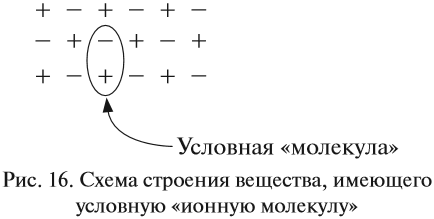
Формально сульфиду натрия приписывают именно такой состав молекулы, хотя вещество, состоящее из ионов, имеет приблизительно такое строение (рис. 16).
Таким образом, можно сказать определённо, что вещества, состоящие из ионов, не содержат отдельных молекул! В этом случае можно говорить лишь об условной «ионной молекуле».
Задание 4.1. Покажите, как происходит переход электронов при возникновении ионной связи между атомами:
Помните! Атом металла отдаёт внешние электроны; атом неметалла принимает недостающие электроны.
Вывод. Ионная связь по описанному выше механизму образуется между атомами активных металлов и активных неметаллов.
Ковалентная связь
Исследования, однако, показывают, что полный переход электронов от одного атома к другому происходит далеко не всегда. Очень часто химическая связь образуется не при отдаче-приёме электронов, а в результате образования общих электронных пар*. Такая связь называется ковалентной.
* Эти электронные пары возникают в месте пересечения электронных облаков.
Ковалентная связь образуется в месте перекрывания электронных облаков* обоих атомов.
* Электронное облако — область пространства, где нахождение электрона наиболее вероятно.
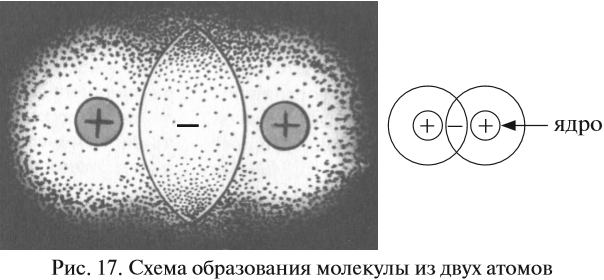
Такая связь образуется, например, между атомами неметаллов. Возникает вопрос: каким образом область пересечения электронных облаков может связывать атомы? Рассмотрим динамическую модель этого явления, т. е. процесс возникновения ковалентной связи. Предположим, два атома сблизились на достаточно близкое расстояние.
Вопрос. Какие силы возникли между атомами?
Поскольку вокруг ядер атомов расположены отрицательно заряженные электроны, между атомами возникают силы отталкивания. Но если атомы обладают достаточной энергией, их электронные облака перекрываются (см. рис. 17.).
В этой области пространства возникает избыточный отрицательный заряд. А ядра атомов, как известно, имеют положительный заряд. Таким образом, ядра обоих атомов притягиваются к общему отрицательному заряду, который возник благодаря пересечению электронных облаков. Поэтому:
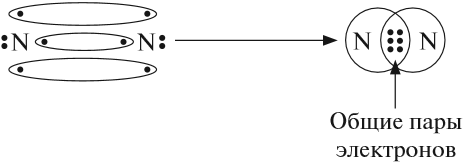
В месте перекрывания электронных облаков образуются общие электронные пары. Рассмотрим, как возникает ковалентная связь в молекуле азота N2. Для этого рассмотрим строение атома азота:
Вопрос. Сколько электронов не хватает до завершения внешнего уровня?
Не хватает трёх электронов. Поэтому, обозначив каждый электрон внешнего уровня точкой, получим:
Вопрос. Почему три электрона обозначены одиночными точками?
Дело в том, что мы хотим показать образование общих пар электронов. А пара — это два электрона. Такая пара возникает, в частности, если каждый атом предоставит по одному электрону для образования каждой пары (1 + 1 = 2). Атому азота не хватает трёх электронов до завершения внешнего уровня. Значит, он должен «приготовить» три одиночных электрона для образования будущих пар.
Получена электронная формула молекулы азота, при помощи которой показано, что:
Каждая общая пара электронов соответствует одной ковалентной связи. Сколько ковалентных связей возникло? Три. Каждую связь (каждую общую пару электронов) покажем при помощи чёрточки (валентный штрих):
Эта графическая формула показывает, что атом азота в молекуле N2 — трёхвалентен, так как валентность — это способность атома образовывать определённое число ковалентных химических связей.
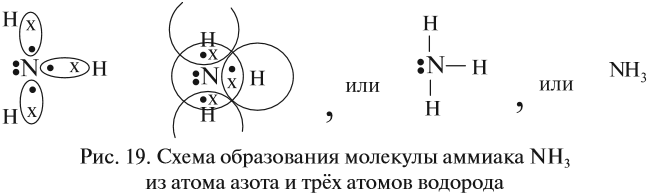
Может ли возникнуть такая связь между разными атомами? Может. Пусть атом азота взаимодействует с атомами водорода:
Строение атома водорода показывает, что этот атом имеет один электрон. Сколько таких атомов нужно взять, чтобы атом азота «получил» «желаемое» — три электрона? Очевидно, три атома водорода (рис. 19).
Крестиком (х) обозначены электроны атома водорода. Электронная формула молекулы аммиака показывает, что у атома азота стало восемь электронов, а у каждого атома водорода получилось по два электрона (а больше на первом энергетическом уровне и быть не может).
Графическая формула показывает, что атом азота имеет валентность три (три чёрточки, или три валентных штриха), а каждый атом водорода — валентность один (по одной чёрточке).
Значит, атом азота в этих молекулах (N2 и NН3) трёхвалентен. Поскольку пара электронов может образовываться из неспаренных электронов обоих атомов, то валентность атома часто соответствует числу неспаренных электронов. Например, в атоме азота 3 неспаренных электрона, поэтому валентность атома азота (в молекуле азота) равна III.
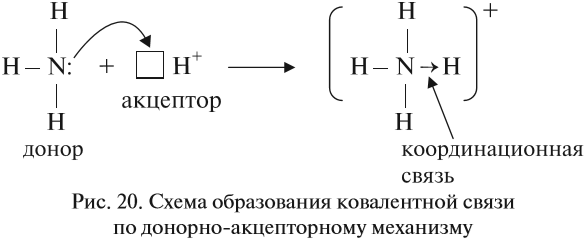
Казалось бы, атом азота не может иметь бОльшую валентность, так как в образовании химической связи задействованы все неспаренные электроны. Но у атома азота осталась «лишняя» неподелённая пара электронов, которая не участвовала в образовании ковалентных связей.
Если ковалентная связь образуется с участием атома, который имеет «собственную» пару электронов (2), то второй атом должен иметь свободную орбиталь (0):
В этом случае атом, имеющий пару электронов (донор), передаёт её на свободную орбиталь второго атома (акцептора). Рассмотрим механизм образования ковалентной связи по донорно-акцепторному механизму:
В полученном катионе аммония валентность атома азота равна IV.
Отметим, что валентность IV для атома азота — максимально возможная. Дело в том, что ковалентные связи образуются за счёт пересечения электронных облаков. А сколько таких электронных облаков в атоме азота? Четыре (одно s— и три р-облака). Поэтому и образуются 4 ковалентные связи. И не больше!
Ковалентная связь может быть полярной и неполярной. Полярность ковалентной связи определяется электроотрицательностью атомов её образующих. Электроотрицательность — способность атома смещать к себе общую пару электронов. Максимальную электроотрицательность (ЭО) имеет фтор 4,1. Далее значение ЭО уменьшается в ряду:
Хотя в состав обеих молекул N2 и NН3 входит один и тот же атом азота, химические связи между атомами отличаются друг от друга. В молекуле азота N2 химические связи образуют одинаковые атомы, поэтому общие пары электронов находятся посередине между атомами. Атомы сохраняют нейтральный характер. Такая химическая связь называется неполярной.
В молекуле аммиака NH3 химическую связь образуют разные атомы. Поэтому один из атомов (в данном случае — атом азота) сильнее притягивает общую пару электронов, так как имеет бОльшую ЭО. Общие пары электронов смещаются в сторону атома азота, и на нём возникает небольшой отрицательный заряд, а на атоме водорода — положительный (рис. 21).
Задание 4.2. Определите, какая химическая связь осуществляется между атомами в веществах:
Задание 4.3. Составьте электронные и графические формулы для тех веществ из упражнения 4.2, в которых вы определили наличие в них ковалентной связи. Для ионной связи составьте схемы перехода электронов.
Химическая связь и агрегатные состояния вещества. Кристаллические решётки
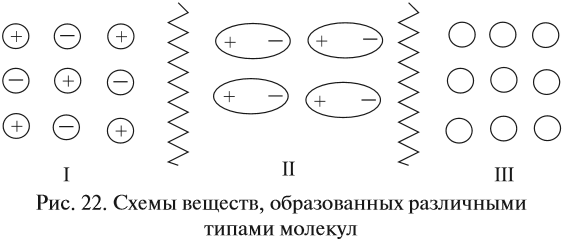
Тип химической связи влияет на свойства вещества, на его поведение в растворах. Так, чем больше, значительнее притяжение между частицами, тем труднее их оторвать друг от друга, тем труднее перевести твёрдое вещество в газообразное или жидкое состояния. Попробуйте определить, между какими частицами больше силы взаимодействия.
Если силы притяжения частиц значительны (притяжение разноимённо заряженных ионов), то частицы колеблются вблизи положения равновесия, а перемещаться не могут, что обусловливает сохранение формы и объёма. Максимальное взаимодействие между частицами осуществляется в случае I (ионная связь). Такие вещества находятся в твёрдом состоянии. Все вещества, построенные по ионному типу, — твёрдые. Среди веществ с ионной структурой ни жидких, не газообразных веществ нет! Для таких веществ характерно особое внутреннее строение — кристаллическая решётка:
От типа кристаллической решётки, которая формируется в твёрдом состоянии, зависят многие физические свойства вещества. В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решёток: ионные, атомные, молекулярные и металлические.
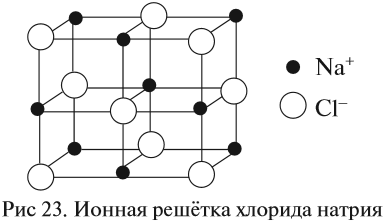
Кристаллические решётки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служить кристалл поваренной соли (хлорида натрия), в котором каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия. Очень часто кристаллические решётки изображают, как показано на рис. 23, где указывается только взаимное расположение частиц, но не их размеры.
Такие вещества обладают твёрдостью, тугоплавкостью, их расплавы проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде, хотя бывают и исключения.
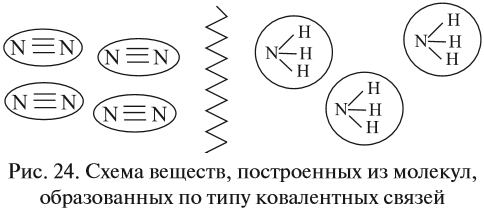
Большинство веществ, построенных при помощи ковалентной связи, состоят из отдельных молекул (рис. 24).
К таким веществам относятся спирты, сахара и большинство органических соединений. Поэтому, если такое вещество станет твёрдым, то эти молекулы образуют молекулярную кристаллическую решётку, т. е. в узлах её находятся молекулы.
Кристаллические решётки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решётках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решёткой имеют малую твёрдость и низкие температуры плавления, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решёткой невелико: вода, кислоты.
Кристаллические решётки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решётках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами:
Весь кристалл алмаза следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием, а также кварца — чистого оксида кремния. Такие вещества очень прочные и тугоплавкие. Они нерастворимы в воде и прочих растворителях.
Металлы образуют металлическую кристаллическую решётку. Свойства таких веществ рассмотрены в уроке 8 данного Самоучителя.
Задание ЕГЭ. К числу веществ молекулярного строения относятся: 1) древесный уголь; 2) кварц; 3) лёд; 4) известняк. Укажите тип кристаллической решётки в остальных веществах.
Наименьшее взаимодействие между незаряженными частицами (рис. 22, случай III), поэтому между молекулами вещества с неполярной ковалентной связью силы притяжения ничтожны. В этом случае молекулы свободно двигаются во всех направлениях, вещество находится в газообразном состоянии *.
Подробнее о газах рассказано в уроке 30.1 данного Самоучителя. Там же рассматриваются способы решения задач по теме «Газы».
Следовательно, вещества, состоящие из неполярных молекул или молекул с неполярными связями, являются газами или летучими жидкостями. Среди веществ такого типа только йод является твёрдым (при нормальных условиях) из-за высокой массы молекул, но он легко возгоняется, переходя из твёрдого состояния сразу в газообразное состояние.
У полярных молекул (диполей) межмолекулярные взаимодействия многократно сильнее, поэтому частицы могут перемещаться «на один шаг», соблюдая ближний порядок, что обусловливает текучесть жидкости. Впрочем, молекулы с полярными связями могут быть и газообразными, и твёрдыми.
Агрегатное состояние в этом случае (при прочих равных условиях) обычно зависит:
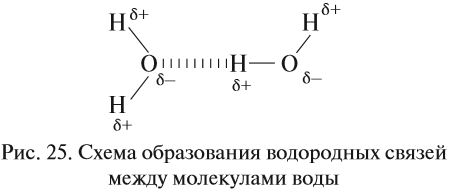
Водородные связи возникают за счёт сильно полярных связей, содержащих атом водорода: N–H, O–H, F–H.
В таких случаях на атомах возникают довольно значительные заряды (δ+) и (δ–) (но всё же меньше единицы!), и атомы (а, значит, и молекулы в целом) притягиваются друг к другу. Атом водорода имеет очень маленький радиус и может частично «внедряться» в электронное облако соединённого атома:
Поэтому все молекулы воды оказываются связанными бесчисленными водородными связями. В результате на разрыв всех этих связей требуется затратить очень много энергии (например, при испарении воды). Поэтому вода имеет аномально высокую температуру кипения:
Если рассуждать логически, опираясь на положение кислорода в периодической системе, экстраполировать параметры в системе Н2О — H2S — H2Se — H2Тe, то у воды как самого лёгкого водородного соединения шестой группы должна быть температура кипения около –80 °C! А на самом деле? А на самом деле она намного выше: +100 °C.
Выводы. Таким образом, агрегатное состояние веществ (температуры кипения и плавления) зависит: