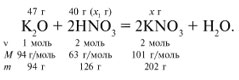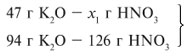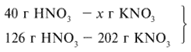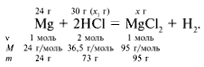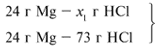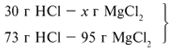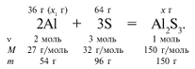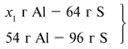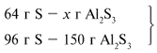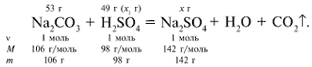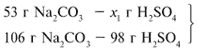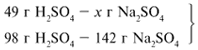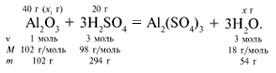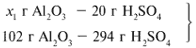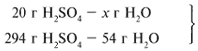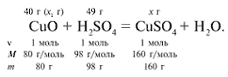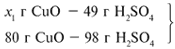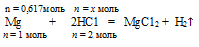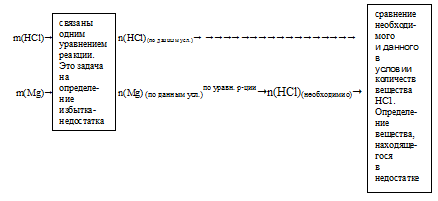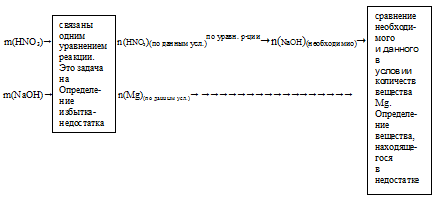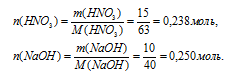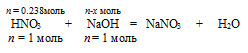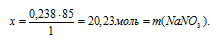как узнать избыток или недостаток
Химия, Биология, подготовка к ГИА и ЕГЭ
Задачи такого типа (точнее, это может быть даже не самой задачей, а частью задачи) есть в части С ГИА, они входят в часть С ЕГЭ, теперь они появились и в части B.
Классический пример задачи на избыток и недостаток.
Этапы решения задачи:
1. Записываем уравнение реакции и уравниваем его:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(Cu) = m\Ar =3.2 г \ 63.5 г\моль = 0,05 моль
m(Hg(NO3)2) = m\Mr = 20 \ 324 = 0,06 моль
3. Сравниваем количество моль веществ и определяем недостаток:
по уравнению реакции меди и нитрат ртути реагируют 1:1, значит, их количество моль тоже должно быть одинаковым
0,05 моль ПО НЕДОСТАТКУ
Почему по недостатку? Это аналогично вопросу — «сколько целых яблок можно сложить из 5 половинок? «
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
0,05 моль ——> 0,05 моль
m(Hg)= n*Ar = 0,05 моль * 200 г\моль = 10 г
______________________________________________________________________________________
Пример задачи на избыток и недостаток,
где вещества в другом соотношении:
те же самые этапы решения:
1. Записываем уравнение реакции и уравниваем его:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(N2 ) = m\Mr = 14\28=0.5 моль
3. Сравниваем количество моль веществ и определяем недостаток:
в этом уравнении все не так очевидно, как в предыдущем, поэтому нужно просто прикинуть:
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
m(N2O5) = n*Mr = 2* 0.5\5 моль * 108 г\моль = 21 г
______________________________________________________________________________________
Есть задачи, очень похожие на задачи избыток-недостаток,
1. Записываем уравнение реакции и уравниваем его:
здесь у нас возможно 2 варианта — образование средней и кислой соли:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(CO2 ) = V\22.4 л\моль = 24.9 \ 22.4 = 1,11 моль
n(NaOH)= m\Mr = 44.4\40 = 1,11 моль
т.к. количество моль веществ одинаково, то делаем вывод, что реакция протекает по схеме образования кислой соли:
4. Вычисляем массу продукта по количеству моль:
m ( NaHCO3) = n*Mr = 1,11 * 84 = 93,24 г
_____________________________________________________________________________________ _
Задачи на избыток и недостаток не трудные, зачастую они являются частью более сложных задач, поэтому все, что нужно сделать, это натренироваться — порешать как можно больше таких примеров, внимательно уравнивая и работая с коэффициентами.
Методика решения задач
на «избыток–недостаток»
в курсе основной
общеобразовательной школы
Умение решать химические задачи – важная составляющая знаний по предмету. Согласно государственному стандарту образования по химии учащиеся, оканчивающие школу, должны уметь решать более десятка типов стандартных задач. Среди них и задачи на «избыток–недостаток».
Предлагаю свой вариант подачи материала по решению таких задач в курсе химии 9-го класса.
На изучение этой темы отвожу 2–2,5 урока, в зависимости от уровня способностей учеников класса. Ознакомление с алгоритмом решения задач данного типа происходит в рамках изучения темы «Теория электролитической диссоциации». Однако если класс сильный, то в рамках эксперимента этот тип задач иногда изучаем и в конце 8-го класса в главе «Галогены», а высвободившееся время можно потратить на изучение органической химии в курсе 9-го класса.
На первом уроке разбираю два типа задач на «избыток–недостаток»:


В качестве домашнего задания обязательно предлагаются две-три задачи, подобные изученным на уроке.
На втором уроке закрепляю и углубляю изученный материал, ввожу понятия «процентная концентрация растворов веществ», вступивших в реакцию, «плотность растворов». Кроме того, усложняю задачи, вводя «процентное содержание примесей в исходном веществе» и т. д. Такой прием позволяет повторить элементы уже изученного материала, сэкономить время. В конце второго урока изучения темы или в начале третьего провожу небольшую самостоятельную работу на закрепление изученного материала, включающую одну-две задачи, причем самостоятельная работа предлагается в трех уровнях сложности, в зависимости от способностей ученика.
Урок 1
Решение задач на «избыток–недостаток»
ХОД УРОКА

Решая химические задачи, следует не забывать о правилах их грамотного оформления по схеме: дано, найти, решение, ответ.
ЗАДАЧА 1. На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Для удобства расчета за х1 примем массу НNО3 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
Следовательно, азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету необходимо 63 г, поэтому расчет ведем по HNO3:
ЗАДАЧА 2. На 24 г металлического магния подействовали 100 г 30%-го раствора соляной кислоты. Найдите массу образовавшегося хлорида магния.
m(Mg) = 24 г,
m(р-р HCl) = 100 г, 
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Для удобства расчета за х1 примем массу соляной кислоты и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
Из расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по соляной кислоте:

ЗАДАЧА 1. На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося сульфида алюминия.
Решение
Примем массу Al за х1 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
В данном случае вещества, вступившие в реакцию, взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
ЗАДАЧА 2. На раствор, содержащий 53 г карбоната натрия, подействовали раствором, содержащим 49 г серной кислоты. Найдите массу образовавшейся соли.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Примем за х1 массу cерной кислоты, чтобы узнать, какое вещество дано в избытке, какое – в недостатке.
В данном случае оба вещества взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
Однако учитель, подбирая задачи для решения в классе, должен помнить, что в некоторых случаях (например, если кислота или кислотный оксид дан в избытке) решение задачи не ограничивается расчетом двух пропорций, т. к. реакция будет протекать дальше с образованием кислой соли. Это повысит сложность материала. На первых уроках при решении задач данного типа я не включаю в материал задачи на прохождение реакций с образованием кислых или основных солей.
Домашнее задание
ЗАДАЧА 1. На 200 г 10%-го раствора серной кислоты подействовали 40 г оксида алюминия. Найдите массу образовавшейся воды.
M(р-р H2SO4) = 200 г, 
m(Al2O3) = 40 г.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Найдем, какое из вступивших в реакцию веществ дано в избытке, а какое – в недостатке.
Из расчета видно, что Al2O3 дан в избытке, следовательно, расчет ведем по кислоте:
ЗАДАЧА 2. На 40 г оксида меди(II) подействовали раствором серной кислоты, содержащим 49 г безводного вещества. Найдите массу образовавшейся соли.
Решение
Найдем, какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
Cогласно уравнению данной реакции вещества взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
Алгоритм определения избытка и недостатка
Задача 4.
В раствор, содержащий 18 г НС1, добавили 15 г Мg. Определите, какое из веществ в избытке.
Дано:
масса хлороводорода: m(НС1) = 18 г;
масса магния: m(Мg) = 15 г.
Найти:
вещество, находящееся в избытке.
Решение:
1. Все данные об исходных участниках реакции из условия задачи переводим в количество вещества.
2. Записываем уравнение реакции и уравниваем его:
Мg + 2НС1 = МgС12 + Н
n = 1 моль n = 2 моль
По коэффициентам в уравнении реакции определяем соотношение количеств веществ интересующих нас исходных реагентов.
В рассматриваемом случае из уравнения следует, что на полное растворение 1 моль Мg необходимо 2 моль НС1.
3. За основу выбираем одно из исходных веществ участников реакции (любое), по которому известны количественные данные (из первого пункта этого плана). В данном случае это будет либо Мg, либо НС1. Выберем за основу Mg. Далее, используя уравнение реакции и количественные данные по выбранному веществу, рассчитываем количество другого исходного вещества, которое необходимо для полного расходования выбранного вещества.В этой задаче нам придется рассчитать количество НС1, которое необходимо для полного расходования 0,617 моль Мg.
Составляем пропорцию:
на 0,617 моль Мg должно расходоваться х моль НС1 (по условию)
на 1 моль Мg полностью расходуется 2 моль НС1 (по уравнению р-ии)

4. Сравнение полученного по пропорции значения количества вещества с данными из условия. Выявление вещества, взятого в избытке, и вещества, взятого в недостатке.
| Количество вещества НС1, которое должно расходоваться для полного растворения всего дан- ного в условии Мg (необходимое количество, определено в третьем действии). | Количество вещества НС1, которое реально дано в условии и участву ет в реакции (из условия задачи, определено в первом действии). |
| 1,234 моль > 0,493 моль | |
Из сравнения видно, что для полного растворения Мg требуется большее количество вещества НС1, чем дано в реальности. Следовательно, НС1 находится в недостатке, а Мg — в избытке.
При использовании таких количеств реагентов, которые указаны в условии данной задачи, НС1 расходуется полностью, а М§ будет израсходован не весь, и часть его останется после реакции.
Ответ: В избытке взят магний.
Схематично алгоритм определения избытка и недостатка для последней задачи можно выразить следующим образом:
В третьем действии решения мы могли выбрать за основу и НС1. Схема решения была бы немного другой, но ответ получился бы тот же:
Задача 5.
Раствор, содержащий 15 г НNО3, смешали с раствором, содержащим 10 г гидроксида натрия. Определите массу образовавшейся соли.
Дано:
масса азотной кислоты: m(НNО3) = 15 г;
масса гидроксида натрия: m(NаОН) = 10 г.
Найти:
массу образовавшейся соли.
Решение:
Запишем схематично алгоритм решения.
1. Определяем количество веществ НNO3 и NаОН
2. Выберем за основу НNO3 и определим по уравнению реакции количество NаОН, которое необходимо для расходования 0,238 моль НNO3.
Составляем пропорцию:
на 0,238 моль НNO3 должно расходоваться х моль NаОН (по усл.)
на 1 моль НNO3 полностью расходуется 1 моль МаОН (по уравн. р-ции)
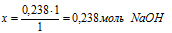
3. Определим, какое вещество в недостатке.
| n(NаОН) необходимо | n(NаОН) дано по условию |
| 0,238моль | |
Гидроксид натрия находится в избытке и расходуется не весь в процессе реакции. Поэтому дальнейшие расчеты по уравнению реакции будем проводить, используя данные по НNO3.
4. По уравнению реакции определяем массу полученной соли.
Составляем пропорцию:
0,238 моль НNO3 дают х г NaNO3 (по данным условия)
1 моль НNO3 дают 85 г NaNO3 (по уравнению реакции)
Ответ: m(NаNО3) = 20,23 г.
Как распознать симптомы дефицита и избытка жизненно важных витаминов
Главным источником витаминов и микроэлементов должен служить рацион, однако далеко не всегда человеку удается сбалансированно питаться, чтобы насытить организм необходимыми веществами. Дефицит витаминов – авитоминоз – нарушает практически все функции организма, но это редкое заболевание в современном мире. Такой диагноз ставит только врач после обследования. По этой и многим другими причинам нельзя самостоятельно назначать курс витаминов во время мнимого «весеннего авитоминоза».
Чтобы разобраться, в чем проявляется норма и недостаток витаминов в организме и нужно ли принимать синтетические витамины (поливитамины, витамины определенной группы) обычному человеку поговорим с экспертом лаборатории персонифицированной медицины ЛабКвест Ириной Валентиновной Мартиросовой.
Витамин С
Наиболее ярким примером авитоминоза служит диагноз цинга. Эта «болезнь моряков» в прошлом была связана с дефицитом витамина С из-за скудного рациона. Сегодня дойти до такого состояния достаточно сложно, однако обо всем по порядку.
Витамин С отвечает за защитные функции организма. Он усиливает иммунный ответ в ответ на чужеродный патоген в организме, участвует в росте и развитии тканей, способствует заживлению ран.
Наиболее богатыми источниками витамина С считается: зелень, шиповник, зеленые овощи, цитрусовые, томаты, картофель.
Недостаток этого витамина проявляется выпадением волос, сухостью и бледностью кожи, воспалительными процессами в полости рта и кровоточивостью десен, повышенной утомляемостью, хрупкостью костей, усиленной склонностью с вирусам и инфекциям и другими последствиями.
Устоявшийся миф о необходимости принимать аскорбиновую кислоту практически в любых количествах может привести к избытку витамина, который не менее опасен, чем дефицит. Он нередко сопровождается похожими симптомами, вызванными недостатком витамина, к которым также добавляются острые проблемы с желудочно-кишечным трактом и предрасположенность к образованию камней в почках. Однако все эти признаки могут проявиться у человека, который действительно «перебрал» с витамином С из баночки. Вообще, избыток витамина организм старается выводить самостоятельно с калом и мочей.
Витамин D
Витамин D – наиболее «противоречивый», поскольку нередко в исследованиях и метаанализах ученые приводят противоречащие выводы о пользе или даже бесполезности синтетического витамина.
Витамин D – прогормон, который участвует в различных биохимических процессах организма. Он необходим для нормальной функции иммунной системы, профилактики сердечно-сосудистых и аутоиммунных заболеваний, является онкопротектором.
Различают витамин D2 и D3. Первая форма витамина содержится в пище, а вторая образуется в коже из D2 под воздействием солнечного света.
Избыток витамина для жителей России труднодостижим, поэтому врачи часто рекомендуют прием синтетического витамина в течение всего года взрослым и детям. О дозах необходимо проконсультироваться со специалистом.
Витамин В12
Основным источником витамина В12 являются продукты животного происхождения, поэтому люди, которым по тем или иным причинам исключили из рациона мясо, рыбу и молочные продукты, находятся в повышенной группе риска.
Витамин имеет жизненно важное значение для кроветворения и нервной системы, он участвует в синтезе компонентов ДНК.
Недостаток В12 проявляется слабостью, головокружениями и шумом в ушах, повышенной раздражительностью, снижением памяти, признаками депрессии. Избытку сопутствует крапивница, а по некоторым данным и проблемы с кожей, включая прыщи и акне. У людей могут возникать аллергические реакции, наблюдаться повышенная возбудимость. Есть и другие симптомы, однако о них можно узнать из лабораторных исследований.
Витамин В9 или фолиевая кислота
Этот витамин обычно назначается в тандеме с В12 для синергетического эффекта. Фолиевая кислота также необходима для иммунной и кровеносной систем, участвует в образовании новых клеток, нужна для здорового метаболизма.
Недостаток проявляется неврологическими симптомами – тревожностью, агрессией, повышенным чувством страха, а также способствует риску развития панических атак и депрессии. На фоне избытка также сохраняется агрессия и повышенная возбудимость, появляются симптомы нарушения пищеварения.
Беременным женщинам и молодым мамам дополнительный прием В9 необходим в течение длительного времени. Остальным людям, как впрочем и беременным женщинам, показан контроль и рекомендации специалиста.
Витамин А
Провитамин А – мощный антиоксидант, защищает от сердечно-сосудистых заболеваний, является онкопротектором, необходим для иммунной и репродуктивной систем организма.
Недостаток витамина также легко определить по внешним факторам, которые тем не менее перекликаются с симптомами дефицита других витаминов. К недостатку бета-каротина относят: сухость кожи и глаз, выпадение волос, проблемы со зрением (развитие «куриной слепоты»), кожные заболевания, нарушения развития скелетной ткани и другие проблемы.
На избыток витамина А, в первую очередь, следует обратить внимание курильщиков, поскольку он повышает риск развития злокачественных опухолей. Симптомы переизбытка могут быть разными, однако к главным относят: выпадение волос и облысение, нарушение аппетита, кожные воспаления, диарею, повышенную усталость, мышечные боли.
Грамотный подход к приему витаминов
Витамины должен назначать врач – аксиома, которая постоянно требует доказательств среди россиян. Мы привыкли покупать поливитамины весной или какую-то конкретную баночку с синтетическим витамином по чьему-либо совету, однако это в корне неверно.
Человек может нести недостаток одного витамина и переизбыток другого, поэтому поливитамины могут быть для него вредными. Еще, прием одной группы витаминов может нейтрализовать другую, и тогда это потерянное время и деньги.
Врачи подчеркивают, что необязательно сдавать комплексные анализы на статус запаса витаминов в организме. Человеку необходимо проконсультироваться с терапевтом, который выслушает жалобы, осмотрит и уже потом порекомендует конкретные лабораторные исследования. А возможно, просто посоветует разнообразить ежедневный рацион.
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
Очень часто при проведении реакции между веществами оказывается, что один реагент прореагировал полностью, а другой нет. В таком случае говорят, что вещество, которое полностью израсходовалось, было в недостатке, а то вещество, которое осталось – в избытке. Поскольку избыток реагента не участвует в реакции, количество продукта зависит только от количества вещества, которое было в недостатке.
Предположим, что осуществляется реакция между веществами А и B, которая протекает в соответствии с уравнением:
Для осуществления этой реакции было взято количество вещества A, равное nA, и количество вещества B, равное nB. Определить то, какое вещество в избытке, а какое в недостатке, можно, сравнив выражения:
В зависимости от того, какое выражение окажется меньше, то вещество соответственно и будет в недостатке.
Примечание: распространенной ошибкой является то, что вместо выражений (1) сравнивают просто количества веществ. Так делать категорически не допускается! Если n(A) > n(B), то это еще не значит, что вещество A в избытке!
После того, как будет установлено то, какое вещество было в недостатке, расчеты ведутся по его количеству аналогично рассмотренным в главе 4.3.3.
Пример задачи на избыток и недостаток
Нагрели смесь 54 г алюминия и 80 г серы. Вычислите массу образовавшегося сульфида алюминия.
Решение
Запишем уравнение реакции:
Рассчитаем количества веществ алюминия и серы:
n(Al) = m(Al)/M(Al) = 54/27 = 2 моль;
n(S) = m(S)/M(S) = 80/32 = 2,5 моль
Для того чтобы выяснить, какое из исходных веществ в недостатке, разделим количества молей веществ на коэффициенты перед этими веществами в уравнении и сравним рассчитанные выражения:
Значит сера в недостатке. Расчеты далее ведем по количеству вещества серы.
Исходя из уравнения реакции
следует, что количество прореагировавшей серы и образовавшегося в результате реакции сульфида алюминия связаны выражением:
где 3 и 1 – коэффициенты перед S и Al2S3 соответственно. Отсюда:
Следовательно, масса сульфида алюминия будет равна:
В случае, если вместо массовой доли чистого вещества дается массовая доля примесей, то учитывая, что:
мы можем записать, что:
Пример задачи на расчет количества продукта, зная массу реагента с примесями
Какой объем углекислого газа (н.у.) выделится при действии избытка соляной кислоты на технический карбонат кальция массой 150 г, содержащий 10% некарбонатных примесей.
Решение:
Запишем уравнение взаимодействия карбоната кальция с соляной кислотой:
Массовая доля примесей в техническом карбонате кальция составляет 10%, значит массовая доля чистого карбоната кальция будет составлять:
ω(CaCO3) = 100% — ω(прим.) = 100% — 10% = 90%.
Масса чистого карбоната кальция будет равна:
m(CaCO3) = ω(CaCO3) ∙ m(CaCO3 техн.)/100% = 90% ∙ 150 г/100% = 135 г,
Следовательно, количество вещества карбоната кальция равно:
n(CaCO3) = m(CaCO3)/M(CaCO3) = 135 г / 100 г/моль = 1,35 моль
В соответствии с уравнением реакции:
Количества веществ карбоната кальция и углекислого газа равны (одинаковые коэффициенты в уравнении), следовательно:
Тогда, зная, что один моль любого газа при нормальных условиях занимает объем 22,4 л, мы можем рассчитать объем выделившегося CO2:
V(CO2) = n(CO2) ∙ Vm = 1,35 моль ∙ 22,4 л/моль = 30,24 л