как узнать изотоп элемента
Химические элементы
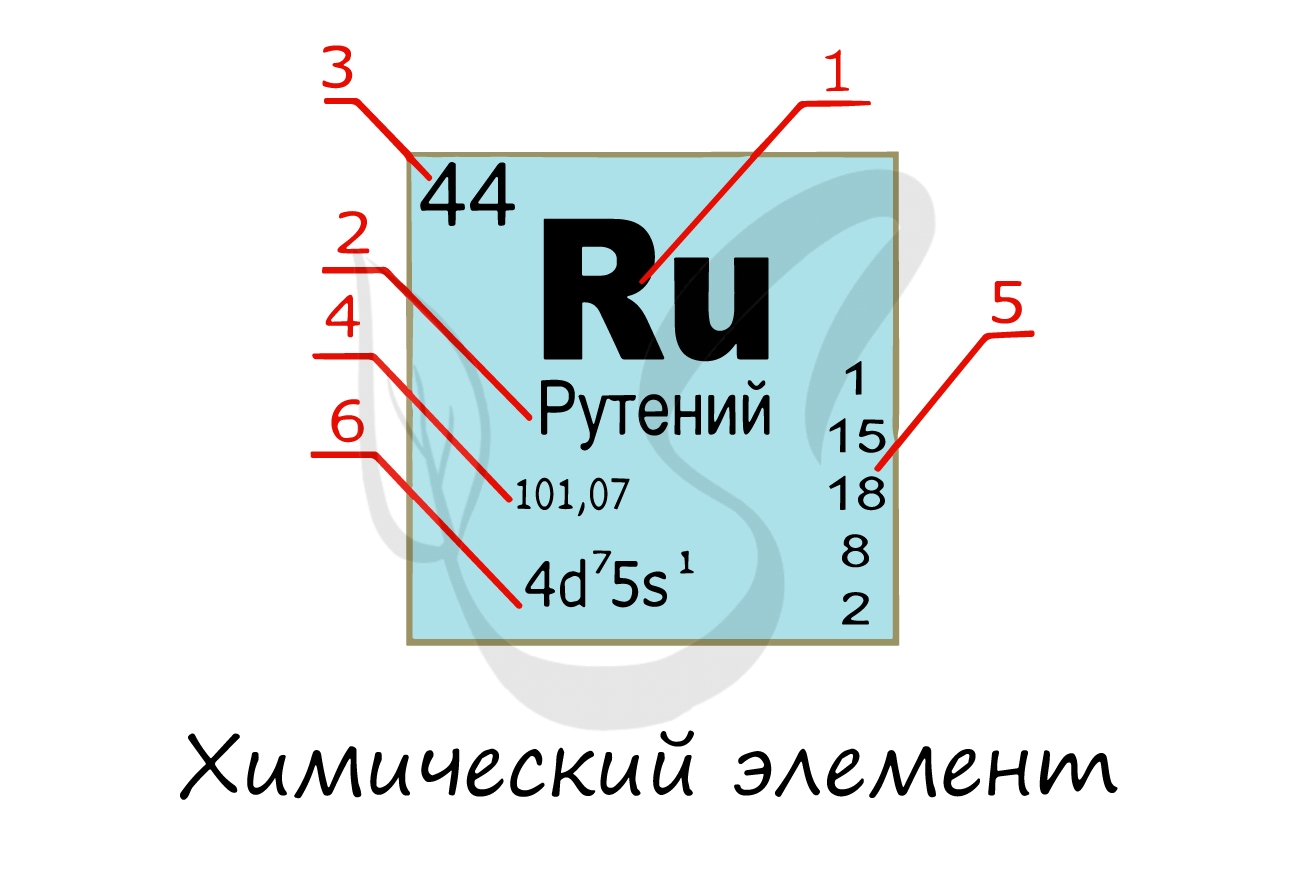
Химический элемент
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
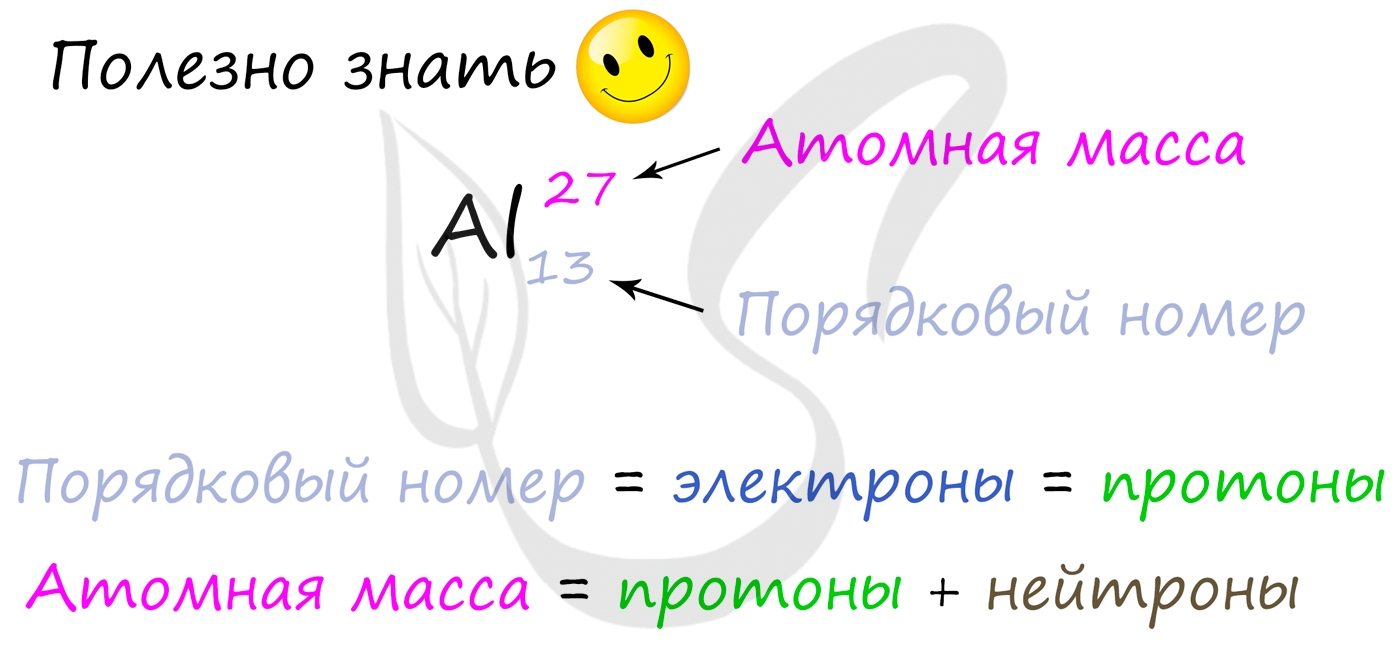
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.
Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
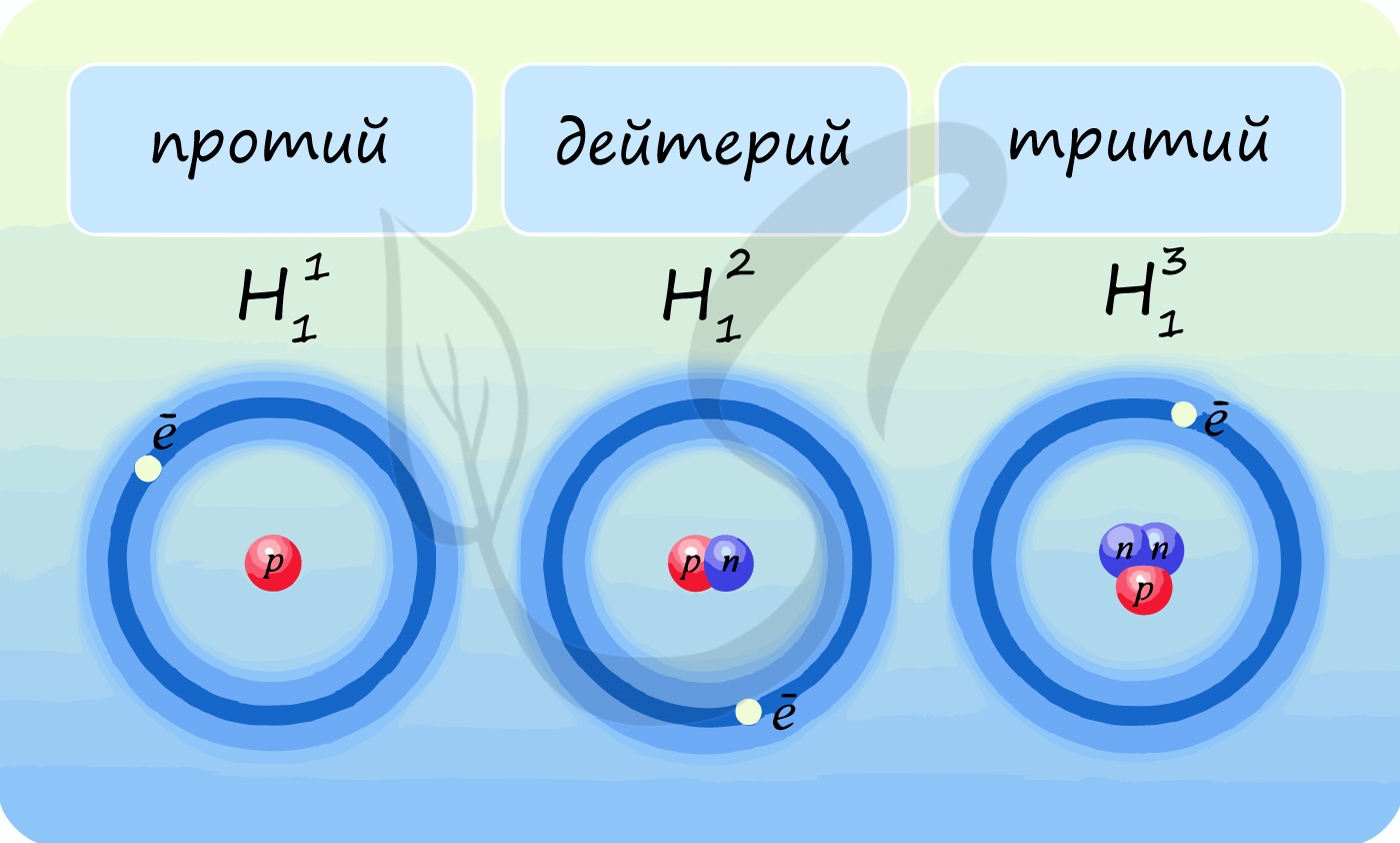
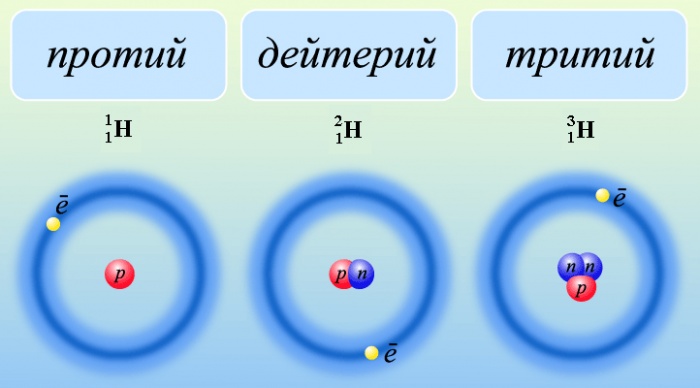
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
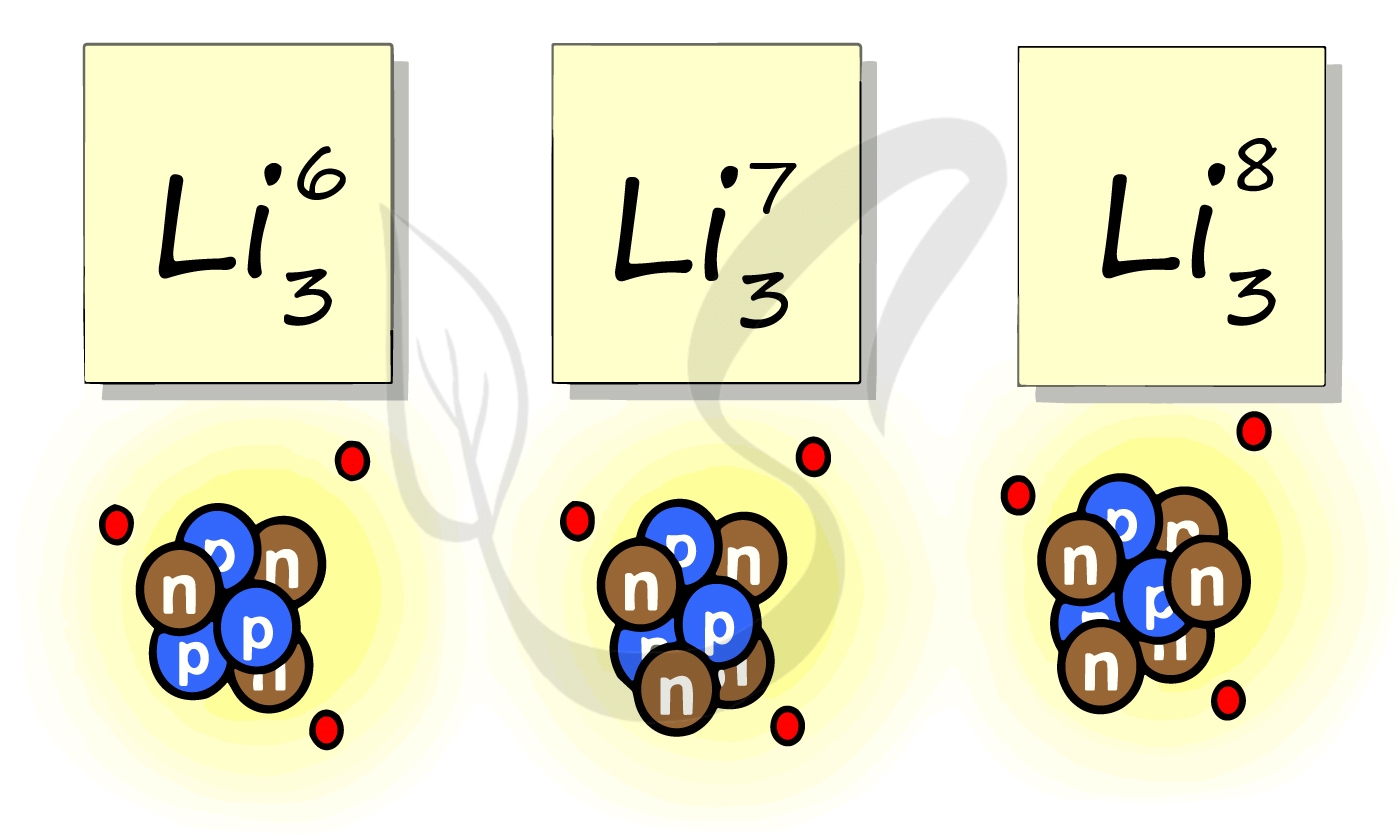
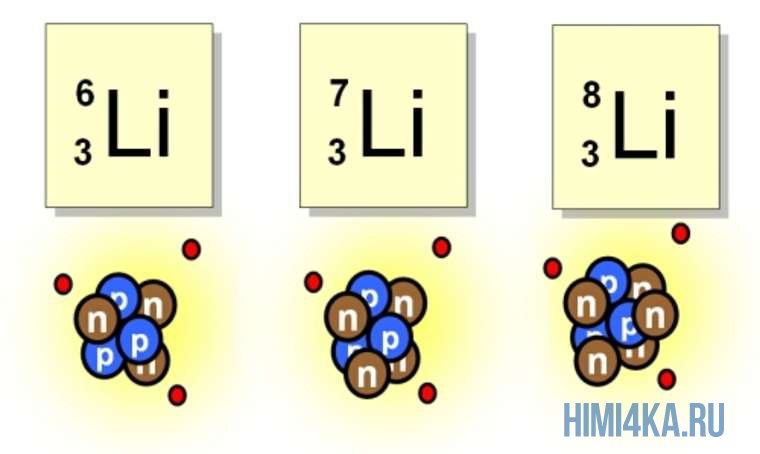
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Урок 2. Изотопы элементов
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
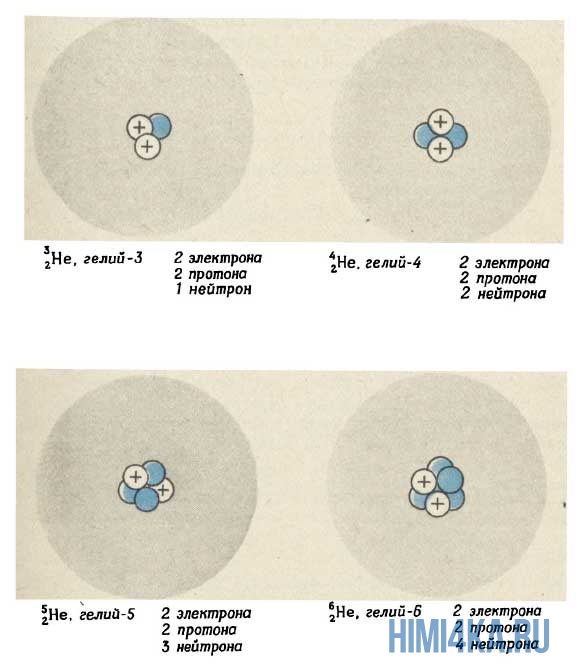
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
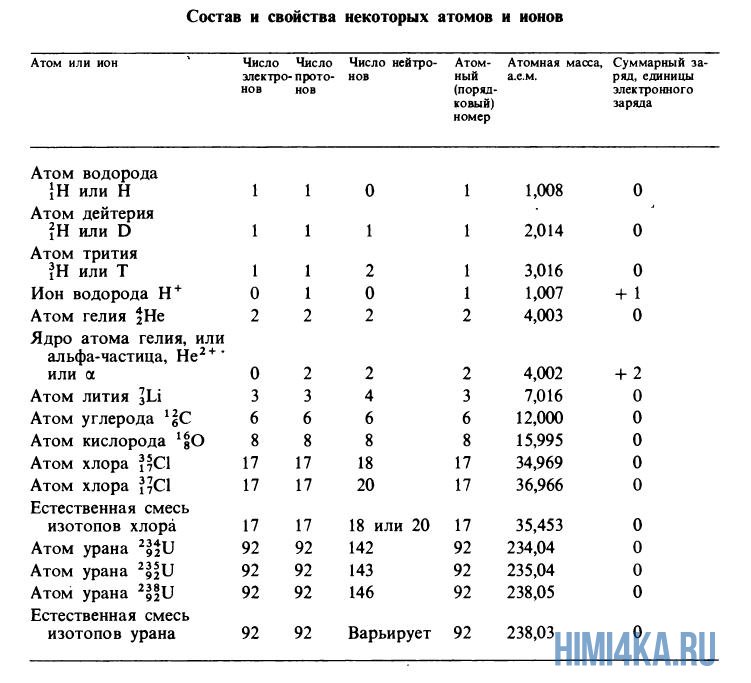
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238 U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24 Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25 Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26 Mg. Средняя атомная масса магния находится следующим образом:
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Изотопы.
Изотопы имеют одинаковое строение электронных оболочек и занимают одно и то же место в периодической системе химических элементов.
Для названий и символов изотопов обычно используют названия и символы соответствующих химических элементов.
Верхний индекс указывает массовое число – сумму чисел протонов и нейтронов в ядре.
Нижний индекс – порядковый номер элемента в периодической системе химических элементов.
Изотопы записываются так (например, изотопы калия):
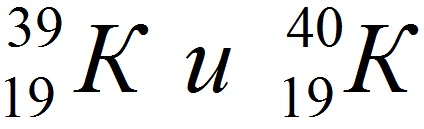
Водород имеет три изотопа:
Углерод имеет три изотопа с массой 12, 13, 14, кислород также имеет три изотопа с массой 16, 17, 18.
Изотопы, имеющие одинаковые массовые числа, но различные заряды ядер, называются изобарами.
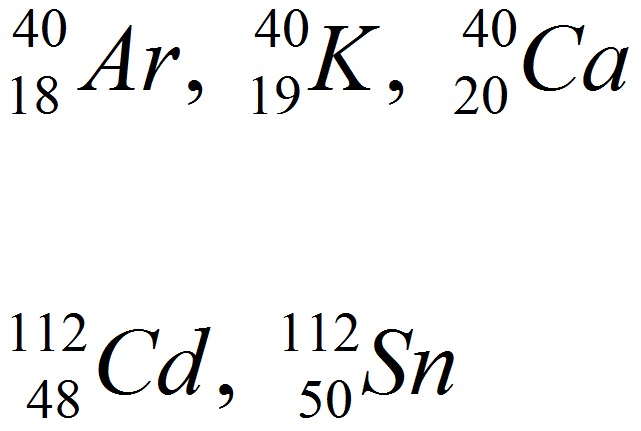
На данный момент науке известно около 280 стабильных и более 2000 радиоактивных изотопов у 116 природных и искусственно полученных химических элементов.
Радиоактивность (от лат. radio – излучаю, radius – луч и activus – действенный), самопроизвольное превращение неустойчивого изотопа химического элемента в другой изотоп (зачастую – изотоп другого элемента), сопровождаемое испусканием ядер элементарных частиц.
Как определить число протонов, нейтронов и электронов в изотопе?
Для того чтобы это сделать вам нужно знать 3 вещи:
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Число нейтронов вычисляется по формуле:
Где N — число нейтронов, A — атомная масса элемента (в целых числах), Z — заряд ядра атома (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
Изотопы это разновидности атомов химического элемента, которые имеют одинаковый заряд ядра (порядковый номер в таблице), но разные массовые числа.
Проще говоря, у изотопов в ядре атома одинаковое число протонов, но разное число нейтронов.
Таким образом, число протонов и электронов у изотопов такое же, как и у обычных атомов, разница лишь в количестве нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит атом изотопа титана 50 Ti?
Титан имеет порядковый номер 22. Значит в ядре содержится 22 протона, а в атоме 22 электрона.
Число нейтронов: N = 50 — 22 = 28 нейтронов.
Сколько электронов содержит нейтральный атом изотопа полония?
В данном случае нам даже не нужно знать массовое число изотопа, т.к. речь идет только об электронах. Порядковый номер полония 84, значит в ядре атома 84 протона, а в атоме 84 электрона.
Определите число протнов, нейтронов и электронов для изотопа 55 Mn.
Порядковый номер марганца 25. Значит в ядре атома 25 протонов, а в атоме 25 электронов.
Найдем число нейтронов: N = 55 — 25 = 30 нейтронов.
Определите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, т.к. речь идет о протонах, число которых у изотопов одинаково. Калий имеет порядковый номер в таблице 19, значит у любого изотопа калия будет 19 протонов.
Как узнать изотоп элемента
Повторите основные положения темы «Основные понятия химии» и решите предложенные задачи. Используйте материалы уроков химии 8 класса №№6-17.
Видео YouTube
1. Вещество (простое и сложное) – это любая совокупность атомов и молекул, находящаяся в определённом агрегатном состоянии.
2. Структурные единицы вещества:
· Атом – наименьшая элекронейтральная частица химического элемента и простого вещества, обладающая всеми его химическими свойствами и далее физически и химически неделимая.
· Молекула – наименьшая электронейтральная частица вещества, обладающая всеми его химическими свойствами, физически неделимая, но делимая химически.
3. Химический элемент – это вид атомов с определённым зарядом ядра.
5. Состав атомного ядра :
· В состав ядра входят элементарные частицы ( нуклоны ) –
(А – массовое число, округлённое значение А r ; N – число нейтронов в ядре; Z – заряд ядра, равный числу протонов)
6. Общее число электронов в электронной оболочке атома N ē равно числу протонов в ядре и порядковому номеру химического элемента
7. Изотопы – разновидность атомов одного и того же химического элемента, отличающиеся друг от друга только своей массой.
· Обозначение изотопов: слева от символа элемента указывают массовое число (вверху) и порядковый номер элемента (внизу)
· Почему у изотопов разная масса?
Задание: Определите атомный состав изотопов хлора: 35 17 Cl и 37 17 Cl ?
· Изотопы имеют разную массу из-за различного числа нейтронов в их ядрах.
8. В природе химические элементы существуют в виде смесей изотопов.
Ar ср ( Cl ) = 0,754 ∙ 35 + 0,246 ∙ 37 = 35,453
10. Задача для решения:
№1. Определите относительную атомную массу бора, если известно, что молярная доля изотопа 10 В составляет – 19,6 %, а изотопа 11 В – 80,4 %.
11. Массы атомов и молекул очень малы. В настоящее время в физике и химии принята единая система измерения.
Абсолютные массы некоторых атомов:
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12 С.
М r – показывает, во сколько раз данная молекула тяжелее 1/12 части атома 12 С.
12. Связь между абсолютной и относительной массами атома или молекулы:
· Моль (ν) – единица количества вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов содержится в 12 г изотопа 12 C
· Масса 1 атома 12 C равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12 C равно:
14. Основные формулы:
Задачи для самостоятельного решения
№1. Вычислите число атомов азота в 100г карбоната аммония, содержащего 10% неазотистых примесей.
№2. При нормальных условиях 12 л газовой смеси, состоящей из аммиака и углекислого газа, имеют массу 18 г. Сколько литров каждого из газов содержит смесь?
№3. При действии избытка соляной кислоты на 8,24 г смеси оксида марганца ( IV ) с неизвестным оксидом МО2, который не реагирует с соляной кислотой, получено 1,344 л газа при н.у. Входе другого опыта установлено, что мольное отношение оксида марганца ( IV ) к неизвестному оксиду равно 3:1. Установите формулу неизвестного оксида и вычислите его массовую долю в смеси.