как узнать кислотный оксид
Как определить тип оксида?
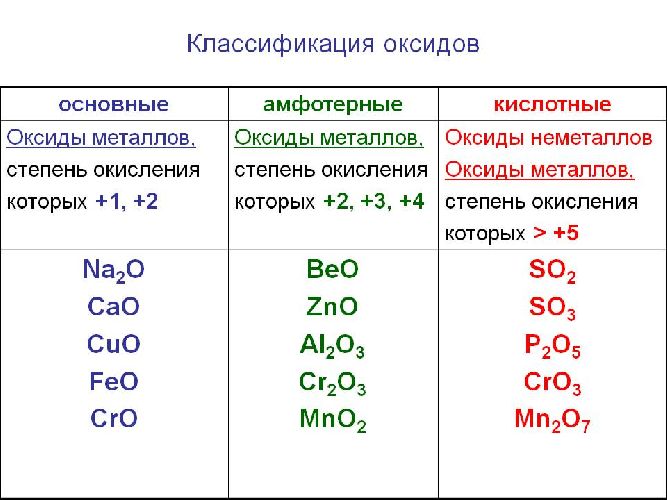
В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
1) Степень окисления неметалла +1 или +2
Вывод: оксид несолеобразующий
Исключение: Cl2O не относится к несолеобразующим оксидам
1) Степень окисления металла равна +1, +2
Вывод: оксид металла основный
Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!!
2) Степень окисления больше либо равна +3
Вывод: оксид кислотный
Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1
2) Степень окисления металла +3, +4,
Вывод: оксид амфотерный.
Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов
3) Степень окисления металла +5,+6,+7
Вывод: оксид кислотный.
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь
Кислотные оксиды
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
Рис. 1. Виды оксидов.
Основные свойства кислотных оксидов
Рис. 2. Кислотные оксиды с соответствующими кислотами.
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
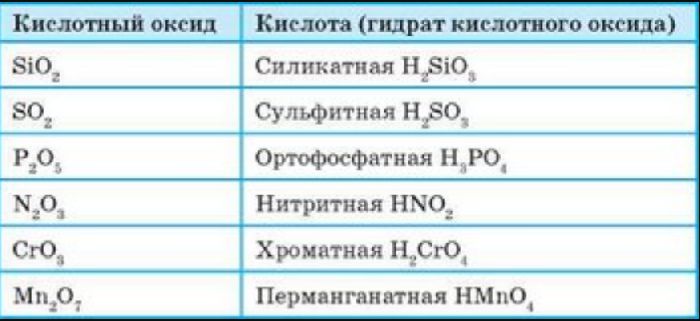
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |
Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Как узнать у какого оксида наиболее выражены кислотные свойства
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
Рис. 1. Виды оксидов.
Основные свойства кислотных оксидов
Рис. 2. Кислотные оксиды с соответствующими кислотами.
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |
Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Тест по теме
Чтобы попасть сюда – пройдите тест.
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 929.
Кислотными свойствами называют те, которые наиболее сильно проявляются в данной среде. Их существует целый ряд. Необходимо уметь определять кислотные свойства спиртов и других соединений не только для выявления содержания в них соответствующей среды. Это также важно для распознавания изучаемого вещества.
Существует множество тестов на наличие кислотных свойств. Наиболее элементарный – погружение в вещество индикатора – лакмусовой бумаги, которая реагирует на содержание водорода, розовея или краснея. Причем более насыщенный цвет демонстрирует более сильную кислоту. И наоборот.
Кислотные свойства усиливаются вместе с увеличением радиусов отрицательных ионов и, следовательно, атома. Это обеспечивает более легкое отщепление частиц водорода. Это качество является характерным признаком сильных кислот.
Существуют наиболее характерные кислотные свойства. К ним относятся:
– диссоциация (отщепление катиона водорода);
– разложение (образование кислотного оксида и воды под воздействием температуры и кислорода);
– взаимодействие с гидроксидами (в результате которого образуются вода и соль);
– взаимодействие с оксидами (в результате также образуются соль и вода);
– взаимодействие с металлами, предшествующими водороду в ряду активности (образуется соль и вода, иногда с выделением газа);
– взаимодействие с солями (только в том случае, если кислота сильнее той, которой образована соль).
Часто химикам приходится самостоятельно получать кислоты. Для их выведения существует два способа. Один из них – смешение кислотного оксида с водой. Этот способ используется наиболее часто. А второй – взаимодействие сильной кислоты с солью более слабой. Его используют несколько реже.
Известно, что кислотные свойства проявляются и у многих органических веществ. Они могут быть выражены сильнее или слабее в зависимости от строения ядер атомов. К примеру, кислотные свойства спиртов проявляются в способности отщеплять катион водорода при взаимодействии с щелочами и металлами.
Алкоголяты – соли спиртов – способны гидролизоваться под действием воды и выделять спирт с гидроксидом металла. Это доказывает, что кислотные свойства этих веществ слабее, чем у воды. Следовательно, среда выражена в них сильнее.
Кислотные свойства фенола гораздо сильнее в связи с повышенной полярностью ОН-соединения. Поэтому данное вещество может реагировать также с гидроксидами щелочноземельных и щелочных металлов. В результате образуются соли – феноляты. Чтобы выявить фенол, наиболее эффективно использовать качественную реакцию с хлоридом железа (III), в которой вещество приобретает сине-фиолетовую окраску.
Итак, кислотные свойства в различных соединениях проявляются одинаково, но с разной интенсивностью, что зависит от строения ядер и полярности водородных связей. Они помогают определять среду вещества и его состав. Наряду с данными свойствами, существуют также и основные, которые усиливаются с ослаблением первых.
Все эти характеристики проявляются в большинстве сложных веществ и составляют важную часть окружающего нас мира. Ведь именно за их счет проходят многие процессы не только в природе, но и в живых организмов. Поэтому кислотные свойства крайне важны, без них была бы невозможна жизнь на земле.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Тренировочные тесты по теме Классификация оксидов.
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → 2Na2O2
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
Но есть некоторые исключения.
Например, сера сгорает только до оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li2CO3 → CO2 + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Кислотные оксиды — получение и химические свойства
Кислотными называются оксиды, взаимодействующие с основаниями (или основными оксидами) с образованием солей.
Кислотные оксиды представляют собой оксиды неметаллов или переходных металлов в высоких степенях окисления, им соответствуют кислотные гидроксиды, обладающие свойствами кислот.
Например, S +6 O3 → H2S +6 O4; N2 +5 O5 → HN +5 O3, причем степень окисления элемента не изменяется при переходе от оксида к гидроксиду.
Получение кислотных оксидов
1. Окисление кислородом
2. Горение сложных веществ
Химические свойства кислотных оксидов
1. Большинство кислотных оксидов непосредственно взаимодействуют с водой с образованием кислот:
2. Наиболее типичными для кислотных оксидов являются их следующие реакции с образованием солей:
| с основными оксидами: | SO3 + Na2O = Na2SO4 |
| с амфотерными оксидами: | P2O5 + Al2O3 = 2AlPO4 |
| со щелочами: | CO2 + 2KOH = K2CO3 + H2O |
3. Кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например,
4. Менее летучие кислотные оксиды вытесняют более летучие кислотные оксиды из их солей (сплавление):
Кислотные оксиды – список с примерами и формулами
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
Рис. 1. Виды оксидов.
Основные свойства кислотных оксидов
Рис. 2. Кислотные оксиды с соответствующими кислотами.
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |
Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.