как узнать кислоту по формуле
Урок 23. Понятие о кислотах
В уроке 23 «Понятие о кислотах» из курса «Химия для чайников» познакомимся со сложными веществами — кислотами; узнаем об индикаторах и как они помогают человеку.
В тексте нашего учебника вам уже неоднократно встречалось слово «кислота». Много раз, конечно, вы слышали это слово и в повседневной жизни. При приготовлении пищи используются уксусная и лимонная кислоты, в домашней аптечке есть борная кислота, в аккумуляторы автомашин заливают серную кислоту и т. д. Отметим, что и в быту, и в производственной деятельности людей используются в основном водные растворы кислот. Познакомимся поближе с этими веществами.
Состав кислот
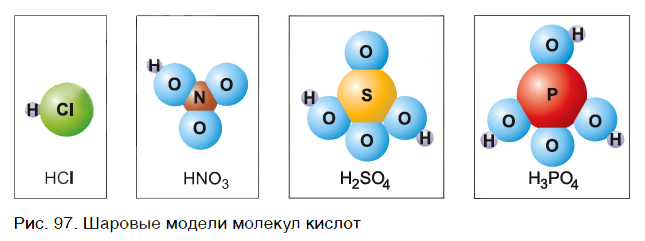
В большинстве случаев в состав молекул кислот входят только атомы неметаллов. На рисунке 97 представлены шаровые модели молекул некоторых кислот и их формулы. Что общего у этих молекул? Ответ прост — в них входят атомы водорода.
Обратим внимание, что в состав молекулы хлороводорода, кроме атома водорода Н, входит атом хлора Cl, молекулы азотной кислоты — группа атомов NO3, молекулы серной кислоты — SO4, молекулы фосфорной кислоты — PO4.
Атом Cl, группы атомов NO3, SO4, PO4, а также другие атомы и группы атомов в составе кислот называют кислотными остатками.
Кислоты — сложные вещества, в состав которых входят атомы водорода, способные замещаться атомами металлов, и кислотные остатки.
Кислотные остатки в молекулах кислот соединены с атомами водорода в соответствии со своей валентностью. Как можно ее определить? Водород всегда одновалентен. Значит, если кислотный остаток в молекуле кислоты соединен с одним атомом водорода, то его валентность равна единице, если с двумя атомами — двум, а с тремя — трем.
При написании формул кислот сначала пишут атомы водорода, а потом кислотные остатки.
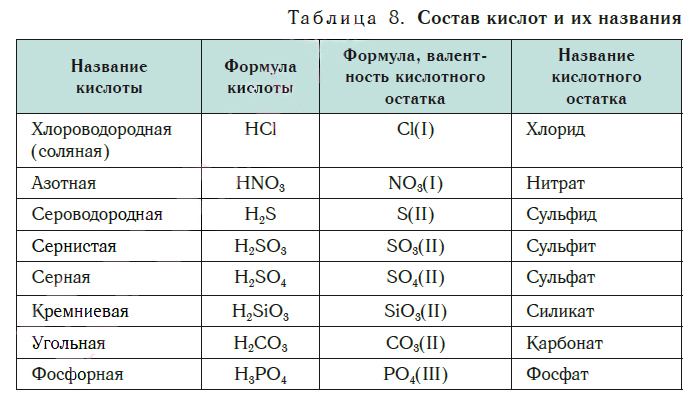
В таблице 8 представлены названия и формулы кислот, с которыми вы будете встречаться при изучении основ химии. Здесь же даны формулы кислотных остатков, которые входят в состав этих кислот, их валентность и названия.
При обычных условиях кислоты существуют в жидком и твердом агрегатных состояниях. Так, фосфорная кислота H3PO4 при комнатной температуре — твердое вещество. При этих же условиях серная кислота H2SO4 — это не имеющая запаха вязкая жидкость. Она почти в 2 раза тяжелее воды. Хлороводородная кислота HCl — раствор газа хлороводорода в воде. Она имеет еще и историческое название «соляная кислота». Раствор этой кислоты имеет характерный запах.
В большинстве случаев кислоты растворяются в воде. Исключение — кремниевая кислота H2SiO3. Водные растворы хлороводородной, серной и фосфорной кислот не имеют окраски. Безводная азотная кислота при хранении желтеет.
Поскольку в состав всех кислот входят атомы водорода, то кислоты обладают общими свойствами: 1) изменяют окраску некоторых органических веществ; 2) имеют кислый вкус (пробовать кислоты на вкус, как и любые другие вещества, запрещается — можно получить ожог полости рта!); 3) оказывают разъедающее действие на кожу человека, ткани, бумагу, древесину и другие материалы.
Меры предосторожности при работе с кислотами
Кислоты — едкие вещества. Попадание кислот на кожу или в глаза может привести к болезненным химическим ожогам. Обращаться с кислотами нужно очень осторожно. При работе с ними следует надевать специальные халаты, перчатки, очки. При попадании кислоты на кожу или в глаза ее необ ходимо немедленно смыть большим количеством воды, а затем пораженный участок промыть раствором питьевой соды. В случае необходимости следует обратиться в медпункт.
Понятие об индикаторах
Некоторые органические вещества изменяют свою окраску в присутствии кислот и ряда других веществ. Такие вещества называют индикаторами, что в переводе с латинского означает «указатель».
Индикаторы — это органические вещества, которые изменяют свою окраску в присутствии кислот и ряда других веществ.
На уроках химии для обнаружения в растворах кислот используют индикаторы лакмус, метиловый оранжевый (метилоранж), а также универсальный индикатор. Это полоска фильтровальной бумаги, пропитанная смесью индикаторов. Окраска индикаторов в воде показана на рисунке 98. Индикаторы изменяют свой цвет, если в растворе есть кислоты (рис. 99).
На заметку: В растворах кислот изменяют цвет сок краснокочанной капусты, вишни, черноплодной рябины, цветки фиалки и др.
Краткие выводы урока:
Надеюсь урок 23 «Понятие о кислотах» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Как узнать кислоту по формуле
Из материалов урока Вы познакомитесь с разными способами классификации кислот, расширите свои знания о физических и химических свойствах кислот.
I. Посмотрите видео-презентацию
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.

HCl – хлороводородная, H2S – сероводородная.
Названия кислородсодержащих кислот тоже подчиняются определенным правилам. К названию химического элемента прибавляется суффикс н или ов(ев) и окончание –ая, если число атомов кислорода в молекуле кислоты наибольшее:
Если в молекуле кислоты число атомов кислорода меньше максимального, то часто в названии используют суффикс ист:
Это интересно
Всегда ли кислоты называли кислотами?
Названия неорганических кислот долгое время никак не были связаны с присущим им кислым вкусом. Так, серную кислоту называли купоросным маслом или купоросным спиртом, хлороводородную (соляную) кислоту — соляным спиртом или кислым спиртом, азотную кислоту — селитряной дымистой водкой или крепкой водкой; смесь азотной и хлороводородной кислот называли царской водкой. Названия эти пришли из языка алхимиков и не отражали особенностей строения кислот.
II. Классификация кислот
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
2. По составу:
а) Таблица кислород содержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
Кислотный остаток (А)
Соответствующий кислотный оксид
SO3 оксид серы (VI ), серный ангидрид
MnO4 (I) перманганат
PO4 (III) ортофосфат
CO2 оксид углерода ( IV), углекислый газ
SiO2 оксид кремния (IV)
б) Таблица бескислородных кислот
Кислотный остаток (А)
HCl соляная, хлороводородная
HF фтороводородная, плавиковая
III. Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
IV. Способы получения кислот
Бескислородные
Кислородсодержащие
ПОЛУЧЕНИЕ
1. Прямое взаимодействие неметаллов
1. Кислотный оксид + вода = кислота
2. Реакция обмена между солью и менее летучей кислотой
V. Химические свойства кислот
Название индикатора
Нейтральная среда
Кислая среда
Универсальная индикаторная бумага
2.Реагируют с металлами в ряду активности до H2 (искл. HNO3 –азотная кислота)
Ме + КИСЛОТА =СОЛЬ + H2↑ (р. замещения)
3. С основными (амфотерными) оксидами – оксидами металлов
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
Сила кислот убывает в ряду:
Каждая предыдущая кислота может вытеснить из соли последующую
6. Разложение кислородсодержащих кислот при нагревании ( искл. H2SO4; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду :
Сероводородная кислота в продуктах выделяется в виде газа: СаS + 2HCl = H2S↑ + CaCl2
Роль кислот в нашей жизни трудно не заметить. Во-первых, в желудочном соке человека и животных содержится слабый раствор соляной кислоты. Муравьиная кислота, которая относится к группе органических кислот, содержится в жидкости, выделяемой муравьями, и ожог от крапивы обусловлен действием на кожу именно этой кислоты.
Рис. 1. Кислоты в природе (в лимонном соке содержится лимонная кислота; в жидкости, выделяемой муравьями – муравьиная кислота)
На этикетке многих газированных фруктовых напитков написано, что в их состав входит фосфорная кислота. Азотная кислота используется в производстве минеральных удобрений и взрывчатых веществ. Серную кислоту применяют в производстве аккумуляторных батарей.
VII. Техника безопасности приработе с кислотами
VIII. Задания для закрепления
Задание №1. Распределите химические формулы кислот в таблицу. Дайте им названия:
Урок 23. Понятие о кислотах
В уроке 23 «Понятие о кислотах» из курса «Химия для чайников» познакомимся со сложными веществами — кислотами; узнаем об индикаторах и как они помогают человеку.
В тексте нашего учебника вам уже неоднократно встречалось слово «кислота». Много раз, конечно, вы слышали это слово и в повседневной жизни. При приготовлении пищи используются уксусная и лимонная кислоты, в домашней аптечке есть борная кислота, в аккумуляторы автомашин заливают серную кислоту и т. д. Отметим, что и в быту, и в производственной деятельности людей используются в основном водные растворы кислот. Познакомимся поближе с этими веществами.
Состав кислот
В большинстве случаев в состав молекул кислот входят только атомы неметаллов. На рисунке 97 представлены шаровые модели молекул некоторых кислот и их формулы. Что общего у этих молекул? Ответ прост — в них входят атомы водорода.
Обратим внимание, что в состав молекулы хлороводорода, кроме атома водорода Н, входит атом хлора Cl, молекулы азотной кислоты — группа атомов NO3, молекулы серной кислоты — SO4, молекулы фосфорной кислоты — PO4.
Атом Cl, группы атомов NO3, SO4, PO4, а также другие атомы и группы атомов в составе кислот называют кислотными остатками.
Кислоты — сложные вещества, в состав которых входят атомы водорода, способные замещаться атомами металлов, и кислотные остатки.
Кислотные остатки в молекулах кислот соединены с атомами водорода в соответствии со своей валентностью. Как можно ее определить? Водород всегда одновалентен. Значит, если кислотный остаток в молекуле кислоты соединен с одним атомом водорода, то его валентность равна единице, если с двумя атомами — двум, а с тремя — трем.
При написании формул кислот сначала пишут атомы водорода, а потом кислотные остатки.
В таблице 8 представлены названия и формулы кислот, с которыми вы будете встречаться при изучении основ химии. Здесь же даны формулы кислотных остатков, которые входят в состав этих кислот, их валентность и названия.
При обычных условиях кислоты существуют в жидком и твердом агрегатных состояниях. Так, фосфорная кислота H3PO4 при комнатной температуре — твердое вещество. При этих же условиях серная кислота H2SO4 — это не имеющая запаха вязкая жидкость. Она почти в 2 раза тяжелее воды. Хлороводородная кислота HCl — раствор газа хлороводорода в воде. Она имеет еще и историческое название «соляная кислота». Раствор этой кислоты имеет характерный запах.
В большинстве случаев кислоты растворяются в воде. Исключение — кремниевая кислота H2SiO3. Водные растворы хлороводородной, серной и фосфорной кислот не имеют окраски. Безводная азотная кислота при хранении желтеет.
Поскольку в состав всех кислот входят атомы водорода, то кислоты обладают общими свойствами: 1) изменяют окраску некоторых органических веществ; 2) имеют кислый вкус (пробовать кислоты на вкус, как и любые другие вещества, запрещается — можно получить ожог полости рта!); 3) оказывают разъедающее действие на кожу человека, ткани, бумагу, древесину и другие материалы.
Меры предосторожности при работе с кислотами
Кислоты — едкие вещества. Попадание кислот на кожу или в глаза может привести к болезненным химическим ожогам. Обращаться с кислотами нужно очень осторожно. При работе с ними следует надевать специальные халаты, перчатки, очки. При попадании кислоты на кожу или в глаза ее необ ходимо немедленно смыть большим количеством воды, а затем пораженный участок промыть раствором питьевой соды. В случае необходимости следует обратиться в медпункт.
Понятие об индикаторах
Некоторые органические вещества изменяют свою окраску в присутствии кислот и ряда других веществ. Такие вещества называют индикаторами, что в переводе с латинского означает «указатель».
Индикаторы — это органические вещества, которые изменяют свою окраску в присутствии кислот и ряда других веществ.
На уроках химии для обнаружения в растворах кислот используют индикаторы лакмус, метиловый оранжевый (метилоранж), а также универсальный индикатор. Это полоска фильтровальной бумаги, пропитанная смесью индикаторов. Окраска индикаторов в воде показана на рисунке 98. Индикаторы изменяют свой цвет, если в растворе есть кислоты (рис. 99).
На заметку: В растворах кислот изменяют цвет сок краснокочанной капусты, вишни, черноплодной рябины, цветки фиалки и др.
Краткие выводы урока:
Надеюсь урок 23 «Понятие о кислотах» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химия
План урока:
Оксиды
Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.
Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.
Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.
Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.
Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.
Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.
Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.
Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.
Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.
В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.
Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.
Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.
Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.
Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.
Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.
Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.
Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.
Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.
Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.
Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.
Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.
Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.
Теперь необходимо справиться с задачей дать название этому типу солей.
Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.
Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.