как узнать летучесть кислоты
Уроки по неорганической химии для подготовки к ЕГЭ
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Химические свойства кислот
1. Сила кислот уменьшается в ряду:
Некоторые реакции, подтверждающие ряд кислот:
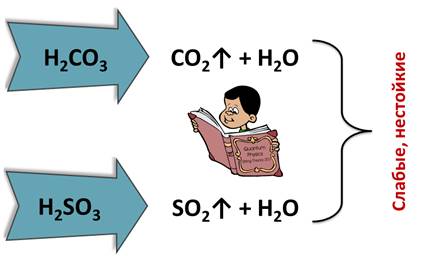
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т.е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
Аналогичным образом можно получить и слабую плавиковую кислоту:
HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
2. Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
При нагревании разлагаются следующие кислоты:
6. Взаимодействие с основаниями (реакция нейтрализации)
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
H2S + Cr(OH)3 → реакция не идет по той же причине.
Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
7. Взаимодействие с солями
Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
8. Взаимодействие кислот-неокислителей с металлами
Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
Кислоты, их классификация
Урок 38. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Кислоты, их классификация»
Существует несколько признаков классификации кислот. Разберем некоторые их них. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных остатков.
По наличию атомов кислорода в кислотах, кислоты делятся на кислородсодержащие, в которых присутствует кислород, например, серная кислота, азотная кислоты, бескислородные, в которых кислорода нет, к таким кислотам относится соляная, сероводородная.
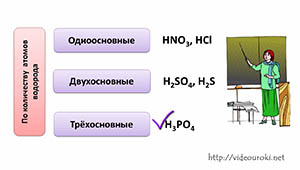
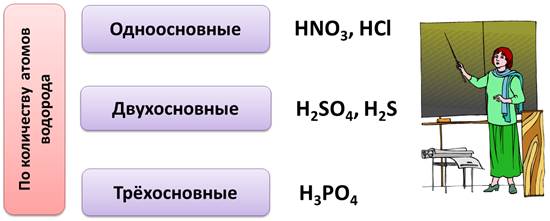
По количеству атомов водорода в кислоте, кислоты делятся на однооснòвные, у которых один атом водорода (например, в азотной кислоте, соляной), двухоснòвные, у которых 2 атома водорода (как в серной кислоте или сероводородной), трёхоснòвные, у которых 3 атома водорода (как в фосфорной кислоте).
По растворимости в воде кислоты делятся на растворимые в воде, к ним относится большинство кислот и нерастворимые в воде, как кремниевая кислота.
По летучести, т.е. способности молекул кислоты легко переходить в газообразное состояние, кислоты делятся на летучие (как соляная, сероводородная и азотная кислоты) и нелетучие – это большинство кислот: серная, кремниевая, фосфорная.
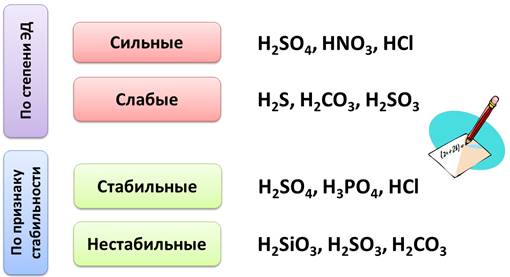
По степени электролитической диссоциации кислоты делятся на сильные, у которых степень электролитической диссоциации стремится к единице, к ним относятся такие кислоты, как серная, азотная, соляная, а слабые кислоты, у которых степень электролитической диссоциации стремится к нулю, например, сероводородная, угольная, сернистая.
По признаку стабильности кислоты делят на стабильные, как серная, фосфорная, соляная, и нестабильные, которые разлагаются при обычных условиях или при нагревании, это такие кислоты, как кремниевая, сернистая, угольная.
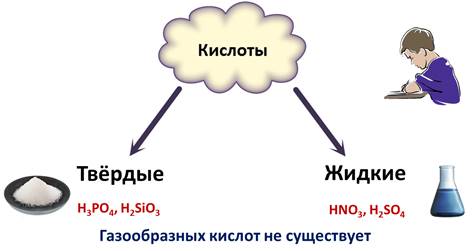
При обычных условиях кислоты могут быть твердыми. Это такие кислоты, как фосфорная и кремниевая. А также кислоты могут быть жидкими, как азотная, серная. Газообразных кислот при обычных условиях нет. Не путайте: соляную, сероводородную, бромоводородную кислоты образуют соответствующе газы, растворенные в воде, но они не являются газообразными кислотами.
Некоторые кислоты, такие как угольная и сернистая, существуют только в водных растворах, потому что они являются слабыми и нестойкими, они легко разлагаются на соответствующие оксиды и воду, поэтому выделить эти кислоты в чистом виде невозможно. Соляная кислота является летучей стабильной кислотой, а кремниевая кислота – нелетучей, нерастворимой и нестабильной кислотой, потому что при нагревании разлагается на оксид и воду.
Большинство водных растворов кислот не имеют окраски: серная, азотная, соляная и др., а хромовая (H2CrO4) имеет жёлтую окраску, марганцевая кислота (HMnO4) имеет малиновую окраску.
Кислоты. 8-й класс
Разделы: Химия
Класс: 8
Тип урока: усвоение новых знаний
Число атомов водорода в кислоте определяют по степени окисления кислотного остатка, и наоборот.
а). по основности (по числу атомов водорода):
— растворимые (все остальные)
в). по наличию атомов кислорода в кислотном остатке:
— нелетучие (все остальные)
д). по силе (степени диссоциации):
— слабые (все остальные)
— нестабильные (все остальные)
Задание № 1. Используя различные признаки классификации кислот, дайте характеристику фосфорной кислоты.
HCl
H3PO4
P2O5
(NO3)
(NO2)
(CO3)
(SiO3)
Номенклатура (названия) кислот:
с.о. = + (№ группы-2) (суффикс -оватая); с.о. = +(№ группы-6) (суффикс -оватистая)
Для распознавания кислот и оснований используют индикаторы.
Индикаторы- это вещества, которые изменяют свою окраску под действием кислот и оснований.
| Название индикатора | кислая среда | нейтральная среда | щелочная среда |
| лакмус | розовый | фиолетовый | синий |
| фенолфталеин | бесцветный | бесцветный | малиновый |
| метилоранж | розовый | оранжевый | жёлтый |
Какое количество вещества составляют 490 мг. фосфорной кислоты? Сколько атомов водорода будет содержаться в этой порции кислоты?
По формуле определить летучесть кислоты не удастся.
Летучие кислоты: HNO3, HCl, HBr, HI, H2S, HClO4, CH3COOH, HF.
2H2S+Hg=4HgSH вот такая хим формула
1. В окислительно-восстановительном отношении сернистая кислота повторяет свойства диоксида серы. Она может играть роль восстановителя в реакциях с сильными окислителями и действовать как окислитель в реакциях с сильными восстановителями.
2. Атом фосфора состоит из положительно заряженного ядра (+15), внутри которого есть 15 протонов и 16 нейтронов, а вокруг, по трем орбитам движутся 15 электронов.
аспределение электронов по орбиталям выглядит следующим образом:
Внешний энергетический уровень атома фосфора содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Каждый валентный электрон атома фосфора можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Подуровеньnl ml s s300+1/2 s300-1/2 p31-1+1/2 p310+1/2 p311+1/2
Наличие трех неспаренных электронов свидетельствует о том, что степень окисления фосфора равна +3. Так как на третьем уровне есть вакантные орбитали 3d-подуровня, то для атома фосфора характерно наличие возбужденного состояния:
Именно поэтому для фосфора также характерна степень окисления +5.
Кислота
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Содержание
Определение кислоты
Определения кислот и оснований претерпели значительную эволюцию по мере расширения теоретических представлений о природе химической связи и механизмах химических реакций.
В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в молекуле атомов кислорода. Эта гипотеза быстро доказала свою несостоятельность, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу.
В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота — это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H + ). Теория Аррениуса быстро показала свою ограниченность, она не могла объяснить многих экспериментальных фактов. В наше время она имеет главным образом историческое и педагогическое значение.
В настоящее время наиболее распространены три теории кислоты и оснований. Они не противоречат друг другу, а дополняют.
Следует также отметить, что многие вещества проявляют амфотерные свойства, то есть ведут себя как кислоты в реакциях с основаниями и как основания — в реакциях с более сильной кислотой.
Классификация кислот
Химические свойства кислот
(в данном случае образуется неустойчивая угольная кислота 
Некоторые распространённые кислоты
Неорганические (минеральные) кислоты
Кислоты, образованные серой
Органические кислоты
Интересные факты
Примечания
См. также
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Смотреть что такое «Кислота» в других словарях:
кислота — сущ., кол во синонимов: 171 • абсцизин (2) • агарицин (1) • адипил (1) • … Словарь синонимов
КиСЛОТа — 1 капля Альбом ремиксов СЛОТ Дата выпуска 2008 Записан … Википедия
кислота — сущ., ж., употр. сравн. часто Морфология: (нет) чего? кислоты, чему? кислоте, (вижу) что? кислоту, чем? кислотой, о чём? о кислоте; мн. что? кислоты, (нет) чего? кислот, чему? кислотам, (вижу) что? кислоты, чем? кислотами, о чём? о кислотах 1.… … Толковый словарь Дмитриева
КИСЛОТА — КИСЛОТА, кислоты, мн. кислоты, жен. 1. только ед. отвлеч. сущ. к кислый, что нибудь кислое (разг.). Я попробовал, чувствую: кислота какая то. 2. Химическое соединение, обладающее кислым вкусом и окрашивающее синий лакмус в красный цвет (хим.).… … Толковый словарь Ушакова
кислота — КИСЛОТА, ы, мн. оты, от, жен. Химическое соединение, содержащее водород, дающее при реакции с основаниями (в 8 знач.) соли и окрашивающее лакмусовую бумагу в красный цвет. Азотная, уксусная к. | прил. кислотный, ая, ое. К. краситель. К. дождь (с… … Толковый словарь Ожегова
КИСЛОТА 1 — КИСЛОТА 1, Шы, мн. оты, от, ж. Химическое соединение, содержащее водород, дающее при реакции с основаниями (в 8 знач.) соли и окрашивающее лакмусовую бумагу в красный цвет. Азотная, уксусная к. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова … Толковый словарь Ожегова
КИСЛОТА 2 — см. кислый 1. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
кислота — КИСЛОТА, ы, ж Химическое соединение, обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. Кислота окрашивает лакмусовую бумагу в красный цвет … Толковый словарь русских существительных
КИСЛОТА — КИСЛОТА, химическое соединение, содержащее водород, который может быть замещен металлом или другим положительным ионом с образованием соли. Кислоты растворяются в воде с получением ионов водорода (Н+), то есть действуют как источник протонов;… … Научно-технический энциклопедический словарь
кислота́ — кислота, ы; мн. кислоты, кислот … Русское словесное ударение
Кислота — ж. 1. Химическое соединение, содержащее водород, способный замещаться металлом при образовании соли. 2. То, что своими свойствами цветом, запахом, едкостью и т.п. напоминает такое химическое соединение. Толковый словарь Ефремовой. Т. Ф. Ефремова … Современный толковый словарь русского языка Ефремовой