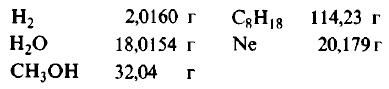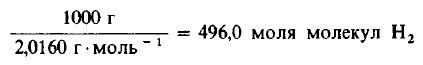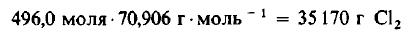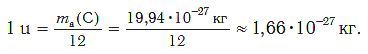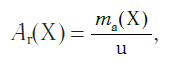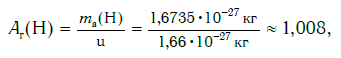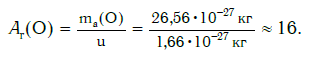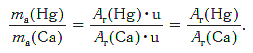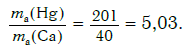как узнать молярную массу по таблице менделеева
Молярная масса
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.
Рис. 1. Формула числа Авогадро.
Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
где m – масса вещества, а v – количество вещества.
Рис. 2. Расчет молярной массы.
Как найти молярную массу вещества?
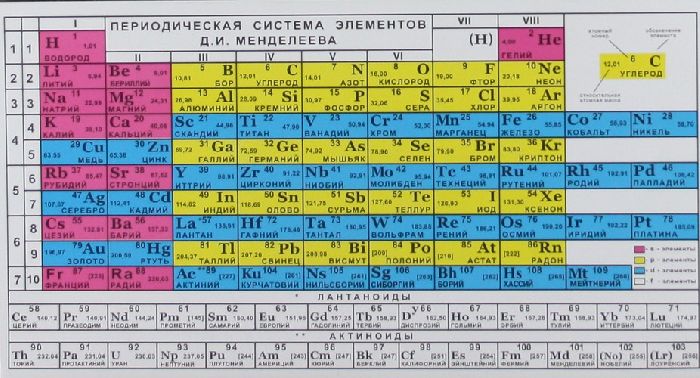
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H2 SO4. Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.
Рис. 3. Формула единицы атомной массы углерода.
Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.
Что мы узнали?
В 8 классе по химии важной темой является «молярная масса вещества». Молярная масса – важное физическое и химическое понятие. Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. измеряется она в кг/моль или грамм/моль.
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
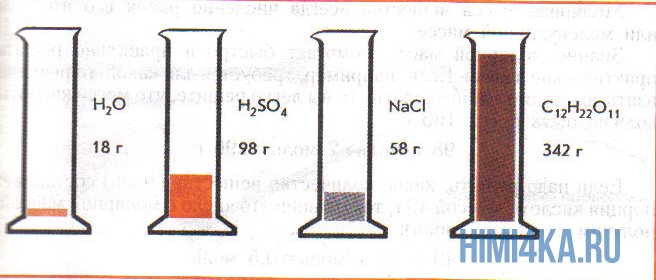
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Молярная, молекулярная и атомная массы
Молярная масса (для обозначения в формулах используется буква М) — характеристика вещества, отражающая количество граммов, которое содержится в одном его моле. Измеряется эта величина в г/моль. Интересно, что в Международной системе единиц указано, что параметр должен выражаться в кг/моль. Но г/моль является более удобной единицей измерения, поэтому именно она обычно используется на практике.
За единицу отсчёта атом элемента был взят за нейтральность и широкую распространённость в природе его изотопа. Но учёные не сразу ориентировались на углерод. Сначала были попытки создания водородной шкалы исходя из того, что водород наиболее лёгкий элемент, потом — кислородной. Но когда оказалось, что в природе это вещество является смесью изотопов с массой от 16 до 18, единица стала неприемлемой, поэтому её заменили углеродной.
С массой атомной молярная тоже может быть одинаковой, если простое вещество состоит из одного атома. Для каждого элемента её легко определить по таблице Менделеева — вместе с порядковым номером она указана в ячейке.
Определение атомной массы для каждого химического элемента было непростой задачей. Для этого учёные взвешивали все существующие в земной коре изотопы и вычисляли их среднее значение с учётом процентной распространённости в природе. Что касается синтетических элементов, то их определяли по наиболее стабильному изотопу.
Определение в сложных веществах
Для простых веществ, состоящих из одного атома, параметр считается так же, как для элемента. Молярная масса углерода всегда равна 12. Этот показатель справедлив и для натрия. Как простое вещество, этот мягкий серебристо-белый металл содержит в себе 23 г/моль, а купрум (так на латинском обозначается медь) — 63,5 г/моль. Газ также может состоять из одного элемента, например, гелий, искомый параметр которого 4 г/моль.
Но существуют и газы, которые образованы двумя молекулами (водород, азот, кислород, хлор, фтор и другие) или тремя (озон). Для них нужно не забывать умножать атомную массу на число молекул. Для сложных веществ параметр можно рассчитать аналогичным образом:
Исходя из этого, формулу молярной массы можно вывести следующим образом: М (XxYy) = М (Хx) + М (Yy) = x * М (Х) + y * М (Y). Таким образом, вычислить этот параметр для любого органического или неорганического вещества совсем несложно.
Главное, иметь под рукой таблицу Менделеева, тогда никакие онлайн-калькуляторы не потребуются.
Расчёты в смеси
Задачу можно усложнить, попробовав посчитать этот показатель в смеси, где в разных пропорциях входят различные соединения. Идеальным примером для этого является воздух. В нем можно выделить следующие составляющие:
Искомый параметр будет вычисляться следующим образом: 0,23*32+0,76*28+0,01*40. Результат равен 29,04 г/моль (можно округлить до 29).
Конечно, в воздухе содержатся и другие вещества (углекислый и инертные газы, водород и т. д. ), но их масса составляет менее десятой процента, поэтому для простоты их допускается не учитывать.
Применение в химических задачах
С этим параметром связано множество других формул. Зная его, можно вычислить количество вещества (n). Для этого нужно разделить его фактическую массу на молярную (n = m / M). Чтобы узнать число частиц в нём (N), полученное значение n нужно умножить на константу Авогадро (N A). Получается 6,02*10 23 (N = n * N A) Именно столько структурных единиц содержится в одном моле любого соединения или простого вещества. С другой стороны, зная показатель n, можно найти m по формуле n * M. В итоге получается ещё одна формула: M = m / n.
В учебнике может ждать такая задача: «Найдите массу 0,75 моль азота N2». Начать нужно с нахождения массы одного атома азота. По таблице Менделеева она равняется 14 г. Молекула состоит из двух атомов, следовательно, масса одного моля азота как простого вещества будет иметь значение 28, а масса 0,75 моль — 21 грамм.
Не менее распространена в мире химии физическая величина под названием молярный объём (V m). Её получают как отношение молярной массы к плотности вещества (M /ρ). Размерность этой величины — м 3 /моль или л/моль (кубический метр или литр на моль). В стандартных условиях для идеального газа её значение принимается за 22,41. Конечно, в реальных условиях наблюдаются отклонения от этого значения, но для решения задач ими можно пренебречь, поскольку они минимальны.
Величину для газа можно найти по формуле M = V m * ρ. Но более правильным будет вычислять её с учётом всех условий по уравнению Менделеева — Клайперона. Оно выглядит следующим образом: p * V = m * R * T / M, где p — давление, V — объём, m — масса, R — константа, равная 8,314, T — температура, M — молярная масса.
Иногда требуется найти параметр для эквивалента (MЭ). Он будет напрямую зависеть от класса соединения и его формулы. Для кислот эквивалентное число (z) соответствует количеству атомов водорода в составе (один для HCl, два для H2SO4, три для H3PO4), для щелочей — групп OH (одна для KOH, две для Ca (OH)2). Для веществ, эквивалент которых равен единице, результат не меняется, для всех остальных МЭ находится как М/ z. Исходя из этого:
Химия может быть понятной и доступной только для тех, кто последовательно подходит к её изучению и уделяет внимание каждой теме, читая учебники или просматривая видеоуроки. Но старания стоят того, ведь эта наука невероятно важная и интересная, она может дать объяснение составу и строению любого объекта окружающей среды, а на основе этих данных можно узнать практически всё о его свойствах и научиться волшебству превращения одних веществ в другие.
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
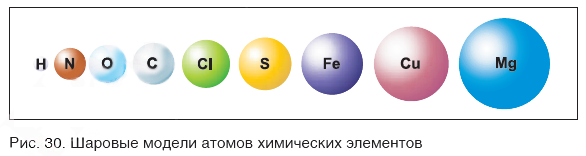
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
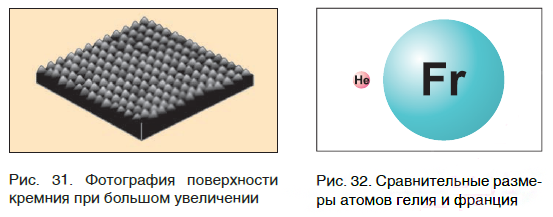
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Относительная атомная и молекулярная массы
Понятия
Для осознания, что такое относительная атомная масса в химии, следует понимать, что абсолютная масса атома слишком мала, чтобы выражать её в граммах, а тем более в килограммах. Поэтому в современной химии за атомную единицу массы (а. е. м.) взята 1/12 часть массы углерода. Относительная атомная масса равна отношению абсолютной массы к 1/12 абсолютной массы углерода. Другими словами относительная масса отражает, во сколько раз масса атома конкретного вещества превышает 1/12 массы атома углерода. Например, относительная масса азота – 14, т.е. атом азота содержит 14 а. е. м. или в 14 раз больше, чем 1/12 часть атома углерода.
Рис. 1. Атомы и молекулы.
Среди всех элементов водород самый лёгкий, его масса равна 1 единице. Самые тяжёлые атомы имеют массу в 300 а. е. м.
Молекулярная масса – значение, показывающее, во сколько раз масса молекулы превышает 1/12 часть массы углерода. Также выражается в а. е. м. Масса молекулы складывается из массы атомов, поэтому для вычисления относительной молекулярной массы необходимо сложить значения масс атомов вещества. Например, относительная молекулярная масса воды равна 18. Это значение складывается из относительных атомных масс двух атомов водорода (2) и одного атома кислорода (16).
Рис. 2. Углерод в периодической таблице.
Как видно, эти два понятия имеют несколько общих характеристик:
Как рассчитать
Чтобы выразить относительную атомную массу математически, следует определить, что 1/2 часть углерода или одна атомная единица массы равна 1,66⋅10 −24 г. Следовательно, формула относительной атомной массы имеет следующий вид:
где ma – абсолютная атомная масса вещества.
Относительная атомная масса химических элементов указана в периодической таблице Менделеева, поэтому её не нужно рассчитывать самостоятельно при решении задач. Относительные атомные массы принято округлять до целых. Исключение составляет хлор. Масса его атомов равна 35,5.
Следует обратить внимание, что при расчёте относительной атомной массы элементов, имеющих изотопы, учитывается их среднее значение. Атомная масса в этом случае высчитывается следующим образом:
где Ar,i – относительная атомная масса изотопов, ni – содержание изотопов в природных смесях.
Например, кислород имеет три изотопа – 16 О, 17 О, 18 О. Их относительная масса равна 15,995, 16,999, 17,999, а их содержание в природных смесях – 99,759 %, 0,037 %, 0,204 % соответственно. Поделив проценты на 100 и подставив значения, получим:
Обратившись к периодической таблице, легко найти это значение в клетке кислорода.
Рис. 3. Таблица Менделеева.
Относительная молекулярная масса – сумма масс атомов вещества:
При определении значения относительной молекулярной массы учитываются индексы символов. Например, вычисление массы H2CO3 выглядит следующим образом:
Зная относительную молекулярную массу, можно вычислить относительную плотность одного газа по второму, т.е. определить, во сколько раз одно газообразное вещество тяжелее второго. Для этого используется уравнение D(y)x = Mr(х) / Mr(y).
Что мы узнали?
Из урока 8 класса узнали об относительной атомной и молекулярной массе. За единицу относительной атомной массы принята 1/12 часть массы углерода, равная 1,66⋅10 −24 г. Для вычисления массы необходимо абсолютную атомную массу вещества разделить на атомную единицу массы (а. е. м.). Значение относительной атомной массы указано в периодической системе Менделеева в каждой клетке элемента. Молекулярная масса вещества складывается из суммы относительных атомных масс элементов.