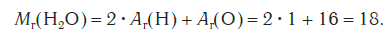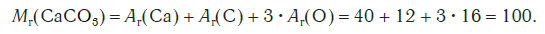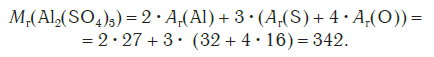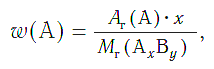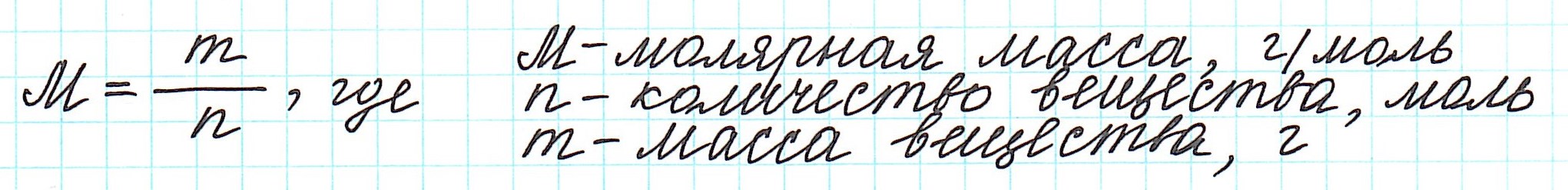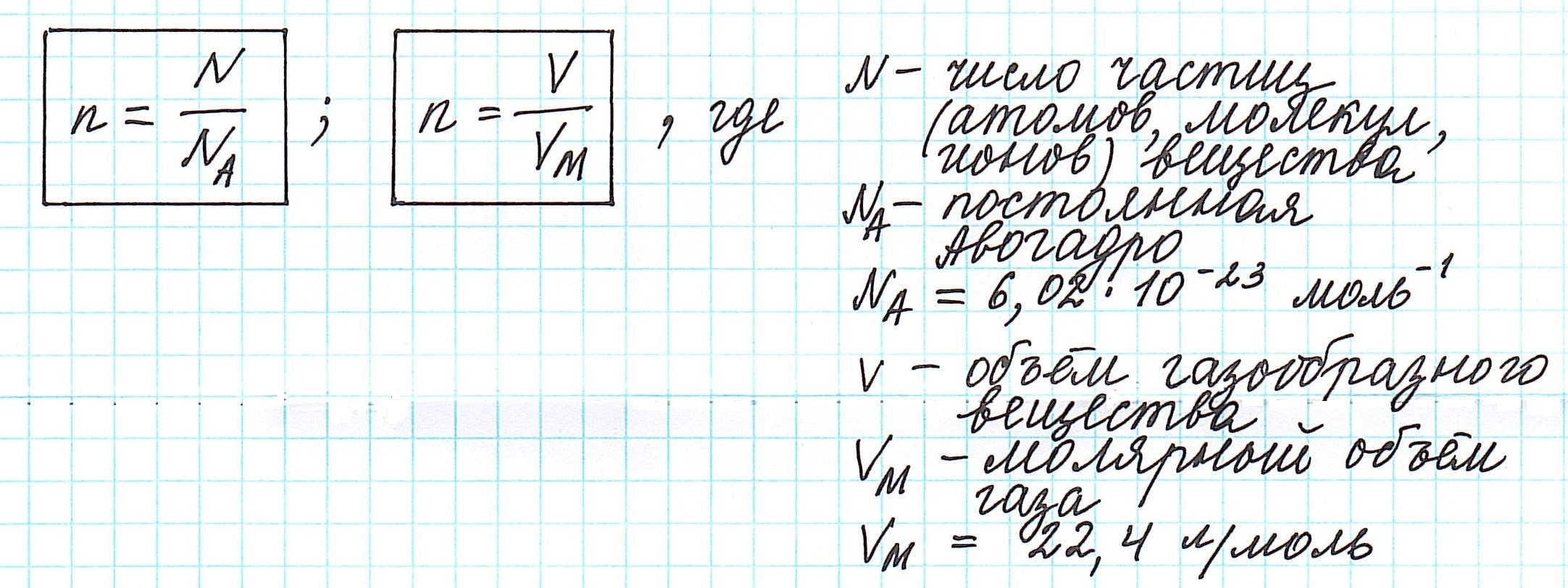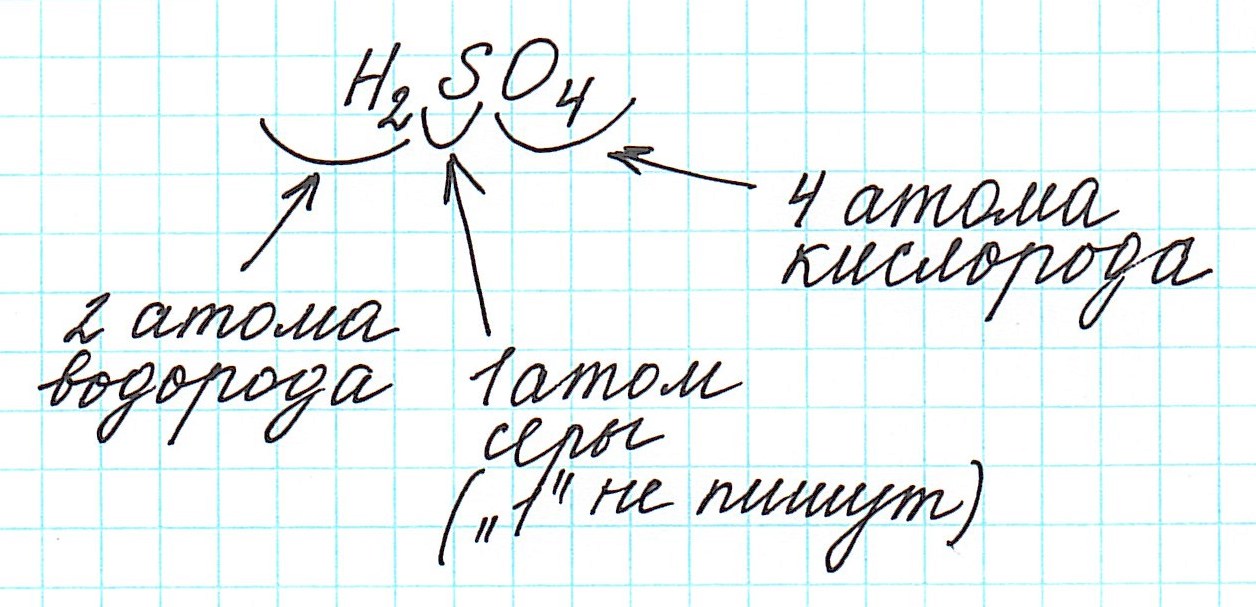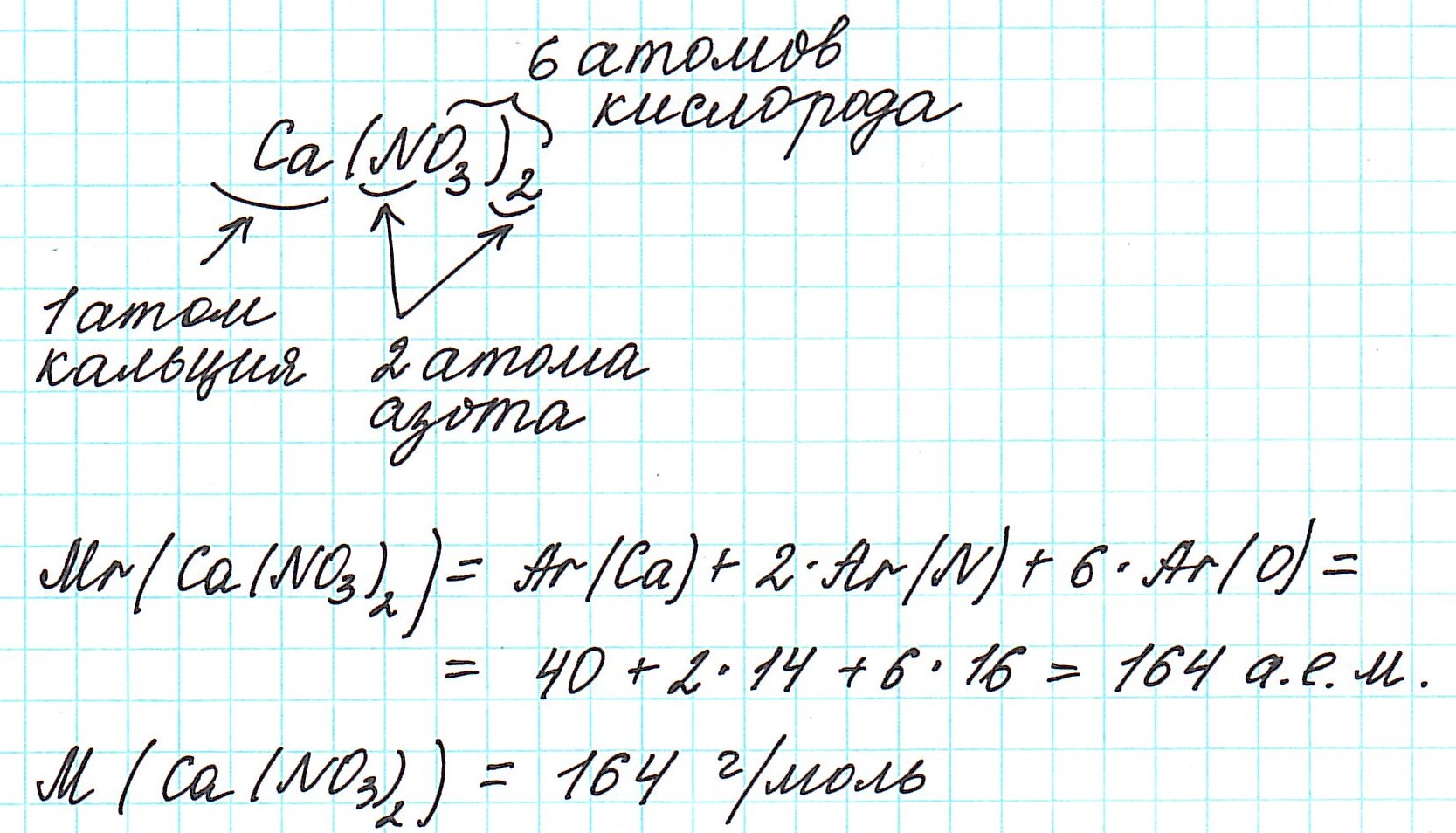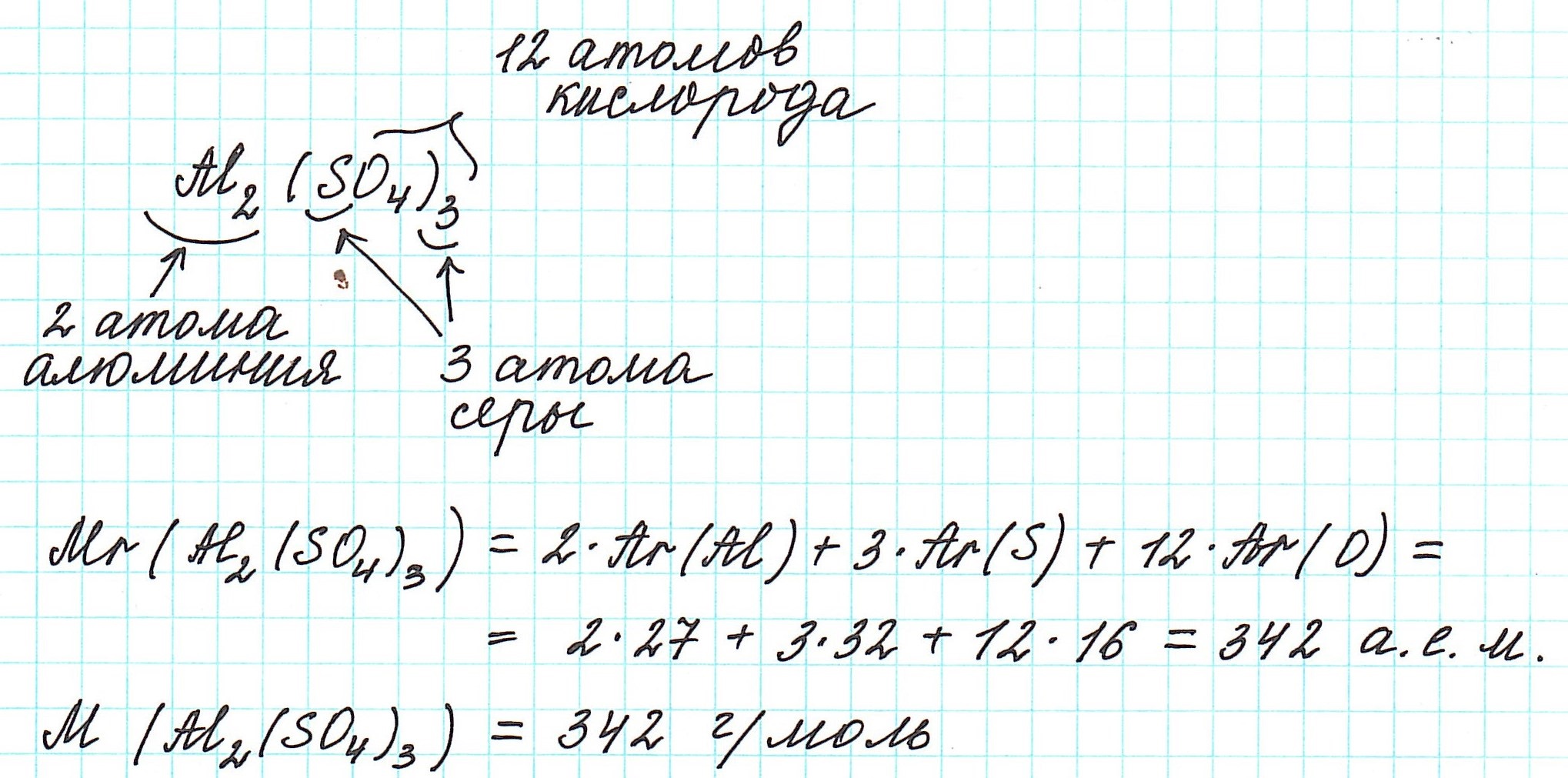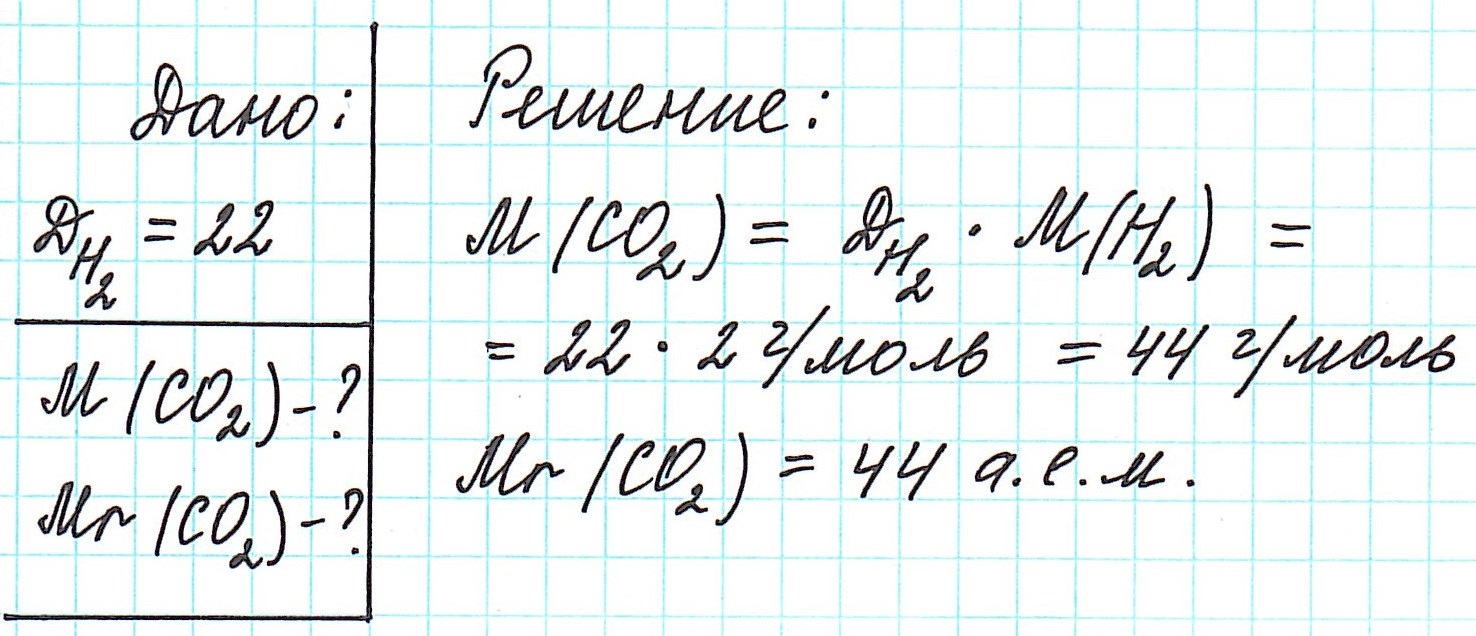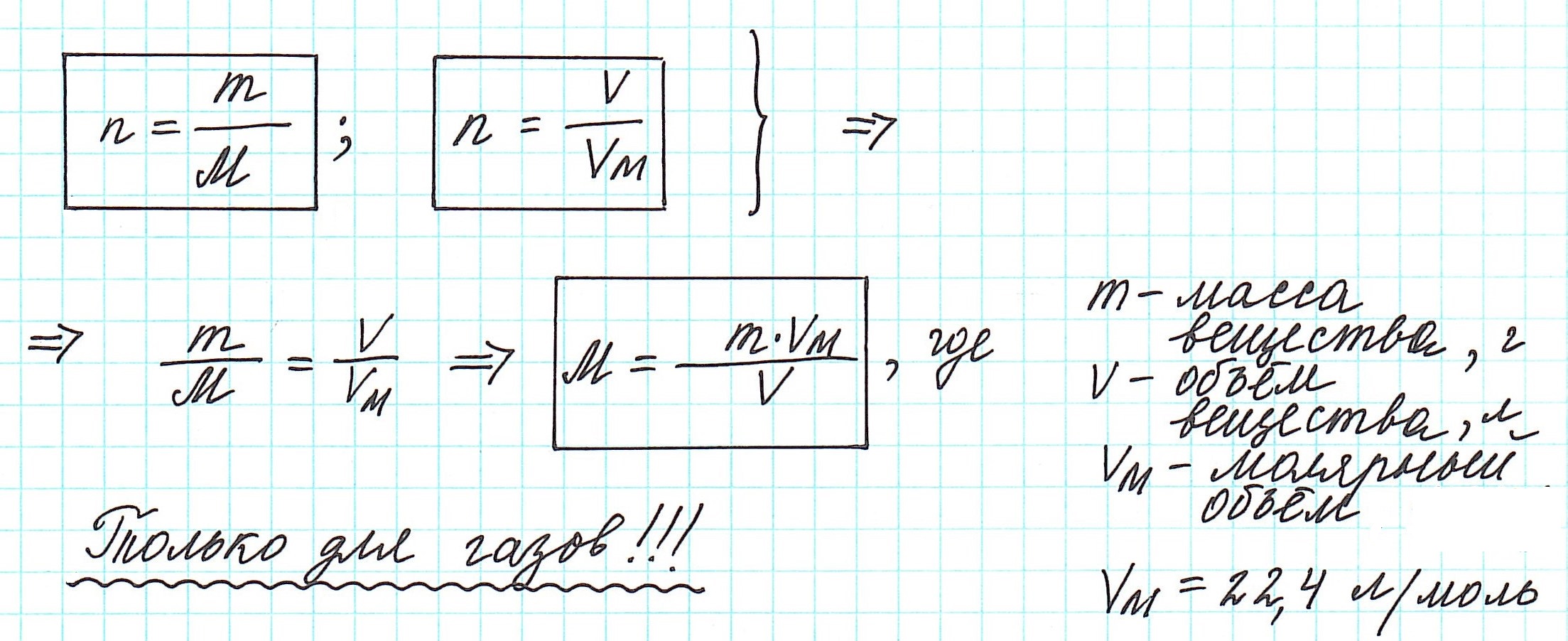как узнать относительную молекулярную массу
Урок 7. Относительная молекулярная и относительная формульная массы
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Относительная молекулярная масса
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr . При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля ( w ) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Краткие выводы урока:
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Относительная молекулярная масса
Молекулярная масса
Атомы и молекулы – мельчайшие частицы любых химических вещества. Если постараться выразить их массу в граммах, то получится число, в котором перед запятой будет находиться около 20 нулей. Поэтому измерять массу в таких единицах, как граммы, неудобно. Чтобы выйти из этой ситуации, следует какую-нибудь очень малую массу принять за единицу, а все остальные массы выражать по отношению к ней. В качестве этой единицы используют 1/12 массы атома углерода.
Относительна молекулярная масса – это масса молекулы вещества, которую измеряют в атомных единицах массы. Молекулярная масса равна отношению массы молекулы того или иного вещества к 1/12 части массы атома углерода. Она показывает, во сколько раз масса молекулы определенного вещества больше 1/12 массы атома углерода.
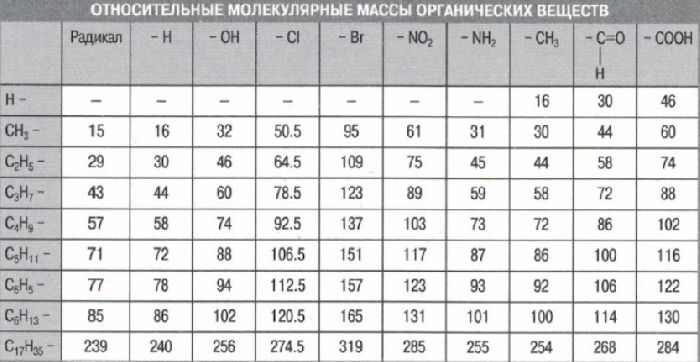
Рис. 1. Таблица молекулярных масс органических веществ.
Молекулярную массу часто путают с молярной массой, единицей измерения которой является г/моль. И действительно численно эти две величины абсолютно идентичны, однако размерность у них абсолютно разная.
Относительную молекулярную массу можно найти, сложив между собой атомные массы
Чтобы вычислить молекулярную массу простых и сложных веществ, необходимо найти сумму относительных атомных масс атомов, входящих в состав молекулы. Например, относительная молекулярная масса воды Mr (H2O), которая состоит, как известно, из двух атомов водорода и одного атома кислорода, равна 1*2+16=18.
Рис. 2. Формула относительная молекулярная масса.
Атомная масса
Атомная масса химического элемента – также одно из важнейших обозначений в химии. Атомная масса – это средняя величина из атомных масс устойчивых природных изотопов этого элемента с учетом их относительного содержания в природе (их природного распространения). Так, в природе существуют два устойчивых изотопа элемента хлора Cl с массовыми числами 35 и 37:
Ar(Cl)=(34.97*0.7553)+(36.95*0.2447)=35.45 – именно такая величина принята для элемента хлора в качестве его относительной атомной массы.
Впервые вычисление атомных весов были сделаны Д. Дальтоном. Атомные веса элементов он относил к атомному весу водорода, приняв его за единицу. Однако вычисленные в соответствии с его принципом «наибольшей простоты» вес атома кислорода и некоторых других элементов оказались неверными.
Что мы узнали?
В школьной программе по химии (8 класс) большое внимание уделяется таким понятием, как относительная атомная и молекулярная масса вещества. Учащиеся изучают их отличия и особенности, а также учатся определять массы газов и веществ.
Относительная молекулярная масса — формула, примеры, таблица (химия, 8 класс)
Для химиков важно знать массы молекул исследуемых ими веществ. Измерять их в килограммах неудобно, поэтому ученые используют а. е. м. – атомные единицы массы.
Понятие атомной единицы массы
На сегодняшний день принята договоренность, что масса атома углерода (а точнее его изотопа углерод-12) в точности равна 12 а. е. м. По этой причине используемую химиками величину иногда называют углеродной единицей. Ранее ученые использовали другие единицы – водородную и кислородную, но они по ряду причин оказались неудобными. Опыты показывают, что 1 а. е. м. равна примерно 1,66•10 –27 кг.
Атомная масса показывает, какую массу имеет тот или иной атом. Найти ее можно в таблице Менделеева. Обычно в этой таблице масса записана как дробное число, очень близкое к какому-либо целому значению. Например, атомная масса водорода составляет 1,000797 а. е. м., у гелия она равна 4,0026 а. е. м., а у кислорода 15,9994 а. е. м. При решении практических задач принято округлять эти значения до целых чисел. То есть надо считать, что у водорода атомная масса равна 1 а. е. м, у гелия – 4 а. е. м., у кислорода – 16 а. е. м. Исключением является хлор, чью массу округляют до значения 35,5 а. е. м.
Важно понимать, что на самом деле у одного и того же элемента атомы могут иметь различную массу. Такие отличающиеся по массе атомы называются изотопами. У изотопов одного элемента одинаковое количество протонов, но различное количество нейтронов. При этом все изотопы одного элемента имеют одинаковые химические свойства.
В таблице Менделеева указан средний вес всех изотопов, при этом учитывается их распространенность в природе. Например, у кислорода есть три стабильных изотопа:
С учетом этого атомная масса кислорода, указанная в таблице Менделеева, рассчитывается так:
(15,9949•99,759 + 16,9991•0,037 + 17,9991•0,204)/100 = 15,9994 а. е. м.
Молекулярная масса
Зная атомные массы отдельных элементов, можно находить и молекулярные массы молекул. Для этого надо всего лишь сложить атомные массы тех атомов, которые входят в состав молекулы.
Например, рассмотрим молекулу метана, она имеет формулу СН4, то есть состоит из 1 атома углерода (который весит 12 а. е. м.) и 4 атомов водорода (каждый массой по 1 а. е. м.). Складываем атомные массы:
12 + 1 + 1 + 1 + 1 = 12 + 4•1 = 16 а. е. м.
Итак, молекула метана имеет молекулярную массу 16 а. е. м.
Заметим, что очень часто возникает путаница из-за молекул простых газов – водорода, кислорода, азота и т. д. Дело в том, что их молекулы состоят из двух атомов, поэтому и масса у них вдвое больше, чем масса атомов. Например, атомная масса элемента кислород – 16 а. е. м., а вот молекула кислорода, имеющая формулу О2, весит уже 16•2 = 32 а. е. м.
Молярная масса
Молекулярные массы веществ тесно связаны с понятием молярной массы. Молярная масса – это масса 1 моля вещества. Численно она совпадает с молекулярной массой, но измеряется в других величинах – в граммах на моль, или в г/моль.
Молярная масса позволяет определять, легче или тяжелее воздуха тот или иной газ. Для этого надо лишь сравнить молярную массу газа с молярной массой воздуха, составляющей 28,98 г/моль. Так, кислород оказывается тяжелее воздуха, так как его молярная масса – 32 г/моль. Азот же легче воздуха, ведь его масса равна 28 г/моль. Здесь следует уточнить, что воздух не является отдельным веществом в химическом смысле слова, то есть никаких «молекул воздуха» не существует (поэтому не существует и понятия «молекулярная масса воздуха»). В реальности воздух – это смесь нескольких газов, преимущественно азота и кислорода. При этом более тяжелые молекулы чаще встречаются в нижних слоях атмосферы, а легкие молекулы – на высоте. По этой причине (но отнюдь не только из-за нее) в горах тяжело дышать – на большой высоте воздух содержит меньше кислорода и больше азота.
Подведение итогов
Молекулярная масса показывает, какую массу имеет та или иная молекула. Для ее вычисления достаточно сложить массы входящих в молекулу атомов. Молекулярная масса численно равна молярной массе, и по ней можно оценить, какой газ легче воздуха, а какой – тяжелее.
МОЛЯРНАЯ МАССА И ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА: В ЧЕМ ОТЛИЧИЕ И ПОЧЕМУ ОНИ ЧИСЛЕННО РАВНЫ
Как вычислить молярную массу вещества? В каких единицах она измеряется?
А еще есть относительная молекулярная масса. Почему она относительная и численно равна молярной массе? Может быть это одно и то же?
Вот сколько вопросов возникает сразу в отношении такого простого на первый взгляд понятия, как молярная масса.
Разберемся по порядку и научимся ее определять.
Относительная атомная масса
Огромнейший вклад в развитие и обоснование понятия относительная атомная масса внесли в разное время французский ученый Гей-Люссак, итальянский ученый А.Авогадро и шведский ученый Й.Я. Берцелиус.
Не углубляясь в историю вопроса, вспомним, что любой химический элемент представляет собой определенную разновидность атомов. Сегодня мы знаем, что атомы химических элементов имеют свои особые характеристики.
И самая главная из них, определяющая практически все остальные, это заряд ядра. А так как заряд ядра обусловлен присутствием в нем протонов, а заряд одного протона равен +1, то и количество протонов, соответственно, также является важнейшей характеристикой атомов химических элементов.
Основную массу атома составляет ядро, которое кроме протонов содержит еще и нейтроны. Масса последних сопоставима с массой первых. Оболочку атома составляют электроны.
По числу частиц в атоме, а точнее, по их суммарной массе, атомы химических элементов можно условно разделить на тяжелые и легкие. Например, легким элементом является водород, так как его атомы имеют самую маленькую массу. А свинец — это уже тяжелый элемент. Масса его атома в 302 раза тяжелее массы атома водорода.
Но тем не менее, как бы мы не делили все атомы на тяжелые или легкие, абсолютная масса (mA) каждого из них ничтожно мала, как мала и масса составляющих их частиц. Например,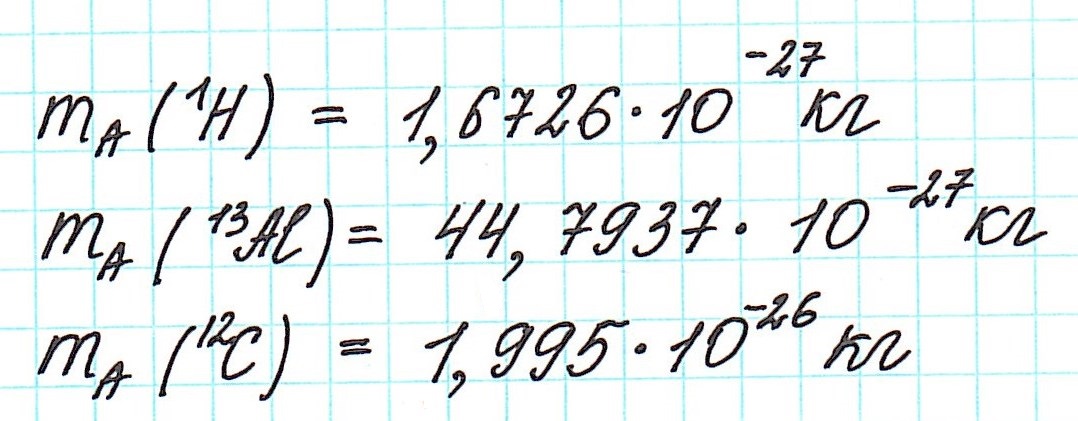
Величина, с которой сравнивают массу атома
Первоначально еще Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого. Позднее появилась так называемая кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что большинство атомов химических элементов образуют соединения с кислородом.
Однако, с развитием атомной физики и эта единица стала крайне неудобной. Все потому, что кислород в природе имеет несколько изотопов (а именно 3 устойчивых, всего же их 16). А изотопы, как известно, отличаются своей атомной массой. Из-за большого разнообразия изотопов и их различной устойчивости кислородная единица утратила свою актуальность.
Почему именно углерод? Да потому, что:
— у углерода всего 2 изотопа: 12 С и 13 С; причем первого 98,9%;
— количество органических веществ (их основу составляет, как известно, именно углерод) в сотни раз больше, чем неорганических;
— при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные массы всех элементов изменились не существенно, что оказалось очень удобным.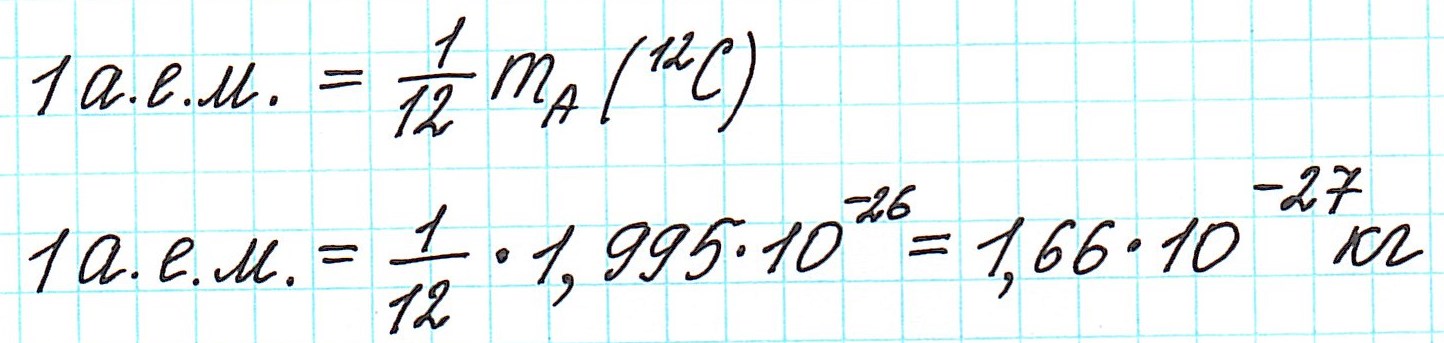
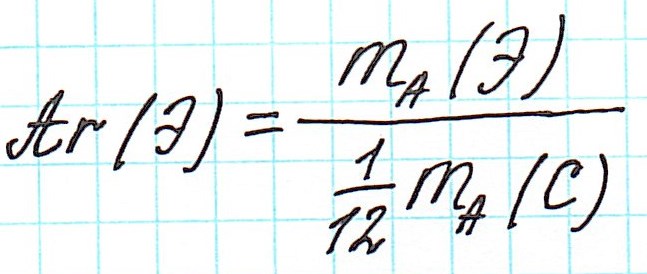
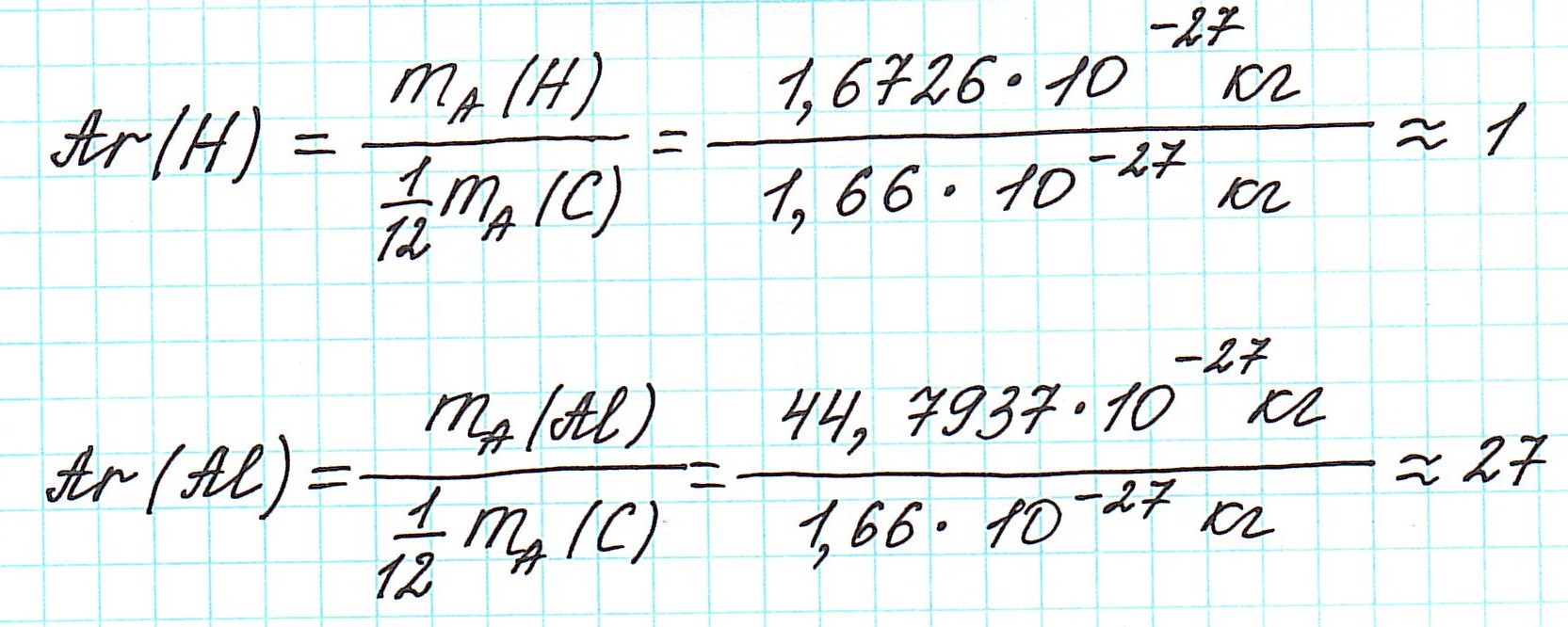
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16 О, на 0,04% из изотопа 17 О и на 0,20% из изотопа 18 О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Относительная молекулярная масса
А как же найти относительную молекулярную массу?
Здесь не все так просто. Понятие «относительная молекулярная масса» не всегда применяется корректно. Правильнее было бы говорить о «формульной массе».
Дело в том, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2SO4, глюкоза C6H12O6 и т.д. И к ним в полной мере можно применить термин «относительная молекулярная масса».
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их относительных атомных масс. Например: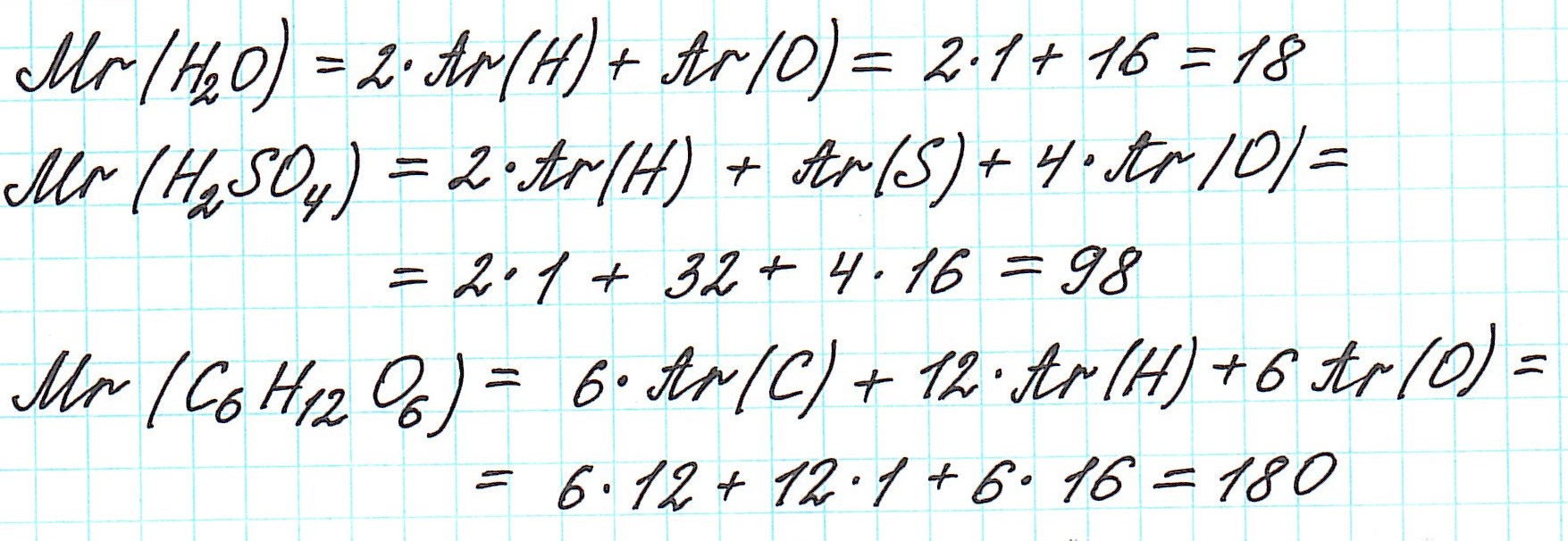
В связи с этим для подобных веществ вычисляется формульная масса. А вычисляется она все по тому же принципу, что и молекулярная масса. Обозначается так же — Mr. Например, для хлорида натрия:
Точно так же, как относительную атомную массу (Ar), относительную молекулярную массу (Mr) будем сопоставлять с 1/12 частью атома изотопа углерода 12 С.
В последующем говорим о Mr.
Количество вещества и молярная масса
В практических расчетах все-таки требуется вычислять массы, взятые в граммах, килограммах ато и в тоннах (если речь идет о каком-то производстве, например).
Как же поступают тогда?
Количество вещества, которое содержит столько же частиц (атомов, ионов, молекул – в зависимости от строения), что и 12 г изотопа углерода 12 С, назвали молем.
Один моль вещества (любого!) всегда содержит 6,02·10 23 его частиц ( постоянная Авогадро ).
Ну, а так как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе.
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль.
Таким образом, молярная масса и количество вещества связаны соотношением:
Можно также определить и такие отношения, связанные с количеством вещества:
Почему же относительная молекулярная и молярная массы равны?
Итак, относительная молекулярная и молярная массы, как следует из их определений – это не одно и то же.
Докажем, каким образом обе массы численно могут быть равны:
Как вычислить молярную массу вещества
Мы уже знаем, что относительная молекулярная масса складывается из относительных атомных масс.
При нахождении относительной молекулярной массы (Mr), а значит и молярной (М), выполняем следующие действия :
1) правильно записываем формулу вещества;
2) анализируем качественный состав (атомы каких элементов составляют вещество) и количественный состав (в каких количествах находятся эти атомы – смотрим по индексам, которые стоят справа внизу от знака химического элемента);
3) в периодической системе химических элементов находим элементы, атомы которых составляют вещество, и округляем относительную атомную массу, стоящую рядом со знаком элемента, до целого числа (! у хлора – до 35,5);
4) складываем относительные атомные массы всех элементов с учетом количества атомов.
Рассмотрим еще примеры:
Как вычислить молярную массу вещества, находящегося в газообразном состоянии
Это означает, что в данных условиях отношение масс газов друг к другу является отношением их молярных масс:


Вычислить молярную массу вещества (а, значит, и относительную молекулярную), находящегося в газообразном состоянии, можно, используя молярный объем газа (VM):
Итак, подведем итог:
Без вычисления молярной массы не обходится решение практически ни одной задачи. Если вы поняли, что такое молярная и относительная молекулярная массы и как их вычислять, но еще не умеете решать задачи с их применением, то самое время научиться.
Разбор простых типовых задач по химии в книге, которую вы можете совершенно БЕСПЛАТНО скачать здесь.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
КОЛИЧЕСТВЕННЫЕ СООТНОШЕНИЯ
Атомная масса
Большинство природных химических элементов представляют собой смесь изотопов. Поэтому за относительную атомную массу элемента принимают среднее значение относительной атомной массы природной смеси его изотопов с учетом их содержания в земных условиях. Именно эти значения и приведены в Периодической системе.
Например, кислород имеет три изотопа 16 О, 17 О и 18 O, их атомные массы и содержание в природной смеси приведены в таблице ниже.
| Изотоп | Содержание в природной смеси, атомн. % ni | Атомная масса изотопа а.е.м. Аr,i |
| 16 О | 99,759 | 15,995 |
| 17 О | 0,037 | 16,999 |
| 18 О | 0,204 | 17,999 |
Среднее значение атомной массы с учетом вклада каждого изотопа вычисляется по следующей формуле:
Подставив в эту формулу соответствующие значения из таблицы для атомной массы кислорода, получим:
Относительные атомные массы имеют дробные значения по следующим причинам:
При образовании любой связи всегда выделяется энергия, на что и расходуется часть массы связывающихся частиц. В случае образования химических связей эта величина очень мала, поэтому изменением массы здесь пренебрегают и считают, что масса образовавшейся частицы равна сумме масс частиц, участвующих в ее образовании. При образовании же ядра выделяется очень большая энергия, и «дефект массы» хорошо заметен.
Молекулярная масса
— масса молекулы, выраженная в а.е.м. Масса молекулы практически равна сумме относительных атомных масс входящих в нее атомов.
Если же вещество состоит не из молекул, а, например, из ионов (NaCl), или является олигомером [(Н2О)n], то относительную молекулярную массу указывают для формульной единицы вещества. Под формульной единицей вещества следует понимать химический состав наименьшего количества данного вещества.
вещества (М) равна отношению массы этого вещества (m) к его количеству (ν):
Прежнее определение: масса одного моля вещества, численно равна его молекулярной массе, но выражается в единицах [г/моль].
Молярная масса и молярный объем
Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то молярная масса вещества пропорциональна массе соответствующей структурной единицы, т. е. относительной молекулярной (или атомной) массе данного вещества:
Согласно закону Авогадро одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует, что при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем. Нетрудно рассчитать, какой объем занимает один моль газа при нормальных условиях, т. е. при нормальном атмосферном давлении (101,325 кПа) и температуре 273 К. Например, экспери-ментально установлено, что масса 1 л кислорода при нормальных условиях равна 1,43 г. Следовательно, объем, занимаемый при тех же условиях одним молем кислорода (32 г), составит 32 : 1,43 = 22,4 л. То же число получим, рассчитав объем одного моля водорода, диоксида углерода и т.д.
Отношение объема, занимаемого веществом, к его количеству называется вещества.
Как следует из изложенного, при нормальных условиях молярный объем любого газа равен 22,4 л/моль (точнее, Vn = 22,414 л/моль). Это утверждение справедливо для такого газа, когда другими видами взаимодействия его молекул между собой, кроме их упругого столкновения, можно пренебречь. Такие газы называются идеальными. Для неидеальных газов, называемых реальными, молярные объемы различны и несколько отличаются от точного значения. Однако в большинстве случаев различие сказывается лишь в четвертой и последующих значащих цифрах.
Молярная масса газа
Для определения относительной молекулярной массы вещества обычно находят численно равную ей молярную массу вещества (в г/моль). Если вещество находится в газообразном состоянии, то его молярная масса может быть найдена с помощью закона Авогадро. По этому закону равные объемы газов, взятых при одинаковой температуре и одинаковом давлении, содержат равное число молекул. Отсюда следует, что массы двух газов, взятых в одинаковых объемах, должны относиться друг к другу, как их молекулярные массы или как численно равные их молярные массы:
Обозначим относительную плотность газа m1/m2 буквой D. Тогда:
равна его плотности по отношению к другому газуу умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода с точностью до сотых равна 2 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид:
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше, равна 22, находим:
Нередко также молярную массу газа вычисляют, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, все же можно говорить о средней молярной массе воздуха, определенной из плотности воздуха по водороду. Найденная таким путем молярная масса воздуха равна 29 г/моль. Обозначив плотность исследуемого газа по воздуху через D получим следующее уравнение для вычисления молярных масс:
Молярную массу вещества (а следовательно, и его относительную молекулярную массу) можно определить и другим способом, используя понятие о молярном объеме вещества в газообразном состоянии. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества в газообразном состоянии, а затем вычисляют массу 22,4 л этого вещества при тех же условиях. Полученная величина и выражает молярную массу вещества.
Пример: 0,7924 г хлора при 0°С и давлении 101,325 кПа занимают объем, равный 250 мл. Вычислить относительную молекулярную массу хлора. Находим массу хлора, содержащегося в объеме 22,4 л (22400 мл): m = 22400*0,7924/250 ≈ 71 г. Следовательно, молярная масса хлора равна 71 г/моль, а относительная молекулярная масса хлора равна 71.
Измерения объемов газов обычно проводят при условиях, отличных от нормальных. Для приведения объема газа к нормальным условиям можно пользоваться уравнением, объединяющим газовые законы Бойля-Мариотта и Гей-Люссака:
Если объем и давление газа выражены в других единицах измерения, то значение газовой постоянной в уравнении Клапейрона-Менделеева примет другое значение. Оно может быть рассчитано по формуле, вытекающей из объединенного закона газового состояния для моля вещества при нормальных условиях:
Пример: Какое значение газовой постоянной следует взять для расчета параметров газа, взятого при давлении 10 атм в объеме 100 л?
Описанными способами можно определять молярные массы не только газов, но и всех веществ, переходящих при нагревании (без разложения) в газообразное состояние. Для этого навеску исследуемого вещества превращают в пар и измеряют его объем, температуру и давление. Последующие вычисления производят так же, как и при определении молярных масс газов. Молярные массы, определенные этими способами, не вполне точны, потому что рассмотренные газовые законы и уравнение Клапейрона-Менделеева строго справедливы лишь при очень малых давлениях. Более точно молярные массы вычисляют на основании данных анализа вещества.
Доли вещества
Парциальное давление газа
При определении молекулярных масс газов очень часто приходится измерять объем газа, собранного над водой и потому насыщенного водяным паром. Определяя в этом случае давление газа, необходимо вводить поправку на парциальное давление водяного пара. При обычных условиях различные газы смешиваются друг с другом в любых соотношениях. При этом каждый газ, входящий в состав смеси, характеризуется своим парциальным давлением.
— это давление (pi) которое производило бы имеющееся в смеси количество данного газа, если бы оно одно занимало при той же температуре весь объем, занимаемый смесью.
Если не учитывать поправку на давление паров воды, то вместо найденного объема получим:
Ошибка составит 13 мл, т. е. около 2,5%, что можно допустить только при ориентировочных расчетах.
Эквивалент. Количество вещества эквивалентов
Из закона постоянства состава следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях. Поэтому в химии введено понятие эквивалента (слово «эквивалентный» в переводе означает «равноценный»).
называют условные частицы вещества в целое число раз меньшие, чем соответствующие им формульные единицы.
В окислительно-восстановительных реакциях значения эквивалентного числа окислителя и восстановителя определяют по числу электронов, которые принимает 1 формульная единица окислителя или принимает 1 формульная единица восстановителя.
Если известно количество вещества, то количество вещества эквивалентов всегда в число эквивалентности раз больше (или равно) количества вещества:
В практических расчетах наиболее часто пользуются молярной массой эквивалентов.
вещества В называется отношение массы вещества В к его количеству вещества эквивалентов:
Наряду с понятием молярной массы эквивалентов вещества иногда удобно пользоваться понятием объема эквивалентов газообразного вещества В. Данный объем рассчитывается как молярный объем данного газа, деленный на число эквивалентности вещества:
Понятие об эквивалентах, молярных массах эквивалентов и объемах эквивалентов газообразного вещества распространяется также на сложные вещества. Эквивалентом сложного вещества является такое его количество, которое взаимодействует без остатка с одним эквивалентом любого другого вещества. Такой расчет возможен благодаря закону эквивалентов.