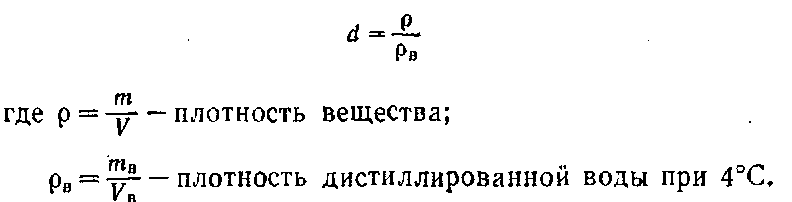как узнать плотность раствора
Как определить плотность раствора
Раствор характеризуется объемом, концентрацией, температурой, плотностью и другими параметрами. Плотность раствора меняется в зависимости от массы и концентрации растворенного вещества.
Ключевой формулой для плотности является ρ=m/V, где ρ – плотность, m – масса раствора, V – его объем. Плотность может выражаться, например, в килограммах на литр, или в граммах на миллилитр. В любом случае, она показывает, сколько вещества по массе приходится на единицу объема.
Масса раствора складывается из массы жидкости и массы растворенного в ней вещества: m(раствора)=m(жидкости)+m(растворенного вещества). Масса растворенного вещества и объем раствора могут быть найдены из известного значения концентрации и молярной массы.
Пусть, например, в задаче дана молярная концентрация раствора. Она обозначается химической формулой соединения в квадратных скобках. Так, запись [KOH]=15 моль/л означает, что в одном литре раствора содержится 15 моль вещества гидроксида калия.
Молярная масса KOH составляет 39+16+1=56 г/моль. Молярные массы элементов можно посмотреть в таблице Менделеева, они указываются обычно снизу от наименования элемента. Количество вещества, масса вещества и его молярная масса связаны соотношением ν=m/M, где ν – количество вещества (моль), m – масса (г), M – молярная масса (г/моль).
Растворы, помимо жидкостных, бывают еще и газовыми. В этом случае необходимо понимать, что в равных объемах газа, близкого к идеальному, при одних и тех же условиях содержится одно и то же число молей. К примеру, при нормальных условиях один моль любого газа занимает объем Vm=22,4 л/моль, который назван молярным объемом.
В решении задачи на плотность газового раствора может понадобиться соотношение, устанавливающее связь между количеством вещества и объемом: ν=V/Vm, где ν – количество вещества, V – объем раствора, Vm – молярный объем, постоянная величина для данных условий. Как правило, в подобных задачах обговаривается, что условия являются нормальными (н.у.).
Определение плотности растворов
В химических исследованиях очень часто приходится определять плотность. Плотностью вещества [P] называют отношение массы [m] тела к его объему [V]:
Плотность тела не зависит от его местонахождения на Земле, в то время как удельный вес изменяется в зависимости от того, в каком месте Земли его измерять. В ряде случаев предпочитают пользоваться так называемой относительной плотностью, представляющей собой отношение его плотности к плотности другого вещества при определенных условиях.

Таким образом, при определении относительной плотности необходимо отмечать температуру, при которой оно проведено. Если измерение проведено не при той температуре, которая указана в справочнике, то вводят поправку, вычисляемую методом интерполяции.
Относительную плотность жидкостей чаще определяют при помощи ареометров (рис. 34).
| Рис.34. Ареометр | зависимости от плотности жидкости. Благодаря балласту во время измерения плотности ареометр находится в вертикальном положении. На верхней части нанесена шкала. |
Если определяют относительную плотность жидкости, нерастворимой в воде, то нужно обмыть ареометр каким-нибудь органическим растворителем.
Ареометр требует осторожного обращения (его можно легко разбить), что нужно всегда помнить при работе с ним.
Существуют специальные ареометры, сразу дающие нужную характеристику жидкости. Так, для спирта имеются специальные спиртометры, сразу показывающие процентное содержание спирта; для молока применяются так называемые лактометры, показывающие содержание жира в молоке, и т.п.
Дата добавления: 2014-12-30 ; просмотров: 49 ; Нарушение авторских прав
Плотность раствора соли (ВПР физика 2020)
Да, плотность кристаллической соли — это все-таки не масса сыпучей соли на объем, а вполне конкретная величина. Таблица говорит, что это 2,17 г/см^3.
Объем кристаллической соли у нас тогда будет [m] \frac<60><2,17>=27,6 [/m] мл
И тогда плотность раствора [m] \frac<310><250+27,6>=\frac<310><277,6>=1,117 [/m] г/мл
Все равно не совпадает. Хотя если вы опечатались и набрали 1181 вместо 1118, тогда все хорошо
Угу, ну я бы тоже решал, как решала ТС. Но ответ реально получится (фактически) неправильный из-за разности плотностей кристаллической и сыпучей соли.
Если у вас есть вариант, то есть и ответы?
Если все в задаче так, как вы описали, и без таблиц, то ответ должен быть такой, какой указала ТС. Никаких данных, очевидно, больше неоткуда взять.
Ответ 1181 кг/куб.м не верный.
Дано:
m_соли = 6г * 10 ложек = 60г.
V_воды = 250 мл.
Р_воды = 1 г/мл.
Решение:
1. Найдем массу воды:
m_воды = V_воды * Р_воды = 250 мл * 1 г/мл = 250 г
2. Считая что вся соль полностью растворяется во всем объёме воды, найдем плотность:
P = m_воды + m_соли / V_воды = 60 г + 250 г / 250 мл = 1,24 г/мл = 1240 кг/ куб. м
Ответ: 1240 кг/ куб. м.
А что бы узнать какая же на самом деле плотность обратимся к химии раздел растворы.
Дано:
m_соли = 6г * 10 ложек = 60г.
V_воды = 250 мл.
Р_воды = 1 г/мл.
Решение:
1. Найдем массу воды:
m_воды = V_воды * Р_воды = 250 мл * 1 г/мл = 250 г
2. Найдем массу раствора:
m_р-ра = m_воды + m_соли = 250 г + 60 г = 310 г
3. Найдем массовую концентрацию соли в растворе
W_соли = m_соли/ m_р-ра = 60 г / 310 г = 0,1935 = 19,35 %
Найдем плотность раствора соли (имеется в виду хлорид натрия) для этой концентрации по таблице из википедии хлорид натрия.
В таблице отсутствует плотность для концентрации 19%, но есть плотности для концентраций 18% и 20%. Воспользуемся линейной интерполяцией.
4. Найдем коэффициенты линейной функции для интерполяции вида y = a*x + b, если: x1 = 18%, y1 = 1,132 г/мл; x2 = 20%, y2 = 1,148 г/мл.
a = (y2 – y1) / (x2 – x1) = (1,148 — 1,132) / (20 – 18) = 0,008
b = y1 – x1*a = 1,132 – 18*0,008 = 0,988
5. Найдем плотность раствора для концентрации 19,35% через функцию линейной интерполяции
P_раствора= a* W_соли +b = 0,008*19,35%+0,988 = 1,1428 г/мл = 1142,8 кг/куб.м
Кстати в этой же таблице есть плотность 1,18 г/мл = 1180 кг/куб.м, но она для концентрации 24%. Видимо 1181 кг/куб.м взяли из подобной таблицы, только посчитали не концентрацию соли в растворе, а отношение массы соли к массе воды: 60 г / 250 г = 0,24 = 24%, что к таблице вообще не относится.
ОПРЕДЕЛЕНИЕ ПЛОТНОСТИ (1 2 3)
Плотностью вещества называют отношение массы тела к его объему:
Следовательно, плотность вещества выражают * в г/см3. Удельным весом у называют отношение веса (силы тяжести) вещества к объему:
Плотность и удельный вес вещества находятся в такой же зависимости между собой, как масса и вес, т. е.
где g — местное значение ускорения силы тяжести при свободном падении. Таким образом, размерность удельного веса ‘(г/см2 • сек2) и плотности (г/см3), а также их числовые значения, выраженные в одной системе единиц, отличаются друг от друга *.
Плотность тела не зависит от его местонахождения на Земле, в то время как удельный вес изменяется в зависимости от того, в каком месте Земли его измерить.
В ряде случаев предпочитают пользоваться так называемой относительной плотностью, представляющей собой отношение плотности данного вещества к плотности другого вещества при определенных условиях. Относительная плотность выражается отвлеченным числом.
Относительную плотность d жидких и твердых веществ принято определять по отношению к плотности дистиллированной воды:
Само собой разумеется, что р и рв должны выражаться одинаковыми единицами.
Относительную плотность d можно также выражать отношением массы взятого вещества к массе дистиллированной воды, взятой в том же объеме, что и вещество, при определенных, постоянных условиях.
Поскольку числовые значения как относительной плотности, так и относительного удельного веса при указанных постоянных условиях являются одинаковыми, пользоваться таблицами относительных удельных весов в справочниках можно так же, как если бы это были таблицы плотности.
Относительная плотность является постоянной величиной для каждого химически однородного вещества и для растворов при данной температуре. Поэтому по
* В технической системе единиц (MKXCC). в которой за основную единицу принята не единица массы, а единица силы — килограмм-сила (кГ или кгс), удельный вес выражается в кГ/м3 или Г/см3. Следует отметить, что числовые значения удельного веси, измеренного в Г/см3, и плотности, измеренной в г/см3, совпадают, что нередко вызывает путаницу в понятиях «плотность» и «удельный вес».
* В ряде случаев плотность выражают в г/мл. Различие между числовыми значениями плотности, выраженными в г/см3 и г/мл, очень незначительно. Его следует принимать во внимание лишь при работах особой точности.
Поэтому по величине относительной плотности во многих случаях можно судить о концентрации вещества в растворе.
* В технической системе единиц (MKXCC). в которой за основную единицу принята не единица массы, а единица силы — килограмм-сила (кГ или кгс), удельный вес выражается в кГ/м3 или Г/см3. Следует отметить, что числовые значения удельного веси, измеренного в Г/см3, и плотности, измеренной в г/см3, совпадают, что нередко вызывает путаницу в понятиях «плотность» и «удельный вес».
Обычно плотность раствора увеличивается с увеличением концентрации растворенного вещества (если оно само имеет плотность больше, чем растворитель). Но имеются вещества, для которых увеличение плотности с увеличением концентрации идет только до известного предела, после которого при увеличении концентрации происходит уменьшение плотности.
Например, серная кислота имеет наивысшую плотность, равную 1,8415 при концентрации 97,35%. Дальнейшее увеличение концентрации сопровождается уменьшением плотности до 1,8315, что соответствует 99,31%.
Уксусная кислота имеет максимальную плотность при концентрации 77- 79%, а 100%-ная уксусная кислота имеет ту же плотность, что и 41%-ная.
Относительная плотность зависит от температуры, при которой ее определяют. Поэтому всегда указывают температуру, при которой делали определение, и температуру воды (объем взят за единицу). В справочниках это показывают при помощи соответствующих индексов, например eft; приведенное обозначение указывает, что относительная плотность определена при температуре 2O0C и за единицу для сравнения взята плотность воды при температуре 4е С. Встречаются также и другие индексы, обозначающие условия, при которых производилось определение относительной плотности, например Я4 Ul и т. д.
Изменение относительной плотности 90%-ной серной кислоты в зависимости от температуры окружающей среды приводится ниже:
Относительная плотность с повышением температуры уменьшается, с понижением ее —увеличивается.
При определении относительной плотности необходимо отмечать температуру, при которой оно проведено, и полученные величины сравнивать с табличными данны-, ми, определенными при той_же температуре.
Если измерение проведено не при той температуре, которая указана в справочнике, то. вводят поправку, вычисляемую как среднее изменение относительной плотпости на один градус. Например, если в интервале между 15 и 20 0C относительная плотность 90%-ной серной кислоты уменьшается на 1,8198—1,8144 = 0,0054, то в среднем можно принять, что при изменении температуры на 1 0С (выше 15 0C) относительная плотность уменьшается на 0,0054 : 5 = 0,0011.
Таким образом, если определение вести при 18 0C, то относительная плотность указанного раствора должна быть равна:
Однако для введения температурной поправки к относительной плотности удобнее пользоваться приведенной ниже номограммой (рис. 488). Эта номограмма, кроме того, дает возможность но известной относительной плотности, вычисленной при стандартной температуре 20° С, приближенно определять относительную плотность при других температурах, в чем иногда может возникнуть потребность.Относительную плотность жидкостей можно определять при помощи ареометров, пикнометров, специальных весов и т. п.
Определение относительной плотности ареометрами.
Для быстрого определения относительной плотности жидкости применяют так называемые ареометры (рис. 489). Это—стеклянная трубка (рис. 489, а), расширяющаяся внизу и имеющая на конце стеклянный резервуар, заполненный дробью нли специальной массой, (реже — ртутью). В верхней узкой части ареометра имеется шкала с делениями. Чем меньше относительная плотность жидкости, тем глубже погружается в нее ареометр. Поэтому на его шкале вверху нанесено наименьшее значение относительной плотности, которое можно определить данным ареометром, внизу — наибольшее. Например, у ареометров для жидкостей с относительной плотностью меньше единицы внизу стоит 1,000, выше 0,990, еще выше 0,980 и т. д.
Промежутки между цифрами разделены на более мелкие деления, позволяющие определять относительную плотность с точностью до третьего десятичного знака. У наиболее точных ареометров шкала охватывает значения относительной плотности в пределах 0,2—0,4 единицы (например, Для определения плотности от 1,000 до 1,200, от 1,200 до 1,400 и т. д.). Такие ареометры обычно продают в виде наборов, которые дают возможность определять относительную плотность в широком интервале.
Номограмма для введения температурной поправки
Иногда ареометры снабжены термометрами (рис. 489,6), что позволяет одновременно измерять температуру, при которой проводится определение. Для определения относительной плотности при помощи ареометра жидкость наливают в стеклянный цилиндр (рис. 490) емкостью не менее 0,5 л, сходный по форме с мерным, но без носика и делений. Размер цилиндра должен соответствовать размеру ареометра. Наливать жидкость в цилиндр до краев не следует, так как при погружении ареометра жидкость может перелиться через край. Это бывает даже опасно при измерении плотности концентрированных кислот или концентрированных щелочей и пр. Поэтому уровень жидкости в цилиндре должен быть на несколько сантиметров ниже края цилиндра.
Иногда цилиндр для определения плотности имеет вверху желоб, расположенный концентрически, так что если жидкость при погружении ареометра перельется через край, то она не выльется на стол.
Для определения относительной плотности имеются специальные приборы, поддерживающие постоянный уровень жидкости в цилиндре. Схема одного из таких приборов приведена на рис. 491. Это — цилиндр 2, имеющий на определенной высоте отводную трубку 3 для стекания жидкости, вытесняемой ареометром при погружении его в жидкость. Вытесняемая жидкость поступает в трубку 4, имеющую кран 5, через который жидкость может быть слита. Цилиндр можно наполнять исследуемой жидкостью через уравнительную трубку /, имеющую в верхней части цилиндрическое расширение.
Определение плотности растворов



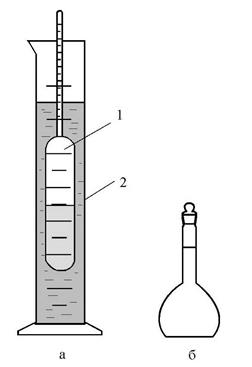
Для быстрого, но приближенного определения плотности служит ареометр.
Он представляет собой поплавок с дробью или ртутью и узким отростком-трубкой, в которой находится шкала с делениями. Ареометр погружается в различных жидкостях на различную глубину. При этом он вытесняет объемы этих жидкостей одной и той же массы, равной массе ареометра, а, следовательно, обратно пропорциональные их плотности. То деление шкалы, до которого ареометр погружается в жидкость, показывает плотность этой жидкости. В зависимости от заданной точности применяют один ареометр с большими интервалами на шкале или набор нескольких ареометров с мелкими делениями.
Ареометры, применяемые для определения плотности жидкостей тяжелее воды, имеют нуль вверху шкалы, а для жидкостей легче воды – внизу шкалы.
От плотности растворов можно перейти к массовой доле, пользуясь специальными таблицами. Если в таблицах не имеется цифры, точно отвечающей сделанному отсчету на шкале ареометра, а есть близкие величины (немного больше и немного меньше), то массовую долю растворенного вещества вычисляют методом интерполяции (определение промежуточной величины по двум известным крайним).
Определяют массовую долю методом интерполяции по следующей формуле:
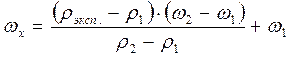
где rэксп. – экспериментально определенная плотность, которой соответствует концентрация ωx в %,
r1 – плотность раствора ближайшего меньшего значения концентрации (ω1),
r2 – плотность раствора ближайшего большего значения концентрации (ω2).
1. дать определение растворам. Назвать главные характеристики растворов.
2. Что называется концентрацией раствора?
3. Перечислить все известные способы выражения концентрации растворов.
4. Что такое молярность, моляльность, нормальность раствора и массовая доля?
5. Какая масса Na2CO3·10H2O потребуется для приготовления 50 г 5 %-го раствора в расчете на водную соль?
6. Рассказать принцип работы ареометра.
7. Рассчитать какое количество из BaCl2·2H2O требуется для приготовления 50 мл 0,5 н. раствора хлорида бария?
8. Какой объем 96 %-й серной кислоты потребуется для приготовления 50 мл 1 М раствора H2SO4 (плотность 1,84 г/мл).
9. Объяснить метод интерполяции.
ОПЫТ №1. Приготовление растворов с заданной массовой долей(из твердого вещества и воды).
Приготовить 50 г 5 %-го раствора карбоната натрия из кристаллической соды Na2CO3·10H2O и воды. Вычислить, какое количество Na2CO3·10H2O требуется для приготовления 50 г 5 %-го раствора в расчете на водную соль. Отвесить это количество измельченной соды в предварительно взвешенном стаканчике на электронных весах с точностью до 0,01 г. Рассчитать, какой объем воды необходим для растворения взятой навески. Отмерить мерным цилиндром этот объем воды. Вылить воду в стакан и растворить в ней отвешенную соль. Измерить температуру приготовленного раствора, если она не равна температуре, которая указана в таблице 6, довести ее до указанной величины, нагревая или охлаждая раствор. Вылить раствор в сухой высокий узкий цилиндр и опустить в него сухой ареометр так, чтобы он не касался стенок сосуда (рис. 14). Отметить то деление шкалы, которое совпадает с нижним мениском жидкости в цилиндре, произведя отсчет по шкале сверху вниз. Ареометр промыть водой, осторожно вытереть досуха и сдать лаборанту. Раствор вылить в приготовленную склянку для слива раствора.