как узнать результат неонатального скрининга
Неонатальный скрининг новорожденных: анализ, который спасает жизнь
В Московском центре неонатального скрининга, функционирующем в Морозовской детской больнице, ежегодно более 100 000 новорожденных проходят диагностику на тяжелые наследственные заболевания.
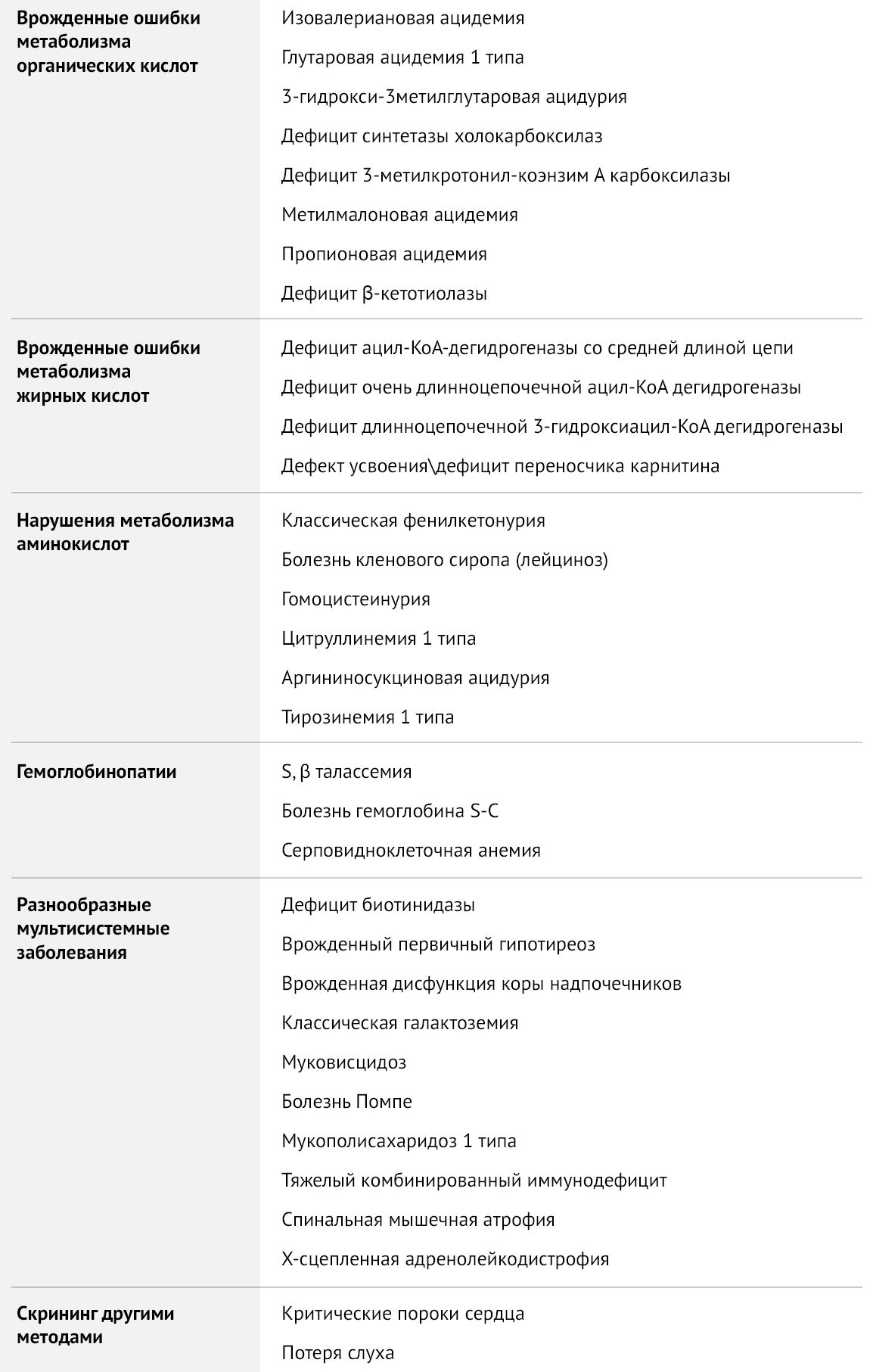
Исследование включает в себя тестирование 11 врожденных болезней: муковисцидоз, галактоземия, врожденная дисфункция коры надпочечников, врожденный гипотиреоз, фенилкетонурия, глутаровая ацидурия тип 1, тирозинемия тип 1, лейциноз, метилмалоновая/пропионовая ацидурия, недостаточность биотинидазы, недостаточность среднецепочечной ацилКоА дегидрогеназы жирных кислот.
«Отсутствие родственников с врожденной и наследственной патологией, к сожалению, не является гарантом рождения здорового ребенка, поэтому важно, чтобы родители не отказывались от проведения исследований. Наследственные заболевания представляют серьезную угрозу для здоровья и жизни детей. Благодаря ранней диагностике и вовремя начатому лечению малышу можно помочь справиться с тяжелыми проявлениями недуга. Наиболее ранний способ диагностики врожденных нарушений обмена веществ — неонатальный скрининг новорожденных. Он позволяет выявить опасную болезнь до появления симптомов, тем самым предотвратив развитие угрожающих жизни осложнений», — отметила заведующий медико-генетическим отделением Морозовской детской больницы, врач-генетик Татьяна Кекеева.
Как сообщила врач, анализ крови собирается у всех новорожденных в родильных домах города. Образцы крови из пяточки детей берут по истечении трех полных суток с момента рождения и направляют на исследование в Московский центр неонатального скрининга.
«Если признаков заболеваний не выявлено, результаты анализов не направляются ни в роддом, ни родителям новорожденного. Если выявлено повышение определенных показателей, ребенку показан немедленный повторный анализ. В случае выявления превышения показателей и в повторном анализе, наши сотрудники связываются с медицинским учреждением или с родителями малыша и приглашают их пройти уточняющую диагностику», — рассказала Татьяна Кекеева.
При подтверждении диагноза ребенок с наследственным заболеванием наблюдается у врача специалиста Морозовской больницы до 18 лет. Пациентам назначаются специализированные лекарственные препараты и лечебное питание, выписываются льготные рецепты.
Московский центр неонатального скрининга работает более пяти лет. Здесь анализируются данные обо всех родившихся в Москве детях с наследственными болезнями обмена, что позволяет оперативно выявить заболевание и своевременно назначить терапию.
Кроме того, специалисты центра консультируют детей в случае подозрения на другую моногенную патологию, хромосомные нарушения и проводят семейные консультации при подготовке к беременности и во время беременности (оценка рисков развития заболеваний у плода).
Скрининг новорожденным из пятки стандартный на 5 наследственных заболеваний и расширенный, 43 показателя
В детском медицинском центре «Санаре» проводится неонатальный скрининг на базе лаборатории Морозовской детской городской клинической больницы.

Суть скрининга в том, что выявляются достаточно часто встречающиеся в популяции заболевания, успех лечения которых целиком и полностью зависит от раннего начала терапии. В терапии этих состояний определяющую роль играет именно время и грамотный подход.
Согласно Приказу № 185 Минздравсоцразвития РФ от 22.03.2006 «О массовом обследовании новорожденных детей на наследственные заболевания», скрининг новорожденных проводится на 5 наследственных заболеваний:
Процедура забора крови для неонатального скрининга
Образец крови у новорожденного ребенка берется таким же способом, как для неонатального скрининга на фенилкетонурию, галактоземию, гипотиреоз, адреногенитальный синдром и муковисцидоз.
Исследование можно провести и для детей старшего возраста!
Если забор крови производится у ребенка старше 1 года, то кровь для проведения исследования берется из пальца.
Для новорожденного ребенка можно использовать пятна крови, которые были взяты для неонатального скрининга, у ребенка старшего возраста забор производится на специальный индивидуальный бланк-фильтр.
Наследственные болезни у детей
Врачи-клиницисты сегодня активно используют различные методы ранней диагностики заболеваний, передающихся по наследству. К ним относятся пренатальный биохимический скрининг и неинвазивные методики для плода, а также неонатальный скрининг новорожденных.
В отличие от врожденных заболеваний, наследственные болезни возникают в результате генетических нарушений. Иногда болезнь проявляет себя через некоторое время и при определенных факторах, которые являются пусковыми для ее развития. В иных случаях малыши уже рождаются больными.
Ранняя диагностика позволяет точно поставить диагноз, принять решение о сохранении беременности или подготовиться к длительному лечению ребенка.
Пренатальный скрининг наследственных болезней
Многие хромосомные и генные нарушения чреваты для плода врожденными патологиями, в том числе несовместимыми с жизнью. Например, малыши с синдромами Эдвардса и Патау часто гибнут и не доживают до года. Никакие медицинские меры, лекарства и способы не помогают продлить их существование. Причина этих синдромов — трисомия, когда вместо положенных двух копий, в результате генетических нарушений, образуются три копии определенной пары хромосом. При синдроме Эдвардса утроение происходит по 18-й хромосоме, а при синдроме Патау — по 13-й хромосоме.
А вот при синдроме Дауна (трисомия по 21-й хромосоме), который встречается довольно часто — один ребенок на 800 родов, выживаемость выше (в среднем такие люди живут до 36 лет). При своевременной регулярной психофизиологической коррекции и уходе детки вполне социализируются и могут найти свое место в обществе.
Неонатальный скрининг новорожденных
Данный вид скрининга является обязательным для всех новорожденных и необходим для выявления таких наследственных заболеваний, как фенилкетонурия, муковисцидоз, врожденный гипотиреоз, адреногенитальный синдром, галактоземия. Кровь для исследования берется у новорожденного на 4-7-й день после рождения. После выявления нарушений (маркеры заболевания) родители получают направление к узкопрофильному специалисту для дальнейшей консультации.
Фенилкетонурия. Причина — нарушение обмена аминокислот, в первую очередь фенилаланина. Вызывает поражение центральной нервной системы, что приводит к умственной отсталости ребенка. В основе лечения — пожизненная низкобелковая диета с исключением ряда продуктов, содержащих аминокислоту фенилаланин (мясо, рыба, яйца, сыр).
Муковисцидоз. Вызывает поражения органов дыхания, поджелудочной железы. Симптомы выявляются не сразу, а через некоторое время после рождения. Заболевание провоцирует хронические бронхиты, рецидивирующий панкреатит, дыхательную недостаточность и, как следствие, отставание в физическом развитии ребенка. Лечится симптоматически, важную роль также играет диета с достаточным количеством белка.
Врожденный гипотиреоз. Чаще регистрируется у девочек, проявляется сразу после рождения в виде полной или частичной дисфункции щитовидной железы. Это приводит к угнетению всех физиологических процессов в организме. Лечение начинается с момента рождения и продолжается всю жизнь (прием L-тироксина).
Галактоземия. Недостаточность ферментов, участвующих в метаболизме галактозы (простой сахар), приводит к патологиям ЖКТ, нервной системы детей раннего возраста. Предполагается, что такой ребенок пожизненно будет соблюдать довольно жесткую специальную диету.
Ранняя диагностика вышеперечисленных заболеваний позволяет выявить проблему в первые дни жизни малыша. Это позволяет своевременно начать необходимое лечение и программу профилактики, которые существенно улучшают качество жизни ребенка.
Как узнать результат неонатального скрининга
Определение сатурации, то есть степени насыщения крови кислородом, также на верхних и нижних конечностях. Для этого используется специальный прибор — детский пульсоксиметр.
Проанализировав полученные данные, врач дает оценку скрининга: он положительный (если что-то внушает подозрение) или отрицательный (когда все показатели в пределах нормы).
Также на третьи сутки малышу выполняется неонатальный аудиологический скрининг, цель которого — выявить потенциальное нарушение слуха. Именно к третьему дню жизнидетское ушко естественным путем освобождается от фрагментов первородной смазки или капелек околоплодных вод, поэтому скрининг становится более информативным.
Аудиоскрининг выполняется при помощи специального прибора (аудиометра), оснащенногодатчиком с высокочувствительным микрофоном. Сверху на него перед исследованием надевают мягкий наконечник (ушной вкладыш) и поочередно вставляют в правый и левый слуховой проход ребенка.
Результат приема детским ушком звукового импульса отображается сразу на мониторе. Если врачу что-то не понравится в нем, ребенок будет записан в группу риска по развитию тугоухости, но уже не в нашей больнице, а по месту жительства. Там, пока малыш не достигнет 3-месячного возраста, ему будут проведены дополнительные обследования, которые либо подтвердят диагноз тугоухости, либо снимут его.
Обращаю внимание, что в группу риска по тугоухости входят дети, перенесшие асфиксию в родах (не сразу закричавшие), родившиеся после переношенной беременности, имеющие дефицит веса или получавшие серьезную лекарственную терапию сразу после родов в связи с каким-то врожденным заболеванием. Такие дети, независимо от результата проведенного аудиологического скрининга в роддоме, также до 3-х месяцев будут обследованы повторно в поликлинике.
Неонатальный скрининг
Неонатальный скрининг, ласково именуемый в нашей стране «пяточка», является одним из первых важных исследований новорожденного. В России скрининг преимущественно направлен на выявление пяти наследственных болезней обмена: фенилкетонурии, врожденного гипотиреоза, врожденной дисфункции коры надпочечников (ВДКН), галактоземии и муковисцидоза. За рубежом этот список расширен до 50 различных заболеваний, в некоторых штатах Америки их свыше 60. Здоровый доношенный новорожденный допускается к скринингу на 4–5 сутки, недоношенный — на седьмой день после рождения. Заболевания, на выявление которых направлен скрининг, никак не проявляют себя в периоде новорожденности, но их ранняя диагностика и своевременно начатое патогенетическое лечение существенно влияют на прогноз и качество жизни ребенка. Помимо исследования крови проводится аудиометрия для оценки слуха и пульсоксиметрия для скрининга пороков сердца, но в данной статье мы преимущественно сосредоточимся на тестировании крови.
Разработка программы скрининга началась в шестидесятых годах прошлого века, когда Роберт Гатри создал технологию тестирования сухих отпечатков крови на фильтровальной бумаге. Первым заболеванием, которое стало кандидатом для массовой диагностики, была фенилкетонурия, так как ее раннее выявление и коррекция питания способны предотвратить развитие тяжелых неврологических нарушений. Затем к скринингу добавилось еще несколько заболеваний: врожденный гипотиреоз, ВДКН, галактоземия и муковисцидоз. Тандемная масс-спектрометрия (ТМС) позволила значительно расширить список заболеваний, добавив к болезням обмена веществ гемоглобинопатии, спинальную мышечную атрофию, тяжелый комбинированный иммунодефицит и др.
Таблица 1 | Рекомендуемая The American College of Obstetricians and Gynecologists (ACOG) скрининг-панель для врожденных заболеваний
В данной статье будут рассмотрены два скрининга, доступные в нашей стране: обязательный, включающий тестирование на пять заболеваний (врожденный гипотиреоз, ВДКН, фенилкетонурия, галактоземия, муковисцидоз) и расширенный скрининг на наследственные нарушения метаболизма.
Обязательный скрининг
На 4–5 сутки после рождения здорового доношенного ребенка или на седьмые сутки жизни недоношенного ребенка проводится тестирование методом «сухого пятна».
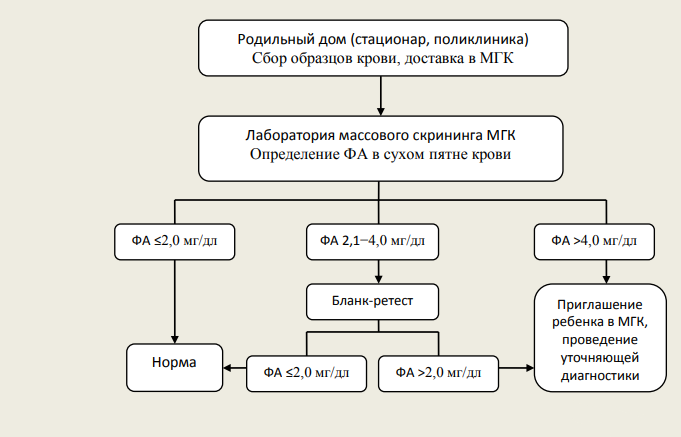
Фенилкетонурия (в современной классификации ― ФАГ-зависимая ФКУ) обусловлена мутацией гена фенилаланингидроксилазы и относится к числу аминокислотных аминоацидопатий. В норме фенилаланин (ФА) путем реакций гидроксилирования превращается в тирозин, однако в случае мутации вышеназванного гена активность превращающего фермента снижается, создается дефицит тирозина одновременно с избытком ФА, образующего токсичные метаболиты (фенилацетат, фенилпируват, фениллактат). Снижение образования тирозина влечет за собой нарушение синтеза гормонов щитовидной железы, нейротрансмиттеров и пигментов меланоцитов, а избыток ФА приводит к дисбалансу аминокислот в тканях мозга, обусловленному торможением их всасывания в желудочно-кишечном тракте или нарушением реабсорбции из почечных канальцев, нарушению образования или стабилизации полирибосом, снижению синтеза миелина, норадреналина и серотонина. Также за счет конкурентного ингибирования создается дефицит тирозиназы, что в совокупности с дефицитом тирозина приводит к снижению образования меланина и гипопигментации.
Основной проблемой пациентов с ФКУ являются нарушения функции ЦНС: от сонливости, вялости, отсутствия аппетита в период манифестации в 2–6 месяцев до тяжелых нарушений психомоторного развития в будущем; нередко развиваются атаксия, гиперкинезы, тремор рук, парезы по центральному типу. Единственный способ предотвратить развитие вышеназванных нарушений — назначение гипофенилаланиновой диеты с момента рождения с поддержанием низкого уровня фенилаланина в течение всей жизни.
Рисунок 1 | Интерпретация результатов исследования на наличие фенилкетонурии
ВДКН обусловлена дефицитом ферментов и транспортных белков, участвующих в биосинтезе кортизола. Наиболее часто встречается дефицит 21-гидроксилазы, что в свою очередь приводит к дефициту кортизола и альдостерона и ответному увеличению секреции АКТГ и гиперплазии коры надпочечников. В условиях дефицита фермента происходит значительное накопление предшественников гормонов, что приводит к увеличению синтеза тестостерона, не зависящего от 21-гидроксилазы. В итоге у пациента формируется надпочечниковая недостаточность и гиперандрогения. Гормональным маркером дефицита 21-гидроксилазы является уровень 17-гидроксипрогестерона (17-ОНП), определяемый в рамках неонатального скрининга. Результат трактуется как положительный, если при двукратном тестировании образца уровень 17-ОНП у доношенных новорожденных составляет ≥ 20 нг/мл. У недоношенных детей при заборе крови на 7–8 сутки после рождения скрининговый результат трактуется как положительный при следующих уровнях 17-ОНП: на сроке 23–32 недели гестации ― ≥ 65 нг/мл; на сроке 33–36 недель гестации ― ≥ 40 нг/мл.
Врожденный гипотиреоз в большинстве случаев вызван дефектами самой щитовидной железы (первичный гипотиреоз). Причины первичного врожденного гипотиреоза можно в широком смысле классифицировать как неспособность щитовидной железы нормально развиваться (дисгенезия) или неспособность структурно нормальной щитовидной железы производить нормальные количества гормона (дисгормоногенез). Дисгенезия щитовидной железы, охватывающая весь спектр агенеза, гипоплазии и эктопии, является наиболее частой причиной врожденного гипотиреоза. В то время как это заболевание остается наиболее частой причиной врожденного гипотиреоза, частота возникновения дисгормоногенеза за последние несколько десятилетий увеличилась. В то время как на дисгормоногенез приходится только 15 % врожденного гипотиреоза, диагностированного в первые дни скрининга новорожденных, у 30–40 % младенцев, прошедших скрининг по современным протоколам, имеется эктопическая щитовидная железа, соответствующая одной из форм дисгормоногенеза. В отличие от дисгенезии щитовидной железы, при которой моногенная причина присутствует только у небольшого количества пациентов, дисгормоногенез часто возникает из-за генетического дефекта на каком-либо этапе синтеза тиреоидных гормонов.
Учитывая разнообразие функций тиреоидных гормонов в организме человека, врожденный гипотиреоз характеризуется разнообразием клинических проявлений с поражением всех органов и систем. При отсутствии своевременного лечения на первый план выходит задержка психомоторного и речевого развития, затем наступают отставание в физическом развитии и задержка полового развития. Основной задачей скрининга является наиболее раннее выявление детей с подозрением на врожденный гипотиреоз.
Рисунок 2 | Интерпретация результатов исследования на наличие врожденного гипотиреоза
Галактоземия — аутосомно-рецессивное наследственное нарушение обмена углеводов, при котором в организме накапливается избыток галактозы и ее метаболитов. В норме галактоза образуется в результате гидролиза лактозы в кишечнике либо в процессе ферментных реакций, обмена гликопротеинов и гликолипидов. Галактоза является материалом для образования клеточных мембран, нервной ткани, нервных окончаний и т. д. В результате ферментных реакций она превращается в глюкозу, и именно дефицит галактозо-1-фосфатуридилтрансферазы лежит в основе патогенеза данного заболевания. Метаболиты галактозы обладают повреждающим действием. Так, галактитол проникает в хрусталик глаза, приводя к повышению осмотического давления, электролитным нарушениям и денатурации белка с формированием катаракты. Другие метаболиты обладают гепато-, нейро- и нефротоксическим действиями, а также вызывают гемолиз эритроцитов. Тормозящее влияние метаболитов галактозы на углеводный обмен приводит к гипогликемии.
Рисунок 3 | Интерпретация результатов исследования на наличие галактоземии
Муковисцидоз — аутосомно-рецессивное заболевание, связанное с мутацией гена МВТР (трансмембранного регулятора муковисцидоза). МВТР является хлорным каналом, мутации гена которого нарушают не только транспорт, но и секрецию ионов хлора. При затруднении их прохождения через клеточную мембрану увеличивается реабсорбция натрия железистыми клетками, нарушается электрический потенциал просвета, что вызывает изменение электролитного состава и дегидратацию секрета желез внешней секреции. В результате выделяемый секрет становится чрезмерно густым и вязким. Поражаются все экзокринные железы организма: печень, поджелудочная железа, мочеполовая система, но наиболее ярко муковисцидоз проявляет себя со стороны органов дыхания, провоцируя бронхообструкцию, дыхательную и сердечную недостаточность, легочную гипертензию.
Рисунок 4 | Интерпретация результатов исследования на наличие муковисцидоза
Расширенный скрининг
Органические ацидемии — группа аутосомно-рецессивных наследственных заболеваний обмена, в основе патогенеза которых лежит дефицит ферментов, участвующих в метаболизме белков, что приводит к повышению уровня кетоновых тел, обладающих токсическим действием на различные органы и ткани, в частности, на ЦНС. Данные заболевания манифестируют уже в стадии декомпенсации, как правило, в период с первой недели до первого года жизни. Триггерами служат стресс, длительное голодание, инфекционные заболевания, иммунизация, реже — чрезмерное употребление белковой пищи. Проявляются преимущественно неврологической симптоматикой: нарушение сознания вплоть до комы, эпилептические приступы, нарушение мышечного тонуса, у детей старшего возраста — нарушения психоречевого развития, атаксия, очаговые неврологические симптомы, синдром Рейе (острая печеночная недостаточность, сочетающаяся с энцефалопатией), психические расстройства.
Нарушения окисления жирных кислот — врожденный дефект метаболизма из-за нарушения либо митохондриального β-окисления, либо транспорта жирных кислот с использованием карнитинового транспортного пути. Проявления зависят от нарушения метаболизма конкретной кислоты, но все они имеют общие черты и требуют схожей тактики лечения. В периоде новорожденности метаболические нарушения проявляются тяжелой кардиомиопатией, гипокетотической гипогликемией, дисфункцией печени в первые несколько дней или недель жизни, часто заканчиваясь летально. В младенческом и детском возрасте характерны эпизоды летаргии и рвоты, развивается дисфункция печени и гипокетотическая гипогликемия, энцефалопатия, что может привести к внезапной младенческой смерти. У подростков и во взрослом возрасте дебютируют эпизодическим рабдомиолизом, мышечной слабостью, миалгией. Лечение включает отказ от голодания, симптоматическую терапию развившихся осложнений и включение в рацион добавок, если это необходимо.
Аминоацидопатии
Болезнь кленового сиропа (она же лейциноз) — наследственное заболевание, обусловленное дефицитом дегидрогеназы кетокислот с разветвленной цепью и нарушением метаболизма лейцина, изолейцина, валина (аминокислоты с разветвленной цепью, АКЦР). Повышение уровня АКЦР и их метаболитов, в частности, кетокислот, приводит к кетоацидозу, атрофии ткани головного мозга, нарушению окислительного фосфорилирования в дыхательной цепи митохондрий. Избыток лейцина обладает нейротоксическим эффектом, вызывая дисфункцию астроцитов, апоптоз нейронов и блокируя транспорт через гематоэнцефалический барьер аминокислот, важных для синтеза нейротрансмиттеров.
Гомоцистеинурия — наследственное заболевание из группы аминоацидопатий, обусловленное нарушением метаболизма серосодержащих аминокислот, в частности, метионина. Дефицит цистатион-b-синтазы нарушает преобразование метионина в цистеин. Высокий уровень гомоцистеина связан с образованием некротически-дегенеративных участков в почках, селезенке, слизистой оболочке желудка и сосудах, активацией XII фактора свертывания, способствующего тромбообразованию.
Тирозинемия 1 типа — заболевание, обусловленное дефицитом фумарилацетоацетатгидролазы, в результате чего происходит накопление высокотоксичных фумарил- и малеилацетоацетата, обладающих гепатотоксическим и канцерогенным действием. Конечные метаболиты — сукцинилацетон и сукцинилацетоацетат — являются митохондриальными токсинами, тормозящими фосфорилирование и блокирующими цикл Кребса. Накопление токсинов приводит к прогрессирующему заболеванию печени с развитием печеночной недостаточности, цирроза, тубулопатии с формированием ренальной тубулопатии, гипофосфатемического рахита, синдрома Фанкони. Острая тирозинемия сопровождается развитием гипертрофической кардиомиопатии. Кроме того, нарушается путь синтеза порфирина, ингибируется синтез порфобилиногена, что приводит к кризам, проявление которых напоминает порфирию. Все пациенты подвержены высокому риску развития гепатоцеллюлярной карциномы, вторичной по отношению к циррозу. Без своевременного лечения дети погибают в возрасте 10 лет.