как узнать скольки атомный газ
Одноатомный газ
При стандартных давлении и температуре все инертные газы являются одноатомными. К инертным газам относятся: гелий, неон, аргон, криптон, ксенон, радон и оганесон. Инертные газы с бо́льшими атомными массами могут создавать структурные образования, но более лёгкие являются нереактивными. При очень высоких температурах все химические элементы в газовом состоянии являются одноатомными.
Единственный вид движения молекул одноатомного газа — это поступательное движение (возбуждение электронов не является важным при комнатных температурах). Поэтому в адиабатном процессе одноатомные газы имеют идеализированный γ-фактор (Cp/Cv) равный 5/3, в то время как у идеальных двухатомных газов этот параметр равен 7/5. Молекулы двухатомного газа, помимо поступательного движения, могут ещё и вращаться (но вибрация при комнатных температурах для них недоступна).
Также про идеальные одноатомные газы можно сказать следующее:
молярная теплоёмкость при постоянном давлении (Cp) равна 5/2 R = 20.8 Дж *K−1* моль−1;
молярная теплоёмкость при постоянном объёме (Cv) составляет 3/2 R = 12.5 Дж* K−1* моль−1;где R — универсальная газовая постоянная.
Связанные понятия
К пе́рвому пери́оду периоди́ческой систе́мы относятся элементы верхней строки (или периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) химических свойств элементов при увеличении атомного числа: новая строка начинается тогда, когда увеличивается количество энергетических уровней, что означает попадание элементов с аналогичными свойствами в тот же вертикальный столбец. Первый период содержит меньше всего.
Водород считается одним из наиболее перспективных топлив как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств. Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около.
Запрос ПИД перенаправляется сюда. ПИД-регулятору посвящена соответствующая статьяПламенно-ионизационный детектор (ПИД) — детектор, используемый в газовой хроматографии, в основном, для обнаружения в газовых смесях органических соединений. Впервые создан в 1957 году в CSIRO, Мельбурн, Австралия.
Химические лазеры — разновидность газовых лазеров, в которых источником энергии служат химические реакции между компонентами рабочей среды. Химические лазеры непрерывного действия могут достигать высокого уровня мощности и используются в промышленности для резки и создания отверстий.
Одноатомный газ
Одноатомный газ — это такой газ, в котором атомы не образуют химических связей друг с другом.
При стандартных давлении и температуре все инертные газы являются одноатомными. К инертным газам относятся: гелий, неон, аргон, криптон, ксенон и радон. Инертные газы с бо́льшими атомными массами могут создавать структурные образования, но более лёгкие являются нереактивными. При очень высоких температурах все химические элементы в газовом состоянии являются одноатомными.
Единственный вид движения молекул одноатомного газа — это поступательное движение (возбуждение электронов не является важным при комнатных температурах). Поэтому в адиабатном процессе одноатомные газы имеют идеализированный γ-фактор (Cp/Cv) равный 5/3, в то время как у идеальных двухатомных газов этот параметр равен 7/5. Молекулы двухатомного газа, помимо поступательного движения, могут ещё и вращаться (но вибрация при комнатных температурах для них недоступна).
Также про идеальные одноатомные газы можно сказать следующее:
молярная теплоёмкость при постоянном давлении (Cp) равна 5/2 R = 20.8 Дж *K −1 * моль −1 ; молярная теплоёмкость при постоянном объёме (Cv) составляет 3/2 R = 12.5 Дж* K −1 * моль −1 ;
Смотреть что такое «Одноатомный газ» в других словарях:
одноатомный газ — vienatomės dujos statusas T sritis chemija apibrėžtis Dujos, kurių molekulėje yra tik vienas atomas. atitikmenys: angl. monoatomic gas rus. одноатомный газ … Chemijos terminų aiškinamasis žodynas
одноатомный газ — vienatomės dujos statusas T sritis fizika atitikmenys: angl. monatomic gas vok. einatomiges Gas, f rus. одноатомный газ, m pranc. gaz monoatomique, m … Fizikos terminų žodynas
Гелий — У этого термина существуют и другие значения, см. Гелий (значения). 2 Водород ← Гелий → Литий … Википедия
Аргон — 18 Хлор ← Аргон → Калий … Википедия
Радон — радиоактивный хим. элемент VIII гр. периодической системы, порядковый номер 86. Массовое число 222. Назв. элемента дано по наиболее долгоживущему изотопу Rn (Т = 3825 дням). В настоящее время известно 19 изотопов Р. с массовыми числами 204 и 206… … Геологическая энциклопедия
Криптон — У этого термина существуют и другие значения, см. Криптон (значения). 36 Бром ← Криптон → Рубидий … Википедия
СТАТИСТИЧЕСКАЯ ФИЗИКА — раздел физики, посвящённый изучению св в макроскопич. тел, т. е. систем, состоящих из очень большого числа одинаковых ч ц (молекул, атомов, эл нов и т. д.), исходя из св в этих ч ц и вз ствий между ними. Изучением макроскопич. тел занимаются и др … Физическая энциклопедия
Радон — У этого термина существуют и другие значения, см. Радон (значения). 86 Астат ← Радон → Франций … Википедия
Е939 — Гелий/Helium (He) Атомный номер 2 Внешний вид простого вещества инертный газ без цвета, вкуса и запаха Свойства атома Атомная масса (молярная масса) 4,002602 а. е. м. (г/моль) … Википедия
Эфир в физике — Содержание: 1) Э. до эпохи Декарта. 2) Э. картезианцев. 3) Э. Гюйгенса, Ньютона и позднейшего времени. 4) Свойства Э., как вида материи, согласно современным воззрениям. 5) Плотность Э. 6) Э. и тяготение. 7) Э. и молекулы обычных тел. 8) Инерция… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Как определить количество атомов в молекуле?
Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Периодическая система химических элементов: как это работает
Рассказываем, как устроена таблица Менделеева и как ею пользоваться.
Дмитрий Иванович Менделеев (1834–1907)
Выдающийся русский учёный, химик, физик и энергетик. Самым значимым его вкладом в науку стало открытие периодического закона, графическое выражение которого получило название Периодической системы химических элементов.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892020 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
Атомный объем, как он меняется в периодической таблице и примерах
атомный объем является относительным значением, которое указывает на соотношение между молярной массой элемента и его плотностью. Таким образом, этот объем зависит от плотности элемента, а плотность зависит, в свою очередь, от фазы и от расположения атомов в этом.
Таким образом, атомный объем для элемента Z не такой же, как в другой фазе, отличной от той, которая проявляется при комнатной температуре (жидкость, твердое вещество или газ), или когда он входит в состав определенных соединений. Таким образом, атомный объем Z в соединении ZA отличается от атомного объема Z в соединении ZB.
Почему? Чтобы понять это, необходимо сравнить атомы, например, с мрамором. Мрамор, как и голубоватый цвет превосходного изображения, очень хорошо определил свою материальную границу, что наблюдается благодаря его блестящей поверхности. Напротив, граница атомов диффузная, хотя их можно считать дистанционно сферическими.
Таким образом, то, что определяет точку за атомной границей, это нулевая вероятность нахождения электрона, и эта точка может быть дальше или ближе к ядру в зависимости от того, сколько соседних атомов взаимодействуют вокруг рассматриваемого атома..
Атомный объем и радиус
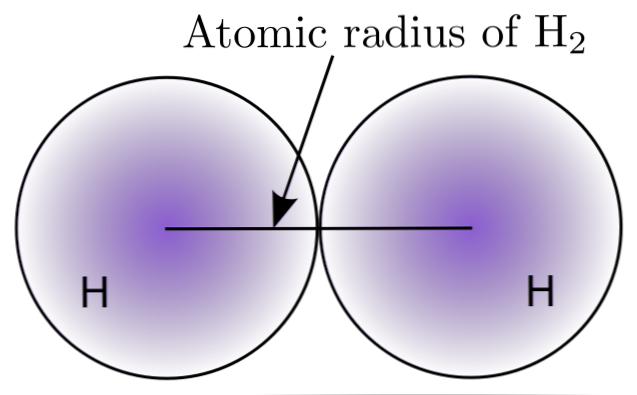
На верхнем изображении видно, как уменьшается вероятность обнаружения электрона при его удалении от ядра. Разделив межъядерное расстояние между двумя, получим атомный радиус. Далее, предполагая сферическую геометрию для атомов, мы используем формулу для расчета объема сферы:
В этом выражении r атомный радиус, определенный для молекулы H2. Значение V, рассчитанное этим неточным методом, может измениться, если, например, оно считалось H2 в жидком или металлическом состоянии. Однако этот метод очень неточный, потому что формы атомов находятся далеко от идеальной сферы в их взаимодействиях..
Чтобы определить атомные объемы в твердых телах, многие переменные, касающиеся расположения, приняты во внимание, и они получены с помощью рентгеноструктурных исследований..
Дополнительная формула
Молярная масса выражает количество вещества, которое имеет один моль атомов химического элемента.
(г / моль) (мл / г) = мл / моль
Или что то же самое:
(Молярная масса) (1 / D) = V
(Молярная масса / D) = V
Как атомный объем изменяется в периодической таблице?
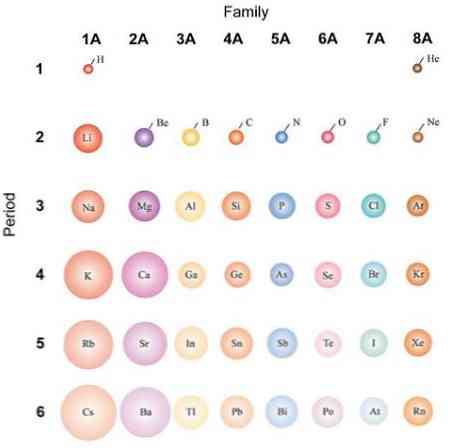
Если атомы считаются сферическими, то их изменение будет таким же, как наблюдается в атомных радиусах. На верхнем изображении, которое показывает репрезентативные элементы, показано, что справа налево атомы карликовые; вместо этого сверху вниз они становятся более объемными.
Это потому, что в тот же период ядро включает в себя протоны при движении вправо. Эти протоны оказывают силу притяжения на внешние электроны, которые ощущают эффективный заряд ядра Zэфф, меньше, чем фактический заряд ядра Z.
Электроны внутренних слоев отталкивают электроны внешнего слоя, уменьшая влияние ядра на них; Это известно как эффект экрана. В тот же период экранному эффекту не удается противодействовать увеличению количества протонов, поэтому электроны во внутреннем слое не препятствуют сжатию атомов.
Однако, спускаясь в группу, включаются новые энергетические уровни, которые позволяют электронам вращаться дальше от ядра. Кроме того, увеличивается число электронов во внутреннем слое, экранирующие эффекты которых начинают уменьшаться, если ядро снова добавляет протоны.
По этим причинам можно видеть, что группа 1А имеет самые объемные атомы, в отличие от маленьких атомов группы 8А (или 18), среди благородных газов..
Атомные объемы переходных металлов
Атомы переходных металлов включают электроны на внутренние орбитали d. Это увеличение эффекта экрана и, как и реального заряда ядра Z, почти одинаково аннулируется, так что их атомы сохраняют свой одинаковый размер в тот же период.
Другими словами: в один период переходные металлы имеют одинаковые атомные объемы. Тем не менее, эти небольшие различия чрезвычайно важны при определении металлических кристаллов (как если бы они были металлическими шариками).
примеров
Для расчета атомного объема элемента доступны две математические формулы, каждая из которых имеет соответствующие примеры..
Пример 1
Используя формулу сферического объема, мы тогда имеем:
ВH= (4/3) (3,14) (37 часов вечера) 3 = 212,07 вечера 3
ВCs= (4/3) (3,14) (265 вечера) 3 = 77912297,67 вечера 3
Однако эти объемы, выраженные в пирометрах, непомерны, поэтому они преобразуются в единицы ангстремов, умножая их на коэффициент пересчета (1Å / 100pm) 3 :
(77912297,67 вечера 3 ) (1Å / 100 вечера) 3 = 77 912 Å 3
Таким образом, различия в размере между небольшим атомом H и громоздким атомом Cs остаются численно очевидными. Следует иметь в виду, что эти расчеты являются лишь приближениями к утверждению, что атом является полностью сферическим, который блуждает перед лицом реальности..
Пример 2
Плотность чистого золота составляет 19,32 г / мл, а его молярная масса составляет 196,97 г / моль. Применение формулы M / D для расчета объема одного моля атомов золота имеет следующий вид:
ВAu= (196,97 г / моль) / (19,32 г / мл) = 10,19 мл / моль
ВAu= (4/3) (3,14) (166 вечера) 3 = 19,15 · 10 6 вечера 3
Какой из двух наиболее близок к принятому значению? Тот, который наиболее близок к экспериментальным результатам, полученным методом рентгеновской дифракции кристаллической структуры золота.


.jpg)

.jpg)

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)