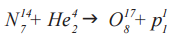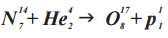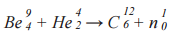как узнать сколько протонов и нейтронов в ядре
Химические элементы
Химический элемент
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.
Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Число нуклонов (протонов и нейтронов) в атоме
Как определить число нуклонов в ядре атома?
Число нуклонов в ядре атома равно массовому числу атома (относительная атомная масса химического элемента) или сумме протонов и нейтронов.
Как определить число протонов в атоме?
Число протонов в атоме равно заряду его ядра (обозначается как Z) или порядковому номеру элемента в периодической таблице Менделеева.
Как определить число нейтронов в атоме?
Где N — число нейтронов, A — атомная масса элемента (в целых числах), Z — заряд ядра атома или порядковый номер атома в периодической таблице Менделеева.
Развернутый ответ
Масса атома складывается из двух величин: масса протонов + масса нейтронов. Дело в том, что масса электронов пренебрежимо мала.
Масса нейтрона = 1,674 927 498 04(95)⋅10⁻²⁷ кг= 1,008 664 915 60(57) а.е.м.
Масса протона = 1,672 621 923 69(51)⋅10⁻²⁷ кг = 1,007276466621(53) а.е.м.
Масса электрона = 9,109383 7015(28)⋅10⁻³¹ кг = 0,000548579909065 а.е.м.
То есть даже 100 электронов дадут в сумме всего 0,0548579909065 а.е.м.
Первоначально Д. И. Менделеев в построении своей периодической таблицы исходил из атомных весов элементов. Однако, дальнейшее развитие науки показало, что свойства химических элементов находятся в прямой зависимости не от атомной массы химического элемента, а от заряда ядра его атома. Таким образом, в периодической таблице химические элементы выстроены в порядке возрастания заряда ядра атома и номер элемента в таблице соответствует заряду его ядра. А заряд ядра равен сумме протонов. То есть № (элемента) = Z (заряд ядра или число протонов).
Остаток массы ядра приходится на нейтроны. Поэтому чтобы определить число нейтронов в атоме нужно всего лишь вычесть из атомной массы число протонов, которое равно заряду ядра или порядковому номеру элемента в таблице Менделеева.
Примеры
Сколько протонов и нейтронов в атоме натрия?
Ar (Na) = 23 а.е.м.
Z (Na) = 11 (протонов)
N = Ar (Na) — Z (Na) = 23 — 11 = 12 (нейтронов)
Ответ: число протонов в атоме натрия равно 11, а число нейтронов в атоме натрия равно 12.
Сколько протонов и нейтронов в атоме фосфора?
Ar (P) = 31 а.е.м.
Z (P) = 15 (протонов)
N = Ar (P) — Z (P) = 31 — 15 = 16 (нейтронов)
Ответ: число протонов в атоме фосфора равно 15, а число нейтронов в атоме фосфора равно 16.
Сколько протонов и нейтронов в атоме золота?
Ar (Au) = 197 а.е.м.
Z (Au) = 79 (протонов)
N = Ar (Au) — Z (Au) = 197 — 79 = 118 (нейтронов)
Ответ: число протонов в атоме золота равно 79, а число нейтронов в атоме золота равно 118.
Сколько протонов и нейтронов в атоме кремния?
Ar (Si) = 28 а.е.м.
Z (Si) = 14 (протонов)
N = Ar (Si) — Z (Si) = 28 — 14 = 14 (нейтронов)
Ответ: число протонов и нейтронов в атоме кремния равно 14.
Сколько протонов и нейтронов в атоме углерода?
Ar (C) = 12 а.е.м.
Z (C) = 6 (протонов)
N = Ar (C) — Z (C) = 12 — 6 = 6 (нейтронов)
Ответ: число протонов и нейтронов в атоме углерода равно 6.
Сколько протонов и нейтронов в атоме калия?
Ar (K) = 39 а.е.м.
Z (K) = 19 (протонов)
N = Ar (K) — Z (K) = 39 — 19 = 20 (нейтронов)
Ответ: число протонов в атоме калия равно 19, а число нейтронов в атоме калия равно 20.
Сколько протонов и нейтронов в атоме железа?
Ar (Fe) = 39 а.е.м.
Z (Fe) = 19 (протонов)
N = Ar (Fe) — Z (Fe) = 56 — 26 = 30 (нейтронов)
Ответ: число протонов в атоме железа равно 19, а число нейтронов в атоме железа равно 30.
Сколько протонов и нейтронов в атоме алюминия?
Сколько протонов и нейтронов в атоме фтора?
Ar (F) = 19 а.е.м.
Z (F) = 9 (протонов)
N = Ar (F) — Z (F) = 19 — 9 = 10 (нейтронов)
Ответ: число протонов в атоме фтора равно 9, а число нейтронов в атоме фтора равно 10.
Сколько протонов и нейтронов в атоме хлора?
Ar (Cl) = 35 а.е.м.
Z (Cl) = 17 (протонов)
N = Ar (Cl) — Z (Cl) = 35 — 17 = 18 (нейтронов)
Ответ: число протонов в атоме хлора равно 17, а число нейтронов равно 18.
Сколько протонов и нейтронов в атоме кислорода?
Ar (O) = 16 а.е.м.
Z (O) = 8 (протонов)
N = Ar (O) — Z (O) = 16 — 8 = 8 (нейтронов)
Ответ: число протонов и нейтронов в атоме кислорода равно 8.
Сколько протонов и нейтронов в атоме серы?
Ar (S) = 32 а.е.м.
Z (S) = 16 (протонов)
N = Ar (S) — Z (S) = 32 — 16 = 16 (нейтронов)
Ответ: число протонов и нейтронов в атоме серы равно 16.
Сколько протонов и нейтронов в атоме магния?
Ar (Mg) = 32 а.е.м.
Z (Mg) = 16 (протонов)
N = Ar (Mg) — Z (Mg) = 24 — 12 = 12 (нейтронов)
Ответ: число протонов в атоме магния равно 16, а число нейтронов равно 12.
Сколько протонов и нейтронов в атоме цинка?
Ar (Zn) = 65 а.е.м.
Z (Zn) = 30 (протонов)
N = Ar (Zn) — Z (Zn) = 65 — 30 = 35 (нейтронов)
Ответ: число протонов в атоме цинка равно 30, а число нейтронов в атоме цинка равно 35.
Ядра атомов: в самом сердце материи

Рис. 1
Ядро атома получается крохотным, его радиус в 10 000–100 000 раз меньше всего атома. Каждое ядро содержит определённое количество протонов (обозначим его Z) и определённое количество нейтронов (обозначим его N), скреплённых вместе в виде шарика, по размеру не сильно превышающего сумму их размеров. Отметим, что протоны и нейтроны вместе часто называют «нуклонами», а Z+N часто называют A – общее количество нуклонов в ядре. Также Z, «атомное число» – количество электронов в атоме.
Типичное мультяшное изображение атома (рис. 1) чрезвычайно преувеличивает размер ядра, но более-менее правильно представляет ядро как небрежно соединённое скопление протонов и нейтронов.
Содержимое ядра
Откуда нам известно, что находится в ядре? Эти крохотные объекты просто охарактеризовать (и это было просто исторически) благодаря трём фактам природы.
1. Протон и нейтрон отличаются по массе всего лишь на тысячную часть, так что если нам не нужна чрезвычайная точность, можно сказать, что у всех нуклонов масса одинакова, и назвать её массой нуклона, mнуклон:
(≈ означает «примерно равно»)
2. Количество энергии, необходимой для удержания вместе протонов и нейтронов в ядре, относительно мало – порядка тысячной доли части энергии массы (E = mc 2 ) протонов и нейтронов, так что масса ядра почти равна сумме масс его нуклонов:
3. Масса электрона равняется 1/1835 массы протона – так что почти вся масса атома содержится в его ядре:
Тут подразумевается наличие четвёртого важного факта: все атомы определённого изотопа определённого элемента одинаковы, как и все их электроны, протоны и нейтроны.
Поскольку в самом распространённом изотопе водорода содержится один электрон и один протон:
масса атома Mатом определённого изотопа просто равна Z+N, помноженному на массу атома водорода
и погрешность этих уравнений примерно равна 0,1%.
Поскольку нейтроны электрически нейтральны, электрический заряд Qядро ядра просто равен количеству протонов, помноженному на электрический заряд протона («e»):
В отличие от предыдущих уравнений, это уравнение выполняется точно.
Эти уравнения проиллюстрированы на рис. 2

Рис. 2
Используя открытия последних десятилетий XIX века и первых десятилетий XX, физики знали, как измерить в эксперименте оба обозначенных красным значения: заряд ядра в e, и массу любого атома в атомах водорода. Так что эти значения были известны уже в 1910-х. Однако правильно интерпретировать их смогли только в 1932 году, когда Джеймс Чедвик определил, что нейтрон (идею которого предложил Эрнест Резерфорд в 1920-м) является отдельной частицей. Но как только стало понятно, что нейтроны существуют, и что их масса практически равна массе протона, сразу же стало ясно, как интерпретировать числа Z и N — количество протонов и нейтронов. А также сразу родилась новая загадка – почему у протонов и нейтронов почти одинаковая масса.
Честно говоря, физикам того времени с научной точки зрения страшно повезло, что всё это было так легко установить. Закономерности масс и зарядов настолько просты, что даже самые долгие загадки были раскрыты сразу после открытия нейтрона. Если бы хотя бы один из перечисленных мною фактов природы оказался неверным, тогда на то, чтобы понять, что происходит внутри атомов и их ядер, ушло бы гораздо больше времени.

Рис. 3
Откуда нам известно, что ядро атома маленькое?
Одно дело – убедить себя, что определённое ядро определённого изотопа содержит Z протонов и N нейтронов; другое – убедить себя, что ядра атомов крохотные, и что протоны с нейтронами, будучи сжатыми вместе, не размазываются в кашу и не разбалтываются в месиво, а сохраняют свою структуру, как подсказывает нам мультяшное изображение. Как это можно подтвердить?
Я уже упоминал, что атомы практически пусты. Это легко проверить. Представьте себе алюминиевую фольгу; сквозь неё ничего не видно. Поскольку она непрозрачная, вы можете решить, что атомы алюминия:
1. Настолько крупные, что между ними нет просветов,
2. Настолько плотные и твёрдые, что свет сквозь них не проходит.
Насчёт первого пункта вы будете правы; в твёрдом веществе между двумя атомами почти нет свободного пространства. Это можно наблюдать на изображениях атомов, полученных при помощи особых микроскопов; атомы похожи на маленькие сферы (краями которых служат края электронных облаков), и они довольно плотно упакованы. Но со вторым пунктом вы ошибётесь.

Рис. 4
Если бы атомы были непроницаемыми, тогда сквозь алюминиевую фольгу ничто не смогло бы пройти – ни фотоны видимого света, ни рентгеновские фотоны, ни электроны, ни протоны, ни атомные ядра. Всё, что вы направили бы в сторону фольги, либо застревало бы в ней, либо отскакивало бы – точно так же, как любой кинутый объект должен отскочить или застрять в гипсокартонной стенке (рис. 3). Но на самом деле электроны высокой энергии легко могут пройти через кусочек алюминиевой фольги, как и рентгеновские фотоны, высокоэнергетические протоны, высокоэнергетические нейтроны, высокоэнергетические ядра, и так далее. Электроны и другие частицы – почти все, если точнее – могут пройти через материал, не потеряв ни энергии, ни импульса в столкновениях с чем-либо, содержащимся внутри атомов. Лишь малая часть их ударится об атомное ядро или электрон, и в этом случае они могут потерять большую часть своей начальной энергии движения. Но большая часть электронов, протонов, нейтронов, рентгеновских лучей и всякого такого просто спокойно пройдут насквозь (рис. 4). Это не похоже на швыряние гальки в стену; это похоже на швыряние гальки в сетчатый забор (рис. 5).

Рис. 5
Чем толще фольга – к примеру, если складывать всё больше и больше листов фольги вместе – тем вероятнее частицы, запущенные в неё, столкнуться с чем-либо, потеряют энергию, отскочат, изменят направление движения или даже остановятся. То же было бы верно, если бы вы наслаивали одну за другой проволочные сетки (рис. 6). И, как вы понимаете, из того, насколько далеко средняя галька может проникнуть сквозь слои сетки и насколько велики разрывы в сетке, учёные могут подсчитать на основании пройденной электронами или атомными ядрами дистанции, насколько атом пустой.

Рис. 6
Посредством таких экспериментов физики начала XX века установили, что внутри атома ничто – ни атомное ядро, ни электроны – не может быть большим, чем одна тысячная миллионных миллионных долей метра, то есть в 100 000 раз меньше самого атома. То, что такого размера достигает ядро, а электроны по меньшей мере в 1000 раз меньше, мы устанавливаем в других экспериментах – например, в рассеянии высокоэнергетических электронов друг с друга, или с позитронов.
Чтобы быть ещё более точным, следует упомянуть, что некоторые частицы потеряют часть энергии в процессе ионизации, в котором электрические силы, действующие между летящей частицей и электроном, могут вырвать электрон из атома. Это дальнодействующий эффект, и столкновением на самом деле не является. Итоговая потеря энергии значительна для летящих электронов, но не для летящего ядра.
Вы можете задуматься над тем, похоже ли то, как частицы проходят сквозь фольгу, на то, как пуля проходить сквозь бумагу – расталкивая части бумаги в стороны. Возможно, первые несколько частиц просто расталкивают атомы в стороны, оставляя большие отверстия, через которые проходят последующие? Мы знаем, что это не так, поскольку мы можем провести эксперимент, в котором частицы проходят внутрь и наружу контейнера, сделанного из металла или стекла, внутри которого вакуум. Если бы частица, проходя через стенки контейнера, создавала отверстия по размеру превышающие атомы, тогда внутрь устремились бы молекулы воздуха, и вакуум бы исчез. Но в таких экспериментах вакуум остаётся!
Также довольно легко определить, что ядро – это не особенно структурированная кучка, внутри которой нуклоны сохраняют свою структуру. Об этом уже можно догадаться по тому факту, что масса ядра очень близка к сумме масс содержащихся в нём протонов и нейтронов. Это выполняется и для атомов, и для молекул – их массы почти равны сумме масс их содержимого, кроме небольшой коррекции на связывающую энергию – и это отражено в том факте, что молекулы довольно легко разбить на атомы (к примеру, нагрев их так, чтобы они сильнее сталкивались друг с другом), и выбить электроны из атомов (опять-таки, при помощи нагрева). Сходным образом относительно легко разбить ядра на части, и этот процесс будет называться расщеплением, или собрать ядро из более мелких ядер и нуклонов, и этот процесс будет называться синтезом. К примеру, относительно медленно двигающиеся протоны или небольшие ядра, сталкивающиеся с более крупным ядром, могут разбить его на части; нет необходимости, чтобы сталкивающиеся частицы двигались со скоростью света.

Рис. 7
Но чтобы понять, что это не является неизбежным, упомяну, что этими свойствами не обладают сами протоны и нейтроны. Масса протона не равняется примерной сумме масс содержащихся в нём объектов; протон нельзя разбить на части; а для того, чтобы протон продемонстрировал что-нибудь интересное, необходимы энергии, сравнимые с энергией массы самого протона. Молекулы, атомы и ядра относительно просты; протоны и нейтроны чрезвычайно сложны.
Как определить количество элементарных частиц в атоме?
Под элементарными частицами в данном контексте нужно понимать нейтроны, протоны и электроны. Т.е. количество элементарных частиц в атоме равно сумме нейтронов, протонов и электронов этого атома.
Таким образом, вопрос можно разделить на два других:
Но в данном случае нам даже не нужно вычислять число нейтронов и протонов в ядре атома — эта информация у нас уже есть! Массовое число (относительная атомная масса) химического элемента есть сумма числа протонов и нейтронов в ядре атома.
Также напомню, что в нейтральном атоме число электронов равно числу протонов, которое, в свою очередь, равно порядковому номеру химического элемента в таблице Менделеева.
Таким образом можно составить простейшую формулу для вычисления числа элементарных частиц в атоме:
Где A — массовое число атома химического элемента, а Z — заряд ядра атома (порядковый номер элемента).
Если же вам нужно знать число отдельных элементарных частиц, то:
Примеры
Определить количество элементарных частиц в атоме 7 Li.
Порядковый номер элемента 3 поэтому в атоме содержится 3 электрона.
N (частиц) = 7 (массовое число) + 3 (порядковый номер) = 10
Определить количество элементарных частиц в атоме 59 Ni.
Порядковый номер элемента 28 поэтому в атоме содержится 28 электронов.
N (частиц) = 59 (массовое число) + 28 (порядковый номер) = 87
Определить количество элементарных частиц в атоме 96 Mo.
Порядковый номер элемента 42 поэтому в атоме содержится 42 электрона.
N (частиц) = 96 (массовое число) + 42 (порядковый номер) = 138
Определить количество элементарных частиц в атоме 207 Pb.
Порядковый номер элемента 82 поэтому в атоме содержится 82 электрона.
N (частиц) = 207 (массовое число) + 82 (порядковый номер) = 289
Состав ядра атома. Расчет протонов и нейтронов
Согласно современным представлениям, атом состоит из ядра и расположенных вокруг него электронов. Ядро атома, в свою очередь, состоит из более малых элементарных частиц ‒ из определенного количества протонов и нейтронов (общепринятое название для которых – нуклоны), связанных между собой ядерными силами.
Количество протонов в ядре определяет строение электронной оболочки атома. А электронная оболочка определяет физико-химические свойства вещества. Число протонов соответствует порядковому номеру атома в периодической системе химических элементов Менделеева, именуется также зарядовое число, атомный номер, атомное число. Например, число протонов у атома Гелия – 2. В периодической таблице он стоит под номером 2 и обозначается как He2 Символом для обозначения количества протонов служит латинская буква Z. При записи формул зачастую цифра, указывающая на количество протонов, располагается снизу от символа элемента либо справа, либо слева: He2 / 2He.
ПРОЦЕСС РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРЕ АТОМА. В качестве примера мы не случайно рассмотрели Гелий-4 (He 4 2), ядро которого состоит из двух протонов и двух нейтронов. Поскольку ядро Гелия-4, именуемое альфа-частицей (α-частица) обладает наибольшей эффективностью в ядерных реакциях, его часто используют для экспериментов в этом направлении. Стоит отметить, что в формулах ядерных реакций зачастую вместо He 4 2 используется символ α.
Именно с участием альфа-частиц была проведена Э. Резерфордом первая в официальной истории физики реакция ядерного превращения. В ходе реакции α-частицами (He 4 2) «бомбардировались» ядра изотопа азота (N 14 7), вследствие чего образовался изотоп оксигена (O 17 8) и один протон (p 1 1)
Осуществим расчёт количества фантомных частичек По до и после данного преобразования.
ДЛЯ РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО НЕОБХОДИМО:
Шаг 1. Посчитать количество нейтронов и протонов в каждом ядре:
— количество протонов указано в нижнем показателе;
— количество нейтронов узнаем, отняв от общего массового числа (верхний показатель) количество протонов (нижний показатель).
Шаг 2. Посчитать количество фантомных частичек По в атомном ядре:
— умножить количество протонов на количество фантомных частичек По, содержащихся в 1 протоне;
— умножить количество нейтронов на количество фантомных частичек По, содержащихся в 1 нейтроне;
Шаг 3. Сложить количество фантомных частичек По:
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах до реакции;
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах после реакции;
— сравнить количество фантомных частичек По до реакции с количеством фантомных частичек По после реакции.
ПРИМЕР РАЗВЁРНУТОГО ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРАХ АТОМОВ.
(Ядерная реакция с участием α-частицы (He 4 2), провёденная Э. Резерфордом в 1919 году)
ДО РЕАКЦИИ (N 14 7 + He 4 2)
N 14 7
Количество протонов: 7
Количество нейтронов: 14-7 = 7
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 7 протонах: (12 х 7) = 84;
в 1 нейтроне – 33 По, значит в 7 нейтронах: (33 х 7) = 231;
Общее количество фантомных частичек По в ядре: 84+231 = 315
He 4 2
Количество протонов – 2
Количество нейтронов 4-2 = 2
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 2 протонах: (12 х 2) = 24
в 1 нейтроне – 33 По, значит в 2 нейтронах: (33 х 2) = 66
Общее количество фантомных частичек По в ядре: 24+66 = 90
Итого, количество фантомных частичек По до реакции
N 14 7 + He 4 2
315 + 90 = 405
ПОСЛЕ РЕАКЦИИ (O 17 8) и один протон (p 1 1):
O 17 8
Количество протонов: 8
Количество нейтронов: 17-8 = 9
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 8 протонах: (12 х 8) = 96
в 1 нейтроне – 33 По, значит в 9 нейтронах: (9 х 33) = 297
Общее количество фантомных частичек По в ядре: 96+297 = 393
p 1 1
Количество протонов: 1
Количество нейтронов: 1-1=0
Количество фантомных частичек По:
В 1 протоне – 12 По
Нейтроны отсутствуют.
Общее количество фантомных частичек По в ядре: 12
Итого, количество фантомных частичек По после реакции
(O 17 8 + p 1 1):
393 + 12 = 405
Сравним количество фантомных частичек По до и после реакции:
| До реакции | После реакции |
| 405 | 405 |
Количества фантомных частичек По до и после реакции равны.
ПРИМЕР СОКРАЩЁННОЙ ФОРМЫ ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДЕРНОЙ РЕАКЦИИ.
Здесь и далее расчёты количества фантомных частичек По приведены в сокращённой форме, в которой отображено общее количество фантомных частичек По в каждом ядре, а также их сумма до и после реакции.
Известной ядерной реакцией является реакция взаимодействия α-частиц с изотопом бериллия, прикоторой впервые был обнаружен нейтрон, проявивший себя как самостоятельная частица в результате ядерного преобразования. Данная реакция была осуществлена в 1932 году английским физиком Джеймсом Чедвиком. Формула реакции:
Количества фантомных частичек По до и после реакции равны.