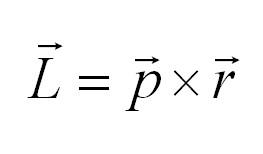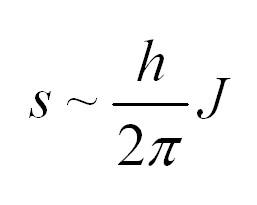как узнать спиновое квантовое число
Как узнать спиновое квантовое число
Орбитальное квантовое число `l` показывает, сколько энергетических подуровней составляют данный уровень и характеризует форму орбиталей. Принимает значения от `0` до `(n-1)`.
При `n=3`, `l` принимает уже три значения: `0` `(s)`; `1` `(p)` и `2` `(d)`. Таким образом, на третьем уровне три подуровня. Орбитали `d`-подуровня имеют форму двух перекрещённых объёмных восьмёрок либо объёмной восьмерки с перемычкой (рис. 1).
При `n=4`, значений `l` уже четыре, следовательно, и подуровней на четвёртом уровне четыре. К перечисленным выше добавляется `3` `(f)`. Орбитали `f`-подуровня имеют более сложную, объёмную, форму.
Магнитное квантовое число `ml` определяет число орбиталей на каждом подуровне и характеризует их взаимное расположение.
Принимает значения `-l` до `+l`, включая `0`.
При `l=1`, `m_l` принимает три значения: `−1`; `0`; `+1`. Значит, орбиталей на данном подуровне (`p`-подуровне) три. Так как `p`-орбитали представляют из себя объёмные восьмёрки (то есть линейной структуры), располагаются они в пространстве по осям координат, перпендикулярно друг другу (`p_x`, `p_y`, `p_z`).
При `l=2`, `m_l` принимает уже пять значений: `−2`; `−1`; `0`; `+1`; `+2`. То есть на `d`-подуровне располагаются пять орбиталей. Это плоскостные структуры, в пространстве занимают пять положений.
Спиновое квантовое число `m_s` характеризует собственный момент количества движения электрона и принимает только два значения: `+1//2` и `-1//2`.
Всё вышесказанное можно обобщить в Таблице 2.
Таблица 2. Квантовые числа, атомные орбитали и число электронов на подуровнях (для `n
Что такое спин в физике: момент импульса, бозоны, фермионы
Итак, полностью абстрагируемся и забываем любые классические определения. Ибо спин – это понятие, присущее исключительно квантовому миру. Попробуем разобраться в том, что это такое.
Больше полезной информации для учащихся – у нас в телеграм.
Спин и момент импульса
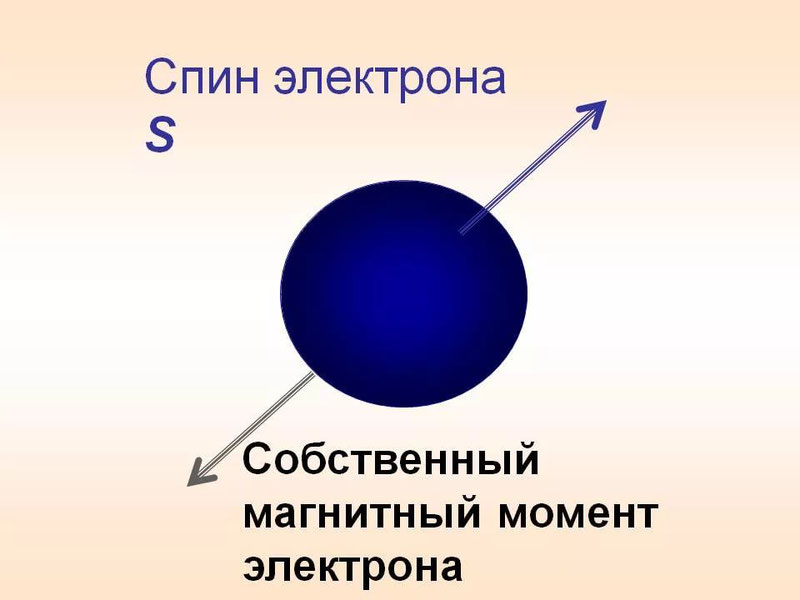
Спин (от английского spin – вращаться) – собственный момент импульса элементарной частицы.
Теперь вспомним, что такое момент импульса в классической механике.
Момент импульса – это физическая величина, характеризующая вращательное движение, точнее, количество вращательного движения.
В классической механике момент импульса определяется как векторное произведение импульса частицы на ее радиус вектор:
По аналогии с классической механикой спин характеризует вращение частиц. Их представляют в виде волчков, вращающихся вокруг оси. Если частица имеет заряд, то, вращаясь, она создает магнитный момент и явлеятся своего рода магнитом.
Однако данное вращение нельзя трактовать классически. Все частицы помимо спина обладают внешним или орбитальным моментом импульса, характеризующим вращение частицы относительно какой-то точки. Например, когда частица движется по круговой траектории (электрон вокруг ядра).
Спин же является собственным моментом импульса, то есть характеризует внутреннее вращательное состояние частицы вне зависимости от внешнего орбитального момента импульса. При этом спин не зависит от внешних перемещений частицы.
Представить, что же там вращается внутри частицы, невозможно. Однако факт остается фактом – для заряженных частиц с разнонаправленными спинами траектории движения в магнитном поле будут различны.
Спиновое квантовое число
Для характеристики спина в квантовой физике введено спиновое квантовое число.
Спиновое квантовое число – одно из квантовых чисел, присущих частицам. Часто спиновое квантовое число называют просто спином. Однако следует понимать, что спин частицы (в понимании собственного момента импульса) и спиновое квантовое число – это не одно и то же. Спиновое число обозначается буквой J и принимает ряд дискретных значений, а само значение спина пропорционально приведенной постоянной Планка:
Бозоны и фермионы
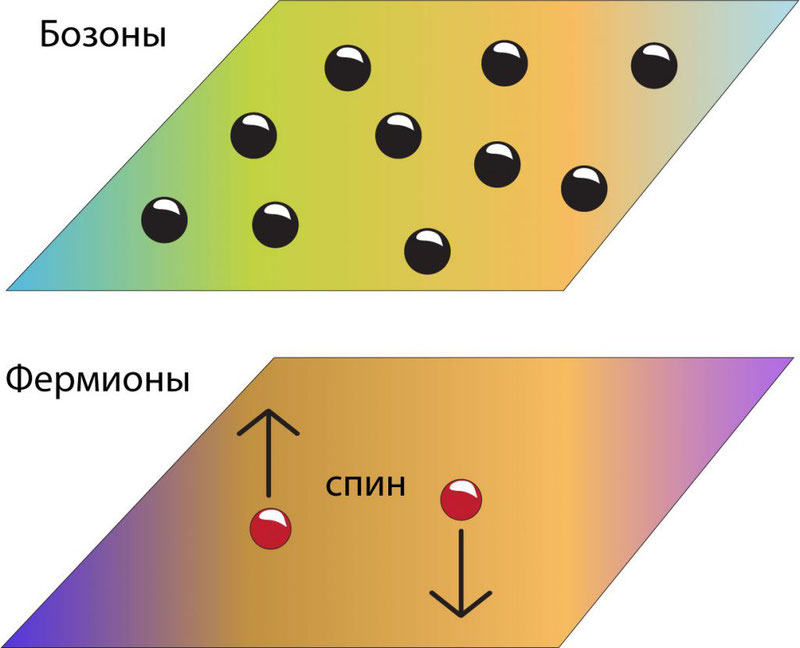
Разным частицам присущи разные спиновые числа. Так, главное отличие состоит в том, что одни обладают целым спином, а другие – полуцелым. Частицы обладающие целым спином называются бозонами, а полуцелым – фермионами.
Бозоны подчиняются статистике Бозе-Эйнштейна, а фермионы – Ферми-Дирака. В ансамбле частиц, состоящем из бозонов, любое их количество может находиться в одинаковом состоянии. С фермионами все наоборот – наличие двух тождественных фермионов в одной системе частиц невозможно.
Фермионы: электрон, лептон, кварк
Попробуем представить, чем отличаются частицы с разными спиновыми числами на примерах из макромира. Если спин объекта равен нулю, то его можно представить в виде точки. Со всех сторон, как ни вращай этот объект, он будет одинаков. При спине равном 1 поворот объекта на 360 градусов возвращает его в состояние, идентичное первоначальному состоянию.
Надеемся, что вы осилите эту теорию быстро и сможете при случае применить знания на практике. Ну а если задачка по квантовой механике оказалось непосильно сложной или не можете не забывайте о студенческом сервисе, специалисты которого готовы прийти на выручку. Учитывая, что сам Ричард Фейнман сказал, что «в полной мере квантовую физику не понимает никто», обратиться за помощью к опытным специалистам – вполне естественно!
Квантовые числа n, ℓ, m не полностью характеризуют движение электронов в атомах. Исследования показали, что электрон имеет свойство, называемое спин. Упрощенно спин можно представить как способ движения (спин) электрона вокруг своей оси (собственный момент количества движения электрона в атоме). Поэтому в теорию строения атома введено еще спиновое квантовое число s, которое может иметь только два значения, численно обозначаемые 
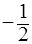
Четыре квантовых числа n, ℓ, m, и s полностью характеризуют движение электрона в атоме. Никаких других независимых от квантовых чисел характеристик у этого движения не может быть.
Поскольку энергия электрона в атоме водорода определяется величиной – n и не зависит от остальных квантовых чисел, то может быть несколько состояний электронов с одинаковой энергией. Эти состояния являются вырожденными (р – трижды вырожденные, d – пять раз вырожденные, , f – семьраз вырожденные). Вырождение исчезает при воздействии на электронв атоме внешнего электрического или магнитного поля. Электрон с одним и тем же значением n, но разными m и s по разному взаимодействуют с внешним полем, в результате энергии электрона в этих состояниях становятся неодинаковыми. Этим объясняется расщепление спектральных линий при помещении источника излучения в электрическое или магнитное поле
2.2.4. Многоэлектронные атомы.
Формирование электронной оболочки многоэлектронных атомов происходит в соответствии со следующими правилами (принципами):
4. принцип минимальной энергии
Электрон в атоме занимает такое положение, чтобы его энергия была минимальна.
В многоэлектронных атомах состояние каждого электрона определяется также значениями четырех квантовых чисел n, ℓ, m, и s, которые принимают те же значения, что и для атома водорода. Но, в многоэлектронных атомах электрон движется не только в поле ядра, но и в поле других электронов. Поэтому энергия электронов в таких атомах определяется значениями двух квантовых чисел n и ℓ. При этом энергия возрастает как с увеличением n, так и ℓ. Зависимость энергии от орбитального квантового числа становится тем большей, чем больше электронов в атоме.
2. принцип (запрет) Паули (открыт в 1925 г)
Согласно этому принципу в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
Хотя бы одно n, ℓ, m, s должно отличаться, т.е. 1) в каждом энергетическом состоянии может находиться только один электрон; 2) каждая новая комбинация квантовых чисел определяет новое состояние.
Исходя из значений, которые могут принимать квантовые числа и на основании принципа Паули нетрудно определить максимальное число электронов в атоме, обладающих данным значением главного квантового числа:
Правило Гунда
В соответствии с этим правилом заполнение атомных орбиталей электронами происходит таким образом, чтобы в пределах квантового подуровня суммарный спин был максимальным.
Спин, определяемый собственным моментом импульса электрона, является векторной величиной, поэтому он обозначается стрелкой ↑ ( 
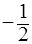
Т.е. при одном и том же и значении орбитального квантового числа должно быть максимальное число электронов, имеющих одно и тоже направление (или 
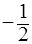
Правило Клечковского
В 1961 г. русский ученый В.М. Клечковский сформулировал общее положение, согласно которому электрон занимает в основном состоянии уровень с наименьшим значением суммы ( n + ℓ), а если эти суммы равны, то вначале заполняется тот подуровень, где n имеет меньшее значение ( соответственно ℓ большее).
Последовательность энергетических уровней в порядке возрастания энергии примерно следующая:
где 1,2 – значения главного квантового числа n;
Графическое изображение распределения электронов по уровням в виде таблицы имеет следующий вид:
-1 0 +1
Лекция 3
Дата добавления: 2021-01-21 ; просмотров: 20 ; Мы поможем в написании вашей работы!
Квантовые числа
Материалы портала onx.distant.ru
Квантовые числа
Общая характеристика квантовых чисел
Принцип (запрет) Паули
Правило Хунда
Примеры решения задач
Задачи для самостоятельного решения
Общая характеристика квантовых чисел
| Значение n | 1 | 2 | 3 | 4 | 5 | 6 |
| Обозначение слоя | K | L | M | N | O | P |
Различия в энергиях электронов, принадлежащих к различным подуровням данного энергетического уровня, отражает побочное (орбитальное) квантовое число l. Электроны в атоме с одинаковыми значениями n и l составляют энергетический подуровень (электронную оболочку). Максимальное число электронов в оболочке Nl:
Побочное квантовое число принимает целые значения 0, 1, … (n – 1). Обычно l обозначается не цифрами, а буквами:
| Значение l | 0 | 1 | 2 | 3 | 4 |
| Обозначение орбитали | s | p | d | f | g |
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, форму орбитали, орбитальный момент импульса электрона.
Таким образом, электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого зависит от значения l. Так, если l = 0, (s-орбиталь), то электронное облако имеет сферическую симметрию. При l = 1 (p-орбиталь) электронное облако имеет форму гантели. d-орбитали имеют различную форму: dz 2 — гантель, расположенная по оси Z с тором в плоскости X – Y, dx2 — y2 — две гантели, расположенные по осям X и Y; dxy, dxz, dyz, — две гантели, расположенные под 45 o к соответствующим осям.
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, а также определяет величину проекции орбитального момента импульса на ось Z. ml принимает значения от +l до — l, включая 0. Общее число значений ml равно числу орбиталей в данной электронной оболочке.
Магнитное спиновое квантовое число ms характеризует проекцию собственного момента импульса электрона на ось Z и принимает значения +1/2 и –1/2 в единицах h/2p (h – постоянная Планка).
Принцип (запрет) Паули
В атоме не может быть двух электронов со всеми четырьмя одинаковыми квантовыми числами. Принцип Паули определяет максимальное число электронов Nn, на электронном слое с номером n:
На первом электронном слое может находиться не более двух электронов, на втором – 8, на третьем – 18 и т. д.
Правило Хунда
Заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным. Например, три р-электрона на орбиталях р-оболочки располагаются следующим образом:
Таким образом, каждый электрон занимает одну р-орбиталь.
Примеры решения задач
Задача 1. Охарактеризуйте квантовыми числами электроны атома углерода в невозбужденном состоянии. Ответ представьте в виде таблицы.
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
| 6 | 2 | 1 | 0 | +1/2 |
Задача 2. Охарактеризуйте квантовыми числами внешние электроны атома кислорода в основном состоянии. Ответ представьте в виде таблицы.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 | 0 | 0 | –1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | –1 | +1/2 |
| 6 | 2 | 1 | 1 | –1/2 |
Решение. Согласно правилу Хунда электроны в квантовых ячейках располагаются следующим образом:
Значения главного, побочного и спинового квантовых чисел у электронов одинаковы и равны n=4, l=2, ms=+1/2. Рассматриваемые электроны отличаются значениями квантовых чисел ml.
| № электрона | n | l | ml | ms |
| 1 | 4 | 2 | 2 | +1/2 |
| 2 | 4 | 2 | 1 | +1/2 |
| 3 | 4 | 2 | 0 | +1/2 |
| 4 | 4 | 2 | –1 | +1/2 |
| 5 | 4 | 2 | –2 | +1/2 |
Задача 4. Рассчитайте максимальное число электронов в электронном слое с n = 4.
Решение. Максимальное число электронов, обладающих данным значением главного квантового числа, рассчитываем по формуле (2). Следовательно, в третьем энергетическом уровне может быть не более 32 электронов.
Задача 5. Рассчитайте максимальное число электронов в электронной оболочке с l = 3.
Решение:
Максимальное число электронов в оболочке определяется выражением (1). Таким образом, максимальное число электронов в электронной оболочке с l = 3 равно 14.
Задачи для самостоятельного решения
1. Охарактеризуйте квантовыми числами электроны атома бора в основном состоянии. Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
2. Охарактеризуйте квантовыми числами d-электроны атома железа в основном состоянии. Ответ представьте в виде таблиц:
Расположение 3d-электронов атома железа на орбиталях:
Значения квантовых чисел этих электронов:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
Шесть 3d-электронов атома железа располагаются на орбиталях следующим образом
Квантовые числа этих электронов приведены в таблице
| № электрона | n | l | ml | ms |
| 1 | 3 | 2 | 2 | +1/2 |
| 2 | 3 | 2 | 1 | +1/2 |
| 3 | 3 | 2 | 0 | +1/2 |
| 4 | 3 | 2 | — 1 | +1/2 |
| 5 | 3 | 2 | — 2 | +1/2 |
| 6 | 3 | 2 | 2 | — 1/2 |
3. Каковы возможные значения магнитного квантового числа ml, если орбитальное квантовое число l = 3?
Ответ: ml = +3; +2; +1; 0, — 1, — 2, — 3.
4. Охарактеризуйте квантовыми числами находящиеся во втором электронном слое электроны:
Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
| 7 | ? | ? | ? | ? |