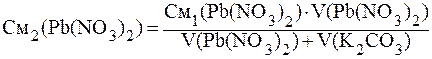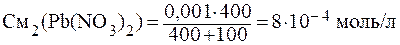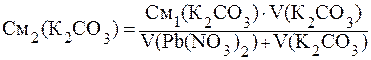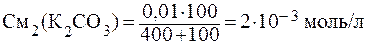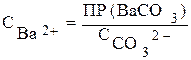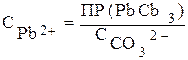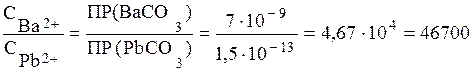как узнать выпадает ли осадок или нет
Определение возможности выпадения осадка малорастворимого электролита в обменной реакции



Знание численной величины произведения растворимости позволяет сделать прогноз, будет ли выпадать осадок малорастворимого соединения в результате обменной реакции. Например, для того чтобы при сливании растворов AgNO3 и K3PO4 выпал осадок Ag3PO4 в результате обменной реакции
необходимо, чтобы образующийся раствор был перенасыщен ионами серебра и фосфат-ионами. Важно понимать, что ПР – это характеристика, относящаяся к насыщенному раствору, поэтому выпадение осадка произойдёт в том случае, если, в полученном растворе произведение концентраций (ПК) ионов, образующих осадок, больше, чем произведение растворимости (ПР) или, более кратко, условие выпадения осадка: ПК > ПР.
При решении подобных задач необходимо в первую очередь найти в исходных растворах число моль тех ионов, которые могут образовать осадок (в данном случае – это ионы Ag + и PO4 3– ).
n(Na3PO4) = 5·10 –5 моль/л · 1 л = 5·10 –5 моль = n(PO4 3– ).
n(AgNO3) = 2·10 –3 моль/л · 1 л = 2·10 –3 моль = n(Ag + ).
В растворе, образующемся после смешивания, число моль ионов Ag + и PO4 3– до образования осадка будет таким же, как и в исходных растворах, а объём раствора станет равен 2 литрам:
Концентрации ионов Ag + и PO4 3– в полученном растворе будут следующими:
C(Ag + ) = n(Ag + ) / Vобщий = 2·10 –3 моль / 2 л = 1·10 –3 моль/л;
C(PO4 3– ) = n(PO4 3– ) / Vобщий = 5·10 –5 моль / 2 л = 2,5·10 –5 моль/л.
Образование осадка происходит в результате реакции, протекающей по уравнению 3 Ag + + PO4 3– ® Ag3PO4¯, поэтому произведение концентраций (ПК) ионов Ag + и PO4 3– в полученном растворе следует рассчитывать по уравнению:
Расчёт количеств ионов Pb 2+ и Cl – в исходных растворах:
n(Pb(NO3)2) = 0,005 моль/л · 0,2 л = 0,001 моль = n(Pb 2+ ).
В растворе NaCl: n(NaCl) = C(NaCl)·Vраствора NaCl;
n(NaCl) = 0,01 моль/л · 0,3 л = 0,003 моль = n(Cl – ).
В растворе, образующемся после смешивания, число моль ионов Pb 2+ и Cl – до образования осадка будет таким же, как и в исходных растворах, а объём раствора станет равен 0,5 литра:
Vобщий ≈ Vраствора Pb(NO3)2 + Vраствора NaCl = 0,2 л + 0,3 л = 0,5 л.
Концентрации ионов Ag + и PO4 3– в полученном растворе будут следующими:
C(Pb 2+ ) = n(Pb 2+ ) / Vобщий = 0,001 моль / 0,5 л = 0,002 моль/л = 2·10 –3 моль/л;
C(Cl – ) = n(Cl – ) / Vобщий = 0,003 моль / 0,5 л = 0,006 моль/л = 6·10 –3 моль/л.
Образование осадка происходит в результате реакции, протекающей по уравнению Pb 2+ + 2 Cl – ® PbCl2¯, поэтому произведение концентраций (ПК) ионов Pb 2+ и Cl – в полученном растворе следует рассчитывать по уравнению:
В задании № 7 (таблица 5.2) студентам предлагается определить возможность выпадения осадка при смешивании двух растворов электролитов.
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
2) взаимодействие металлов с азотной кислотой (концентрированной)
3) разложение нитратов
Взаимодействие активных металлов с концентрированной серной кислотой:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Газ с резким запахом. Растворимый в воде
2) взаимодействие некоторых металлов с концентрированной серной кислотой
2) обменные реакции солей аммония
1) горение азотсодержащих веществ;
2) разложение нитрита аммония:
Газы, поддерживающие горение:
(иногда, для озона — запах свежести);
(для NO2 – бурый цвет)
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
Таблица качественных реакций
— цвета осадков
Осадки белого цвета
нерастворимый в воде;
нерастворимый в HNO3
качественная реакция на соли серебра;
качественная реакция на хлорид-ионы;
нерастворимый в кислотах
качественная реакция на соли бария;
качественная реакция на сульфат-ионы;
образуется при пропускании газа без цвета с резким запахом через известковую воду;
растворяется при пропускании избытка газа;
растворяется в кислотах
растворение в кислотах:
CaSO3 + 2H + → SO2↑ + H2O + Ca 2+
образуется при добавлении щелочи;
растворяется в избытке щелочи
избыток щелочи : Al(OH)3 + NaOH =Na[Al(OH) 4 ];
образуется при пропускании газа без цвета и запаха через известковую воду;
растворяется при пропускании избытка газа;
растворяется в кислотах
растворение в кислотах:
Осадок светло-желтого цвета
(осадок кремового цвета)
образуется при приливании AgNO3;
нерастворим в HNO3;
качественная реакция на бромид-ионы;
(качественная реакция на соли серебра);
Осадок желтого цвета
образуется при приливании AgNO3;
нерастворим в HNO3;
качественная реакция на иодид-ионы;
(качественная реакция на соли серебра);
Осадок желтого цвета
образуется при приливании AgNO3;
растворим в кислотах;
Осадки коричневых цветов
Осадок бурого цвета
образуется при взаимодействии с растворами щелочей;
качественная реакция на соли железа
Осадки синих и зеленых цветов
Осадки зеленого цвета
Осадок голубого цвета
(осадок синего цвета)
образуется при взаимодействии с растворами щелочей
качественная реакция на соли меди ( II)
Осадок синего цвета
образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли
качественная реакция на соли железа ( II) — с красной кровяной солью;
качественная реакция на соли железа ( III) — с желтой кровяной солью;
Осадки черного цвета
Осадок черного цвета
Образуется при взаимодействии с сульфидами или с H2S
качественная реакция на сульфид-ионы
Еще на эту тему:
Обсуждение: «Таблицы качественных реакций»
а какого цвета осадок тетрагидроксоалюмината натрия?
а это не осадок, это растворимое вещество
Любой осадок возможно растворим другим веществом. В данной среде вещество ведет себя пассивно от того и осаждается.
порода, до этого промытая кислотами, была залита мною аптечным йодом и прокипела в нём целую ночь. После остывания была добавлена вода, раствор отстоялся и был декантирован. Раствор представляет собой очень тёмный, чёрно-коричневый золь. В луче фонаря видна мельчайшая, не оседающая, не фильтрующаяся пыль. При добавлении в золь соляной к-ты выпадает красно-коричневый осадок, а раствор светлеет до тёмно красного. В растворе появляется свободный йод обнаруживаемый крахмалом, до прибавления солянки йод не обнаруживался. Так вот, выпавший осадок не растворяется ни в кислотах, ни в щелочах, не реагирует с хлором, растворить его больше ни в чём не получается, на частицы породы уже не похож. Напоминает по цвету осадок смеси гидроксидов железа II и III, однако нерастворим в кислотах. Что это может быть, хотя бы класс соединения узнать? Подскажите пожалуйста.
напишите хотя бы примерно что за порода…
Это глинистая порода светло коричневого цвета. После травления указанной породы смесью соляной к-ты с гипохлоритом натрия был получен жёлтый раствор. Раствор был нейтрализован и осаждён гидрокарбонатом натрия, осадок отправлен на спектральный анализ, вот результат в массовых долях:
13Al 5.420±0.061
14Si 1.136±0.023
15P 0.597±0.019
16S 0.279±0.010
17Cl 77.974±0.066
20Ca 5.778±0.014
22Ti 0.157±0.017
26Fe 8.506±0.026
29Cu 0.152±0.002
Да, результат более чем странный, но ведь лаборатория анализ делала! В общем, эта же порода (поскольку растворилась лишь незначительная, незаметная на глаз её часть) была промыта водой и обработана указанным выше способом. Больше ничего не знаю))) Подскажите хотя бы возможные варианты полученного осадка.
После обработки смесью гипохлорита и соляной все указанные элементы должны были перейти в раствор. После реакции с гидрокарбонатом могло получиться:
Al(OH)3, CaCO3, Ca(OH)2, Ti(OH)2, возможно, Ti(OH)CO3, Fe(OH)2, Fe(OH)3, Cu(OH)2, возможно очень небольшие кол-ва карбонатов, хотя, после промывания водой они должны были раствориться
Дело в том, что полученный раствор после травления солянкой с гипохлоритом был декантирован с породы и только тогда обработан гидрокарбонатом, там действительно могли образоваться указанные вами осадки хоть это и противоречит результатам лаб. анализа. Но не в этом дело. Состав этого раствора я привёл лишь для понимания какие элементы могут там содержаться. Сама порода была промыта водой и затем обработана аптечным йодом, как я писал ранее в первом посте, вот осадок полученный после йода меня интересует.
Указанные осадки как раз по составу соответствуют анализу, ну да ладно. Смотрите по таблице растворимости, что дает с йодом осадок
Условия образования и выпадения осадка
Осадок малорастворимого электролита образуется тогда, когда после смешивания растворов реагентов произведение молярных концентраций веществ катионов и анионов буде большим, чем ПР осадка при данной температуре (ИП > ПР осадка):
Так как произведение растворимости – величина постоянная, поэтому при увеличении ионной силы раствора концентрация ионов малорастворимого электролита увеличивается, что приводит к увеличению растворимости осадка.
Ø Чем меньше тенденция к переходу осадка в раствор, тем меньше произведение растворимости и растворимость соответствующего соединения;
Ø Направление реакции обмена между двумя электролитами в растворе определяется возможностью образования между ионами малорастворимого соединения, выпадающего в осадок (чем меньшая растворимость образованного малорастворимого соединения, тем сильнее смещено равновесие в сторону её образования).
Наряду с образованием осадка в качественном анализе большое значение имеет и растворение осадка, который является обратным процессу образования:
Сдвиг гетерогенного равновесия вправо может происходить в следующих случаях:
ü происходит связывание ионов в растворе в другой, менее растворимый осадок;
Растворение осадка не происходит, но такая операция позволяет определить в растворе анион или катион, входящий в первоначальный осадок. Соединение, которым проводится обработка, должно быть хорошо растворимо и полностью диссоциировано на ионы.
ü происходит реакция комплексообразования с участием ионов металла;
ü анион переходит в малодиссоциирующую кислоту;
ü происходит восстановление или окисление ионов.
Растворимость осадков зависит от:
a Концентрации ионов водорода (растворимость осадков в кислотах).
Диссоциация малорастворимого соединения:ВаСО3 « Ва 2+ + СО3 2-
При действии на осадок ВаСО3 кислоты (ионов Н + ) равновесие между осадком и раствором смещается вправо (согласно принципу Ле Шателье) потому, что карбонат-ион связывается с ионами водорода с образованием слабой угольной кислоты:
Действие кислоты на осадок зависит от:
· Значения произведения растворимости малорастворимой соли(чем больше ПР соли, тем большая растворимость осадка этой соли);
· Величины константы диссоциации образованной слабой кислоты (чем меньше Кдис. слабой кислоты, тем большая растворимость осадка).
Если растворимость вещества в воде сопровождается поглощением теплоты, то повышение температуры вызывает увеличение растворимости осадка (принцип Ле Шателье) – осаждение необходимо проводить на холоде.
Например, растворимость РbCI2 при комнатной температуре равна 10,9г/л, а при 100 С – 333,8г/л.
a Природы растворителя
При добавлении к воде органических растворителей растворимость неорганических солей, как правило, уменьшается: растворимость полярных веществ в полярных растворителях больше, чем в неполярных.
Применение правила произведения растворимости в аналитической химии для:
Ø решения вопросов образования и растворения осадков;
Ø вычисления растворимости малорастворимых соединений (количество молей вещества, содержащихся в 1л насыщенного раствора при данной температуре):
S(АаВb) = 
Ø решения вопросов последовательности образования и выпадения осадков (действие групповых реактивов).
Дробное осаждение – это метод, с помощью которого одним и тем же осадителем последовательно разделяют несколько ионов, пользуясь разными величинами произведения растворимости образованных соединений. В качественном анализе используют в тех случаях, когда осадки отличаются по внешнему виду (окрашивание).
Сущность: сначала выпадает в осадок соединение, произведение растворимости которого имеет меньшую величину.
Гидролиз солей
Гидролиз– это обменное взаимодействие веществ с водой, при которой составные части этого вещества соединяются с составными частями воды. Гидролизу могут подвергаться химические соединения разных классов: соли, жиры, углеводы, белки.
 |
В практике качественного анализа чаще всего имеют дело с гидролизом солей и солеподобных соединений.
Способы усиления гидролиза:
ü разбавление растворов;
ü повышение температуры;
ü удаление продуктов гидролиза;
ü добавление к раствору: катионов – сильных комплексообразователей и анионов – сильных доноров пар электронов.
Для усиления гидролиза соли, образованной катионом слабого основания и анионом сильной кислоты, необходимо добавить основание для связывания получающихся в процессе гидролиза ионов водорода: NH4 + + HOH ↔ NH4OH + H +
При добавлении основания произойдёт нейтрализация кислоты и динамическое равновесие сдвинется вправо, т.е. гидролиз усилится. Если же к раствору подобной соли прибавить кислоты, то гидролиз затормозится.
Прибавление кислоты приводит к нейтрализации основания, и динамическое равновесие сдвигается вправо, т.е. гидролиз усиливается. Если в раствор подобной соли ввести основание, то гидролиз замедлится.
Определяем хороший и плохой осадок в вине
Заметив в бутылке осадок, многие считают, что вино испортилось. На самом деле не всегда так. Поэтому очень важно уметь отличать плохой осадок от хорошего, который часто гарантирует качество напитка. Мы рассмотрим самые популярные виды и причины образования винных отложений на дне. Если в бутылке с вином есть осадок, его следует проанализировать по следующим показателям:
1. Характер осадка. По своей природе винные отложения бывают микробиологическими и физико-химическими.
Микробиологические (бактерии, дрожжи) – это остаточные продукты брожения, они образуют осадок в виде хлопьев серого цвета с красным ли желтоватым оттенком. При долгом контакте с вином ухудшают его вкус.
Микробиологические отложения характерны для домашнего виноградного вина и его фруктовых аналогов. Чтобы избавиться от дрожжевых хлопьев домашнее вино сливают с осадка – переливают через тоненькую трубочку в другую емкость.
В магазинных винах микробиологических осадков быть не должно, поскольку напиток проходит несколько стадий фильтрации. Наличие осадка как минимум свидетельствует о нарушении технологии производства. Еще одна причина – бутылка не была герметично закрыта, вследствие чего вино снова начало бродить. Понятно, что покупать подобные напитки не стоит.
Кристаллический осадок (винный камень) – появляется на дне в виде прозрачных кристалликов, напоминающих битое стекло или сахар. Это затвердевшие соли калия и кальция, которые попадают в вино вместе с виноградом, затем выпадают в осадок при брожении и созревании напитка.

Наличие винного камня зависит от технологии производства (тщательности фильтрации) и возраста вина. Чем старше напиток, тем больше в нем может быть маленьких кристалликов. Кристаллический осадок абсолютно безвреден и указывает на натуральность вина, не влияя на вкус. Чтобы он не мешал дегустации, перед подачей на стол вино декантируют – переливают из бутылки в специальный графин.

Любой другой осадок – в большинстве случаев это твердые скопления, имеющие разную форму и цвет. Могут быть остатками диоксида серы, который используется как консервант, или иметь другую природу появления. Например, резкое изменение температуры помещения, где находится бутылка, приводит к помутнению, потом эти частички скапливаются на дне. Сказать однозначно, безвредны ли подобные осадки, нельзя. Лучше выбирать вино, где их нет.

2. Вид вина. Осадок может появиться как в красном, так и в белом вине и даже в шампанском (очень редко). Если это обычный винный камень, то причин для паники нет. Напитки, которые планируют выдерживать длительное время, разливают в специальные бутылки с воронкообразным дном, чтобы потом их было проще декантировать. Подобная бутылка признак того, что виноделы ждут осадка в своем продукте.
Вина многих известных регионов, например французского Бордо, традиционно имеют больше осадка, так как подвергаются минимальной фильтрации. Это также уместно для всех элитных вин длительной выдержки. Перед покупкой советую предварительно узнать, насколько характерен осадок для выбранного вами вина.

Выводы
Осадок в вине появляется по разным причинам. Единственный осадок, который считается нормальным – это винный камень, свидетельствующий о натуральности напитка. Все другие отложения ставят покупку выбранной бутылки под сомнение. В самых дешевых отечественных винах не должно быть даже винного камня.
УСЛОВИЕ ВЫПАДЕНИЯ ОСАДКА.



Произведение растворимости является одной из основных характеристик осадка. Пользуясь этой характеристикой, можно изменять растворимость осадка, рассчитывать оптимальные условия осаждения, предвидеть, какими реакциями осаждения лучше пользоваться для определения тех или иных ионов.
Из уравнения (3.1.) вытекают условия образования в растворе осадка:
Осадок малорастворимого электролита образуется только в том случае, когда произведение концентраций его ионов (П) в растворе превышает величину произведения растворимости этого соединения, т.е. когда раствор становится пересыщенным относительно данного малорастворимого соединения. Из ненасыщенного раствора осадок не выделяется, происходит растворение твёрдой фазы.
ПРИМЕР 3.6 Определить, образуется ли осадок PbCО3 при смешении 400 мл 0,001 М Pb(NO)2 и 100 мл 0,01 М К2СО3.
Решение: Найдём молярные концентрации веществ в момент смешения по формуле:
Концентрации ионов, образующих осадок, равны:
[Pb 2+ ]= См2(Pb(NO)2), т.к. при диссоциации из 1 моль соли образуется 1 моль ионов свинца.
Итак, карбонаты бария и свинца будут выпадать одновременно из раствора, если СВа 2+ >СРb 2+ в 46700 раз. Если отношение СВа 2+ / СPb 2+ >46700, то первым из раствора будет выпадать ВаСО3 до тех пор, пока отношение СВа 2+ / СPb 2+ не будет равным 46700. И только после этого начнется одновременное выпадение осадков. Если же отношение концентрации ионов бария и свинца меньше 46700, то первым начнет осаждаться карбонат свинца. Осаждение карбоната свинца будет протекать до тех пор, пока отношение СВа 2+ / СPb 2+ не достигнет значения, при котором ВаСО3 и РbСО3 будут осаждаться одновременно.