В чем биологический смысл гетерохроматизации одной х хромосомы
В чем биологический смысл гетерохроматизации одной х хромосомы
Анеуплоидия по Х-хромосоме — одна из наиболее частых онтогенетических аномалий. Относительная устойчивость кариотипа человека к хромосомным аномалиям Х-хромосомы может объясняться инактивацией Х-хромосомы, процессом, эпигенетически подавляющим большинство генов в одной из двух Х-хромосом у женщин, не давая им производить какие-либо продукты. Здесь мы обсудим хромосомный и молекулярный механизмы инактивации Х-хромосомы.
Инактивация Х-хромосомы. Теория инактивации Х-хромосомы гласит, что в соматических клетках здоровых женщин (но не у мужчин) одна Х-хромосома инактивируется в начале эмбрионального развития, уравнивая таким образом экспрессию генов этой хромосомы у двух полов. В нормальных женских клетках выбор инактивируемой Х-хромосомы произволен, а затем поддерживается в каждом клоне клетки.
Таким образом, женщины мозаичны по экспрессии Х-сцепленных генов; некоторые клетки экспрессируют аллели, унаследованные от отца, другие клетки — от матери. Этот образец экспрессии генов отличает большинство Х-сцепленных генов от импринтируемых генов (также экспрессирующих только один аллель, но определяемых родительским началом не случайно), а также от большинства аутосомных генов, экспрессирующих оба аллеля.
Хотя неактивная Х-хромосома сначала была обнаружена цитологически по присутствию гетерохроматиновой массы (названной тельцем Барра) в интерфазных клетках, существует много эпигенетических характеристик, различающих активные и неактивные Х-хромосомы. Проливая свет на механизмы Х-инактивации, эти особенности могут быть диагностически значимыми для установления неактивной Х-хромосомы в клиническом материале.
Хромосомные характеристики Х-инактивации:
— Инактивация большинства генов, расположенных на неактивной Х-хромосоме
— Произвольный выбор одной из двух Х-хромосом в женских клетках
— Неактивная Х-хромосома:
а) гетерохроматиновая (тельце Барра)
б) поздно реплицируется в S фазе
в) экспрессирует XIST-PHK
г) связана с модификациями гистона macroH2A в хроматине
Область промотора многих генов в неактивной Х-хромосоме существенно модифицируется присоединением метильной группы к цитозину при действии фермента ДНК-метилтрансферазы. Как уже упоминалось в контексте геномного импринтинга в главе 5, такое метилирование ДНК связано с CpG динуклеотидами и приводит к неактивному состоянию хроматина. Дополнительные различия между активными и неактивными Х-хромосомами связаны с гистоновым кодом и оказались существенной частью механизма Х-инактивации.
Например, содержание варианта гистона macroH2A очень возрастает в неактивном хроматине Х-хромосом и позволяет различить две хромосомы в женских клетках.
У пациентов с дополнительными Х-хромосомами все Х-хромосомы, кроме одной, инактивируются. Таким образом, все диплоидные соматические клетки как у мужчин, так и у женщин, имеют единственную активную Х-хромосому, независимо от общего числа Х- или Y-хромосом.
Примечательно, что эти гены не распределены произвольно по Х-хромосоме: большинство генов, избегающих инактивации, расположены на плече Хр (до 50%), по сравнению с Xq (несколько процентов). Данный факт имеет большое значение для генетического консультирования в случаях частичной хромосомной анеуплоидии X, так как дисбаланс генов на Хр может иметь большее клиническое значение, чем дисбаланс Xq.
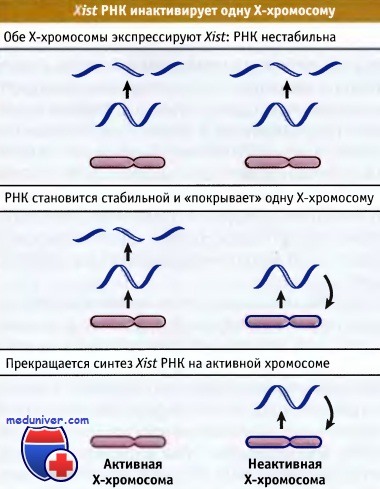
которая покрывает неактивную хромосому.
Центр Х-инактивации и ген XIST
При исследованиях структурно аномальных инактивированных Х-хромосом был картирован центр Х-инактивации в проксимальном отделе Xq, в полосе Xql3. Центр Х-инактивации содержит необычный ген XIST (англ. Xinactivate specific transcripts; специфическая транскрипция инактивированной Х-хромосомы), оказавшийся ключевым управляющим локусом Х-инактивации. Ген XIST имеет новую характеристику: он экспрессируется только в аллеле на неактивной Х-хромосоме; он отключен на активной Х-хромосоме как в мужских, так и в женских клетках.
Хотя точный способ действия гена XIST неизвестен, Х-инактивация не может происходить в его отсутствие. Продукт XIST — некодирующая белок РНК, остающаяся в ядре в тесной ассоциации с неактивной Х-хромосомой и тельцем Барра.
Неслучайная инактивация Х-хромосомы
Х-инактивация в норме происходит в женских соматических клетках случайным образом и приводит к мозаицизму по двум популяциям клеток, экспрессирующих аллели одной или другой Х-хромосомы. Тем не менее существуют исключения из этого правила, когда в кариотипе имеются структурно аномальные Х-хромосомы. Например, почти у всех пациентов с несбалансированными структурными аномалиями Х-хромосомы (включая делеции, дупликации и изохромосомы) структурно аномальная хромосома всегда неактивна, что, вероятно, отражает вторичный отбор против генетически несбалансированных клеток, которые могли бы привести к значимым клиническим аномалиям.
Из-за преимущественной инактивации аномальной Х-хромосомы такие аномалии Х-хромосомы имеют меньшее влияние на фенотип, чем аналогичные аномалии аутосом, и, следовательно, более часто обнаруживаются.
Неслучайную инактивацию наблюдают также в большинстве случаев транслокаций X на аутосому. Если такая транслокация сбалансирована, избирательно инактивируется нормальная Х-хромосома, и две части транслоцированной хромосомы остаются активными, вероятно, снова отражая отбор против клеток с неактивированными аутосомными генами. В несбалансированном потомстве сбалансированного носителя, тем не менее, присутствует только продукт транслокации, несущий центр Х-инактивации, и такая хромосома неизменно инактивируется; нормальная Х-хромосома всегда активна.
Эти неслучайные образцы инактивации имеют общий эффект снижения, хотя и не всегда устранения, клинических последствий конкретного хромосомного дефекта. Поскольку образцы Х-инактивации хорошо согласуются с клиническим результатом, определение цитогенетическим или молекулярным анализом индивидуального образца Х-инактивации показано во всех случаях транслокации X и аутосом.
Одна закономерность, иногда наблюдающаяся у сбалансированных носителей транслокаций Х-хромосомы на аутосому, проявляется тем, что сам разрыв может вызывать мутации, нарушая ген в точке транслокации. Единственная нормальная копия конкретного гена инактивируется в большинстве или всех клетках из-за неслучайной инактивации нормальной Х-хромосомы, таким образом приводя к экспрессии у женщины сцепленного с полом признака, обычно наблюдающегося только у гемизиготных мужчин.
Выявлено несколько Х-сцепленных генов, когда типичный фенотип сцепленного с полом состояния обнаруживали у женщин с доказанной транслокацией Х-хромосомы на аутосому. Главный клинический вывод из этой информации — если женщина проявляет сцепленный с полом фенотип, обнаруживаемый обычно только у мужчин, показан хромосомный анализ с высоким разрешением. Обнаружение сбалансированной транслокации может объяснить фенотипическую экспрессию и выявить вероятную позицию гена на карте Х-хромосомы.
Клетки, у которых + аллель находится на активной хромосоме, обладают диким фенотипом, но клетки,
у которых на активной хромосоме находится аллель, приобретают мутантный фенотип.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В чем биологический смысл гетерохроматизации одной х хромосомы
• В процессе эмбриогенеза одна из двух Х-хромосом в каждой клетке организма плацентарных млекопитающих произвольно инактивируется
• В отдельных случаях, когда в клетке присутствует более двух Х-хромосом, инактивируются все, кроме одной
• Xic (центр инактивации) представляет собой цис-активируемую область Х-хромосомы, которая необходима и достаточна для того, чтобы убедиться в том, что активной осталась только одна Х-хромосома
• Xic включает ген Xist, который кодирует РНК, обнаруживаемую только на неактивной Х-хромосоме
• Механизм, ответственный за предотвращение накопления Xist РНК на активной хромосоме, неизвестен
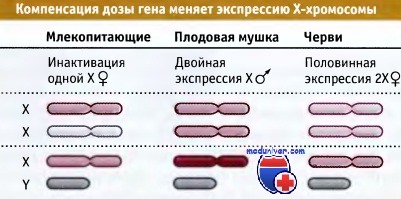
Проблема пола приобретает особо важное значение для регуляции активности генов, поскольку среди живых организмов существуют различия в количестве Х-хромосом. Если бы гены, локализованные в Х-хромосоме, в равной степени экспрессировались у обоих полов, женские особи должны были бы иметь в два раза больше каждого генного продукта, чем мужские. Для того чтобы не допустить этого, существует механизм компенсации дозы генов, с помощью которого у обоих полов уравнивается экспрессия генов Х-хромосомы. На рисунке ниже представлены различные механизмы, позволяющие осуществлять такую компенсацию у различных особей:
• У млекопитающих одна из двух женских Х-хромосом полностью инактивирована. В результате, в клетках женской особи присутствует только одна активная Х-хромосома, что соответствует мужскому организму. Активная женская Х-хромосома и единственная мужская хромосома характеризуются одним и тем же уровнем экспрессии.
• У Drosophila уровень экспрессии единственной мужской Х-хромосомы удваивается по сравнению с экспрессией каждой женской хромосомы
• У C.elegans уровень экспрессии каждой женской Х-хромосомы достигает лишь половинного уровня по сравнению с экспрессией единственной Х-хромосомы у мужской особи

Общая особенность всех механизмов компенсации дозы генов заключается в том, что мишенью регуляции служит вся хромосома. При этом происходят глубокие изменения, затрагивающие все промоторы хромосомы. Больше всего нам известно об инактивации Х-хромосомы у женских особей, когда хромосома целиком приобретает гетерохроматиновую организацию.
Характерным свойством гетерохроматина является его конденсированное состояние, сопряженное с отсутствием генетической активности. Гетерохроматин можно подразделить на две категории:
• Конститутивный гетерохроматин, который содержит специфические последовательности, не обладающие кодирующей функцией. Обычно к их числу относятся сателлитные ДНК, часто локализованные в центромерных участках хромосом. Для этих областей характерна гетерохроматиновая организация
• Факультативный гетерохроматин, который принимает форму целой хромосомы; в одних клетках она может быть неактивна, а в других может экспрессироваться. Классический пример представляет Х-хромосома млекопитающих. Неактивная Х-хромосома состоит из гетерохроматина, а активная представляет собой часть эухроматина. Таким образом, оба состояния хроматина содержат одинаковые последовательности ДНК. Когда хроматин приобрел неактивную организацию, она наследуется потомками клеток. Это пример эпигенетической наследственности, поскольку наследование признака не определяется последовательностью ДНК.
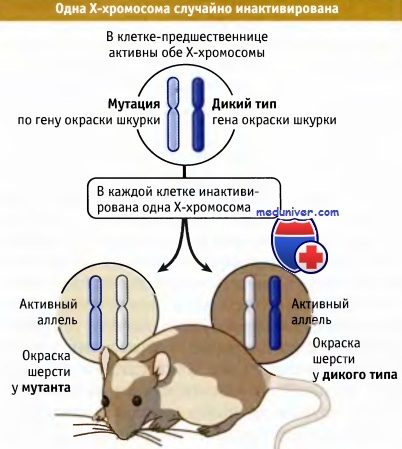
Наши основные представления об особенностях функционирования женских Х-хромосом сложились к 1961 г. в форме гипотезы функционирования одной Х-хромосомы. Самки мышей, гетерозиготных по мутации, затрагивающей окраску тела, сцепленную с полом, обладали мозаичным фенотипом, при котором окраска одних участков кодировалась геном дикого типа, а других — мутантным геном. Как следует из рисунка ниже, это можно объяснить, если принять, что в небольшой популяции клеток-предшественников одна из двух Х-хромосом в каждой клетке произвольным образом инактивируется.
Клетки, в которых инактивирована Х-хромосома, несущая ген дикого типа, образуют потомство, экспрессирующее на активной хромосоме только мутантный аллель. При развитии окраски клетки, которые произошли от определенного предшественника, располагаются рядом, и т. о. образуют пятно определенного цвета, создавая видимый эффект мозаичности. В другом случае отдельные клетки в популяции экспрессируют тот или иной аллель, сцепленный с Х-хромосомой. Например, у гетерозигот по локусу G6PD Х-хромосомы любая из красных кровяных клеток будет экспрессировать только одну из двух аллельных форм. (У плацентарных млекопитающих происходит случайная инактивация одной Х-хромосомы. У сумчатых выбор предопределен: у них всегда наследуется инактивированная отцовская Х-хромосома.)

Клетки, у которых + аллель находится на активной хромосоме, обладают диким фенотипом, но клетки,
у которых на активной хромосоме находится аллель, приобретают мутантный фенотип.
Инактивация Х-хромосомы у женских особей происходит в соответствии с правилом n-1; и если в клетке присутствуют несколько Х-хромосом, инактивируются все, за исключением одной. Обычно у женских особей в клетках присутствуют две Х-хромосомы, однако в редких случаях может наблюдаться 3Х или более сложный генотип, и тогда только одна Х-хромосома остается активной. Это позволяет предполагать существование общего механизма, который ограничивает протекание специфических процессов только одной хромосомой и защищает ее от инактивации, которой подвергаются остальные.
Для инактивации оказывается достаточным выключить один локус Х-хромосомы. Когда между Х-хромосомой и аутосомой происходит транслокация, этот локус попадает только в один из образующихся продуктов, и возможна инактивация только этого продукта. Исследуя разные транслокации, можно определить местонахождение этого локуса, который называется Xic (X-inactiva-tion center). Клонированная область размером 450 тпн обладает всеми свойствами Xic. Когда эта область включается в аутосому, то образующаяася трансгенная аутосома может инактивироваться (в клеточной культуре).
Xic представляет собой цис-активируемый локус, содержащий всю информацию, необходимую для того, чтобы определить количество Х-хромосом и инактивировать все, кроме одной копии. Инактивация распространяется от локуса Xic по всей хромосоме. Если Xic присутствует в продукте транслокации между хромосомой и аутосомой, инактивация распространяется на область аутосомы (хотя эффект не всегда проявляется полностью).
Локус Xic содержит ген, называемый Xist, который экспрессируется только в неактивной Х-хромосоме. Этот ген ведет себя совершенно противоположным образом по сравнению с прочими генами, присутствующими в хромосоме, которые выключаются. Делеция в локусе Xist предотвращает инактивацию Х-хромосомы, однако не влияет на функционирование механизма подсчета Х-хромосом (поскольку остальные хромосомы могут инактивироваться). Таким образом, Xist обладает двумя характерными чертами: содержит неидентифицированный компонент (или компоненты), необходимый для подсчета, и Xist ген, участвующий в инактивации.
Рисунок ниже иллюстрирует роль Xist РНК в инактивации Х-хромосомы. Ген кодирует РНК, у которой отсутствует открытая рамка считывания. Эта РНК «покрывает» Х-хромосому, на которой она синтезировалась, что предполагает наличие у нее структурной роли. Эта РНК образуется при участии обеих женских Х-хромосом до момента их инактивации. После инактивации РНК обнаруживается только на неактивной Х-хромосоме.
До момента инактивации Xist РНК характеризуется периодом полусуществования порядка 2 ч. Инактивация достигается за счет стабилизации РНК на неактивной хромосоме. Для Xist РНК характерна пятнистость распределения вдоль хромосомы. Это позволяет предполагать, что ассоциация ее с белками с образованием определенных структур может играть стабилизирующую роль. Пока мы не знаем, какие дополнительные факторы могут участвовать в этом процессе и каким образом ограничивается распространение Xist РНК вдоль хромосомы.
Процессы, характерные для неактивной Х-хромосомы, включают отсутствие ацетилирования Н4 гистона и метилирование последовательности CpG. По-видимому, они происходят позже, являясь частью механизма инактивации.
Правило n-1 предполагает, что стабилизация Xist РНК представляет собой процесс, происходящий «по умолчанию», и что некий блокирующий механизм предотвращает стабилизацию одной Х-хромосомы (которая становится активной хромосомой). Это означает, что хотя Xist является необходимым и достаточным инструментом инактивации хромосомы, для поддержания функционирования активной Х-хромосомы могут потребоваться продукты других генов.

которая покрывает неактивную хромосому.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Генетические нарушения у человека и методы их выявления
Генами называются участки ДНК, в которых закодирована структура всех белков в теле человека или любого другого живого организма. В биологии действует правило: «один ген – один белок», то есть в каждом гене содержится информация только об одном определенном белке.
В 1990 году большая группа ученых из разных стран начала проект под названием «Геном человека». Он завершился в 2003 году и помог установить, что человеческий геном содержит 20–25 тысяч генов. Каждый ген представлен двумя копиями, которые кодируют один и тот же белок, но могут немного различаться. Большинство генов одинаковые у всех людей – различается всего 1%.
ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом – эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки – гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
В клетках человека есть структуры, которые называются митохондриями. Они выполняют роль «электростанций» и отвечают за дыхание. Это единственные клеточные органеллы, у которых есть собственная ДНК. И в ней тоже могут возникать нарушения. 
Весь набор хромосом в клетке называется кариотипом. В норме у человека он представлен 23 парами хромосом, всего их 46. Выделяют два вида хромосом:
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод – световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:

Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
Эта методика позволяет в одном исследовании выявлять делеции и дупликации участков ДНК по всему геному. Разрешающая способность стандартного ХМА от 100 000 пар нуклеотидов – «букв» генетического кода (в отдельных регионах от 10 000 п. н.).
С помощью ХМА можно выявлять:
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
Мутации в генах и заболевания, к которым они способны приводить
Мутации – это изменения, которые происходят в ДНК как случайным образом, так и под действием разных факторов, например химических веществ, ионизирующих излучений. Они могут затрагивать как отдельные «буквы» генетического кода, так и большие участки генома. Мутации происходят постоянно, и это основной двигатель эволюции. Чаще всего они бывают нейтральными, то есть ни на что не влияют, не приносят ни вреда, ни пользы. В редких случаях встречаются полезные мутации – они дают организму некоторые преимущества. Также встречаются вредные мутации – из-за них нарушается работа важных белков, наоборот, происходят достаточно часто. Генетические изменения, которые происходят более чем у 1% людей, называются полиморфизмами – это нормальная, естественная изменчивость ДНК Полиморфизмы ответственны за множество нормальных отличий между людьми, таких как цвет глаз, волос и группа крови.
Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы.
Например, карий цвет глаз у человека является доминантным. Поэтому у кареглазых родителей с высокой вероятностью родится кареглазый ребенок. Если у одного из родителей глаза карие, а у другого голубые, то вероятность рождения кареглазых детей в такой семье тоже высока. У двух голубоглазых родителей, скорее всего, все дети тоже будут голубоглазыми. А вот у кареглазых родителей может родиться ребенок с голубыми глазами, если у обоих есть рецессивные «гены голубоглазости», и они достанутся ребенку. Конечно, это упрощенная схема, потому что за цвет глаз отвечает не один, а несколько генов, но на практике эти законы наследования зачастую работают. Аналогичным образом потомству могут передаваться и наследственные заболевания.
Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Секвенирование по Сэнгеру – метод секвенирования (определения последовательности нуклеотидов, буквально – «прочтение» генетического кода) ДНК, также известен как метод обрыва цепи. Анализ используется для подтверждения выявленных мутаций. Это лучший метод для идентификации коротких тандемных повторов и секвенирования отдельных генов. Метод может обрабатывать только относительно короткие последовательности ДНК (до 300–1000 пар оснований) одновременно. Однако самым большим недостатком этого метода является большое количество времени, которое требуется для его проведения.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Панель исследования — тестирование на наличие определенных мутаций, входящих в перечень конкретной панели исследования. Анализ позволяет выявить одномоментно разные мутации, которые могут приводить к генетическим заболеваниям. Анализ позволяет компоновать мутации в панели по частоте встречаемости (скрининговые панели, направленные на выявление носительства патологической мутации, часто встречаемой в данном регионе или в определенной замкнутой популяции) и по поражаемому органу или системе органов (панель «Патология соединительной ткани»). Но и у этого анализа есть ограничения. Анализ не позволяет выявить хромосомные аберрации, мозаицизм и мутации, не включенные в панель, митохондриальные заболевания, а также эпигенетические нарушения.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома – тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS – определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.
Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4–10 бластомеров). Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38–40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант – исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.

Автор статьи
Пелина Ангелина Георгиевна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.



