В чем была несостоятельность планетарной модели атома
Планетарная модель атома Резерфорда
«Каждый, кто надеется, что преобразования атомных ядер станут источником энергии, исповедует вздор.»
Эрнест Резерфорд
Модель Томсона была первым пробным шагом в познании микромира. Однако она не отвечала на многие вопросы. Требовался новый нестандартный взгляд для создания модели, способной разрешить возникшие противоречия.
Модель атома, предложенная Томсоном, давала только общее представление о строении атома и не согласовывалась со все новыми данными экспериментов и теоретических вычислений. Настало время создания другой модели, способной согласовать теорию и эксперимент.
Этого не может быть. Или факты — упрямая вещь
К 1904 году японский физик Хантаро Нагаока разработал раннюю «планетарную модель» атома — так называемый «атом типа Сатурна». Модель была разработана по аналогии с расчетами устойчивости колец Сатурна. И хотя впоследствии модель и оказалась ошибочной, два следствия из нее все-таки оказались пророческими:
Годом раньше немецкий физик Филипп фон Ленард попытался создать модель, которая не предполагала раздельное существование в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц — динамид, каждая из которых является электрическим дуплетом. Расчеты, выполненные Ленардом, показали, что эти частицы должны иметь очень маленькие размеры, то есть большая часть объема атома представляет собой пустоту.
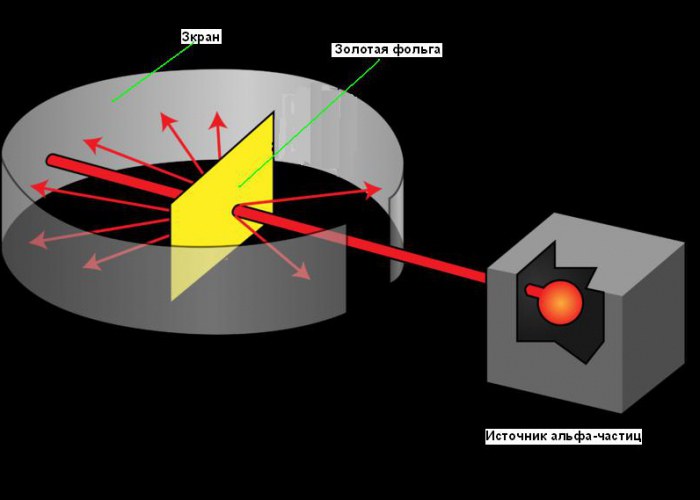
В 1909 году Ганс Гейгер и Эрнест Марсден под руководством Эрнеста Резерфорда решили попытаться найти экспериментальное подтверждение модели Томсона и провели ставшие классическими опыты по рассеиванию альфа-частиц на тонкой золотой фольге. Альфа-частицы были выбраны благодаря своей большей массе (в 7350 раз больше массы электрона), поэтому они не должны претерпевать сколь-нибудь заметного отклонения при взаимодействии с электронами. Это позволяет исследовать только положительную составляющую атома. Источником альфа-частиц послужил радий. Частицы, проходящие через золотую фольгу, рассеивались, и это рассеяние регистрировалось по сцинтилляционным вспышкам на экране из сульфида цинка.
В начале эксперимента исследовались только малые углы отклонения альфа-частицы. И тут выяснилось, что подавляющее большинство частиц проходили сквозь фольгу, как раскаленная дробинка через кусок масла, словно мишень была прозрачна для бомбардирующих ее частиц. Наблюдалось лишь весьма незначительное отклонение порядка одного градуса.
Затем Резерфорд поручил молодому сотруднику Марсдену выяснить, могут ли частицы рассеиваться на большие углы. В частности, до 180°. И вот зимним днем 1909 года Марсден остановил на университетской лестнице Резерфорда и сказал: «Вы были правы, профессор: они возвращаются». Это было невероятно и противоречило существующей модели атома. Таким образом, вместо доказательства правоты Томсона эксперименты Резерфорда доказали ее несостоятельность.
Тот факт, что альфа-частицы возвращались, говорил о том, что они столкнулись с преградой — очень массивной положительно заряженной частицей, но эти столкновения происходили очень редко, в среднем — одно на восемь тысяч. А это уже свидетельство о том, что. Впрочем, именно над этим и задумался Резерфорд.
Альфа-частица (а-частица)— положительно заряженная частица, образованная двумя протонами и двумя нейтронами, по сути это ядро атома гелия. Поток альфа-частиц называют альфа-лучами, или альфа-излучением.
И все-таки он вертится!
И задумался он на целых два года. К 1911 году результатом его раздумий явилась новая модель строения атома. Однако обо всем по порядку.
Альфа-частицы, проходя через фольгу, проходят сквозь атомы золота в большинстве случаев без отклонений.
Из этого следуют два вывода. Первый: легкие электроны практически не влияют на движение тяжелой альфа-частицы. Вывод второй: так как альфа-частицы в большинстве случаев отклоняются на малые углы, атом в большей части своего объема пустой.
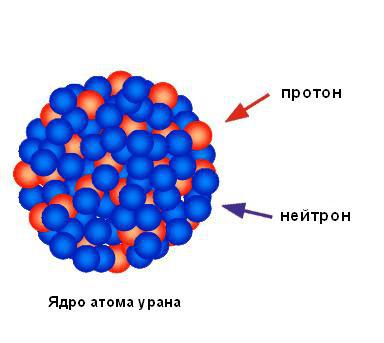
Небольшая часть альфа-частиц все же отклоняется на значительные углы. А значит, вывод третий такой: центральная часть атома очень маленьких размеров, но в ней сосредоточена почти вся масса атома, и эта центральная часть имеет положительный заряд. Она и получила название ядра атома.
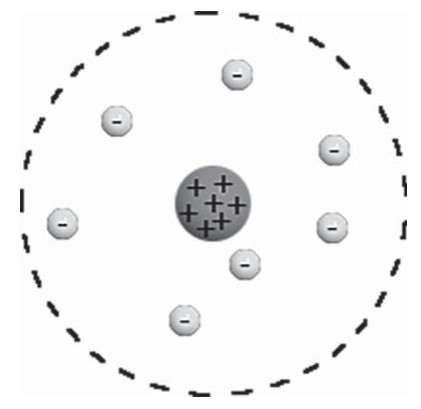
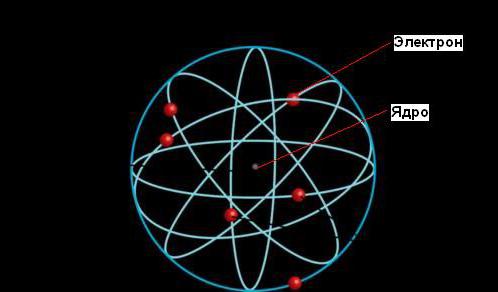
Согласно Резерфорду, атом состоит из массивного положительного ядра и вращающихся по определенным орбитам вокруг него электронов, что само по себе напомнило Солнечную систему, поэтому модель и получила название планетарной.
Если представить атом в виде сферы диаметром один километр — его ядро будет размером с мелкую монету.
Однако и эта модель атома оказалась в противоречии с классической физикой. Согласно теории Максвелла, любой ускоренно движущийся заряд должен непрерывно излучать электромагнитные волны. Поскольку электроны, вращаясь вокруг ядра, движутся с центростремительным ускорением, они должны непрерывно излучать электромагнитные волны. На самом же деле в нормальном состоянии атомы не излучают!
Таким образом, эти факты были несовместимы с планетарной моделью атома Резерфорда, если рассматривать ее с позиции классической электродинамики.
Разрешения этих противоречий были еще впереди. Пока же количество вопросов значительно превышало число удобоваримых объяснений. Тем не менее, это был значительный шаг на пути понимания устройства мира. Добавим лишь, что рассеяние микрочастиц на других частицах или атомных ядрах — это квантовый процесс, а для его описания необходимо уравнение Шредингера, которого в 1911 году еще попросту не было.
Модель атома Резерфорда. Достоинства и недостатки



Резерфорд предложил Планетарную модель атома:
В центре атома находится маленькое плотное положительное Ядро, а вокруг его вращаются отрицательные электроны. Размер атома определяется диаметром орбиты вращения электронов вокруг ядра. В целом атом электронейтрален. Данная модель хорошо согласовалась со всеми известными явлениями, включая и опыты по рассеянию a-частиц.
Строение 3-х первых атомов таблицы Менделеева по Резерфорду:
Не 2 протона, 2 нейтрона, 2 электрона;
Достоинства модели Резерфорда:
Хорошо описывает геометрическое строение атома.
Недостатки модели Резерфорда:
Не объясняет энергетическую устойчивость атома. Электрон вращается вокруг ядра, следовательно, имеет центростремительное ускорение, следовательно, излучает энергию, радиус вращения уменьшается и электрон должен упасть на ядро. А это не происходит.
Недостатки планетарной модели атома



Урок 86. Физика
Быть может, эти электроны –
Миры, где пять материков,
Искусства, знания, войны, троны
И память сорока веков!
Вселенная, где сто планет;
Там все, что здесь, в объеме сжатом,
Но также то, чего здесь нет!
Мы сегодня переходим к рассмотрению вопроса о важнейшем этапе становления физики – изучение сложного строения атома.
Запишите вопросы, которые мы рассмотрим на уроке
1.Исторические сведенияо возникновении теории строения вещества
2.Модель атома Томсона
3.Опыт Резерфорда по экспериментальному исследованию распределения положительного заряда внутри атома.
4.Планетарная модель атома
1.Исторические сведения о возникновении теории строения вещества
Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества. Открыли электрон, измерили его массу и заряд. Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 году, развил Л. Лоренц. Именно он создал электронную теорию: электроны входят в состав атома.
Модель атома Томсона
Опираясь на открытия, Дж. Томсон в 1898 г. предложил одну из первых модель строения атома. Атом – шар, по всему объёму которого равномерно распределён положительный заряд. Внутри шара находятся электроны. Каждый электрон может совершать колебательные движения около своего положения равновесия. Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю.
Большинство физиков склонялось, что прав Дж. Томсон.
Однако в физике уже более 200 лет принято правило: окончательный выбор между гипотезами вправе сделать только опыт
Опыт Резерфорда по экспериментальному исследованию распределения положительного заряда внутри атома.
Такой опыт поставил в 1909 г. Эрнест Резерфорд (1871-1937) со своими сотрудниками.
Планетарная модель атома
В поисках разгадки Резерфорд предложил Гейгеру и Марсдену проверить: «а не могут ли α-частицы отскакивать от фольги назад».
Прошло два года. За это время Гейгер и Марсден сосчитали более миллиона сцинтилляций и доказали, что назад отражается примерно одна α-частица из 8 тысяч.
Резерфорд показал, что модель Томсона находится в противоречии с его опытом. Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома:
1.Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома.
2.В ядре сконцентрирована почти вся масса атома.
3.Отрицательный заряд всех электронов распределен по всему объему атома.
Расчеты показали, что α-частицы, которые взаимодействуют с электронами в веществе, почти не отклоняются. Только некоторые α-частицы проходят вблизи ядра и испытывают резкие отклонения.
Недостатки планетарной модели атома
Резерфорд создал планетарную модель атома, электроны обращаются вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.(слайд)
Эта модель проста, обоснована экспериментально, но не позволяет объяснить устойчивость атома
Д.З Составить конспект и ответить на вопросы
А.1.В чем заключается сущность модели Томсона?
2.Начертите и объясните схему опыта Резерфорда по рассеиванию α-частиц. Что наблюдаем в этом опыте?
3.Объясните причину рассеивания α-частиц атомами вещества?
4.В чем сущность планетарной модели атома?
5.Почемуэто строение называется планетарной моделью?
Б.1.Определить атом, какого химического элемента изображен на схеме
2.Изобразить модель атома С (углерода).Дочитать стих и внимательно посмотреть на год написания.
Стихотворение. Валерий Брюсов “Мир электрона”. (1922г)
Планетарная модель атома: опыт Резерфорда
Планетарную модель атома предложил Э. Резерфорд в 1910 году. Первые исследования структуры атома были сделаны им при помощи альфа-частиц. На основе результатов, полученных в экспериментах по их рассеянию, Резерфорд предположил, что весь положительный заряд атома сосредоточен в крошечном ядре в его центре. С другой стороны, отрицательно заряженные электроны распределены внутри всего остального его объема.
Немного предыстории
Первую гениальную догадку о существовании атомов сделал древнегреческий ученый Демокрит. С тех пор идея о существовании атомов, комбинации которых дают все окружающие нас вещества, не покидала воображения людей науки. Периодически к ней обращались различные ее представители, но до начала XIX века их построения были всего лишь гипотезами, не подкрепленными опытными данными.
Наконец, в 1804 году, более чем за сто лет до того как появилась планетарная модель атома, английский ученый Джон Дальтон представил доказательства его существования и ввел понятие атомного веса, явившееся его первой количественной характеристикой. Как и его предшественники, он представлял атомы мельчайшими частями материи, похожими на твердые шарики, которые не могут быть разделены на еще более мелкие частицы.
Открытие электрона и первая модель атома
Эта модель удовлетворительно объясняла то обстоятельство, что при нагревании вещества оно начинает излучать свет. Хотя это была первая попытка понимания того, что же такое атом, она не смогла удовлетворить результатам экспериментов, выполненных позже Резерфордом и другими. Томсон в 1911 году согласился, что его модель просто не может ответить, как и почему происходит наблюдаемое в опытах рассеяние α-лучей. Поэтому она была оставлена, а на смену ей пришла более совершенная планетарная модель атома.
Как же все таки устроен атом?
Эрнест Резерфорд дал объяснение явления радиоактивности, которое принесло ему Нобелевскую премию, однако его наиболее значительный вклад в науку был сделан позднее, когда он установил, что атом состоит из плотного ядра, окруженного орбитами электронов, подобно тому, как Солнце окружено орбитами планет.
Согласно планетарной модели атома, большая часть его массы сконцентрирована в крошечном (по сравнению с размерами всего атома) ядре. Электроны двигаются вокруг ядра, путешествуя с невероятной скоростью, но большая часть объема атомов является при этом пустым пространством.
Опыты Резерфорда
Планетарная модель атома возникла в 1911, после знаменитого эксперимента с золотой фольгой, позволившего получить некоторые фундаментальные сведения о его строении. Путь Резерфорда к открытию атомного ядра является хорошим примером роли творчества в науке. Его поиски начались еще в 1899 году, когда он обнаружил, что некоторые элементы испускают положительно заряженные частицы, которые могут проникать через что угодно. Он назвал эти частицы альфа (α) частицами (теперь мы знаем, что они были ядрами гелия). Как и все хорошие ученые, Резерфорд был любопытен. Он задавался вопросом, можно ли использовать альфа-частицы, чтобы узнать структуру атома. Резерфорд решил нацелить луч альфа-частиц на лист очень тонкой золотой фольги. Он выбрал золото, потому что из него можно получать листы толщиной всего 0,00004 см. За листом золотой фольги он поставил экран, который светился, когда альфа-частицы ударяли в него. Его использовали для обнаружения альфа-частиц после их прохождения через фольгу. Небольшая прорезь в экране позволяла лучу альфа-частиц достичь фольги после выхода из источника. Часть из них должна пройти сквозь фольгу и продолжать двигаться в том же направлении, другая их часть должна отскакивать от фольги и отражаться под острыми углами. Вы можете увидеть схему эксперимента на рисунке ниже.
Что же получилось в опыте Резерфорда?
Исходя из модели атома Дж. Дж. Томсона, Резерфорд предполагал, что сплошные области положительного заряда, заполняющие весь объем золотых атомов, будут отклонять или сгибать траектории всех альфа-частиц, когда они проходят через фольгу.
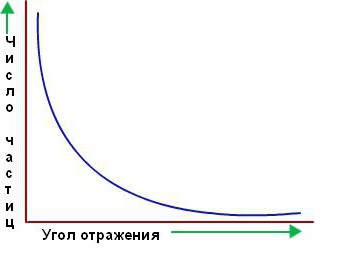
Однако подавляющее большинство альфа-частиц прошло прямо через золотую фольгу, как будто ее и не было. Казалось, они проходят через пустое пространство. Лишь немногие из них отклоняются от прямого пути, как и предполагалось вначале. Ниже приведен график зависимости количества частиц, рассеянных в соответствующем направлении, от угла рассеяния.
Удивительно, но крошечный процент частиц возвращался от фольги, как баскетбольный мяч отскакивает от щита. Резерфорд понял, что эти отклонения были результатом прямого столкновения между альфа-частицами и положительно заряженными компонентами атома.
Ядро занимает центральное место
Исходя из ничтожного процента отразившихся от фольги альфа-частиц, можно сделать вывод, что весь положительный заряд и практически вся масса атома сосредоточены в одной маленькой области, а в остальной части атома в основном находится пустое пространство. Резерфорд назвал площадь концентрированного положительного заряда ядром. Он предсказал и вскоре обнаружил, что оно содержит положительно заряженные частицы, которые он назвал протонами. Резерфорд предсказал существование нейтральных атомных частиц, называемых нейтронами, но он не смог обнаружить их. Тем не менее его ученик Джеймс Чедвик открыл их через несколько лет. На рисунке ниже показана структура ядра атома урана.
Атомы состоят из положительно заряженных тяжелых ядер, окруженных вращающимися вокруг них отрицательно заряженными чрезвычайно легкими частицами-электронами, причем на таких скоростях, что механические центробежные силы просто балансируют их электростатическое притяжение к ядру, и в этой связи якобы обеспечивается стабильность атома.
Недостатки этой модели
Основная идея Резерфорда относилась к идее малоразмерного атомного ядра. Предположение об орбитах электронов было чистой гипотезой. Он не знал точно, где и как электроны вращаются вокруг ядра. Поэтому планетарная модель Резерфорда не объясняет распределение электронов на орбитах.
Основная идея Резерфорда относилась к идее малоразмерного атомного ядра. Предположение об орбитах электронов было чистой гипотезой. Он не знал точно, где и как электроны вращаются вокруг ядра. Поэтому планетарная модель Резерфорда не объясняет распределение электронов на орбитах.
Кроме того, стабильность атома Резерфорда была возможна только при непрерывном движении электронов по орбитам без потерь кинетической энергии. Но электродинамические расчеты показали, что движение электронов по любым криволинейным траекториям, сопровождающееся изменением направления вектора скорости и появлением соответствующего ускорения, неизбежно сопровождается излучением электромагнитной энергии. При этом, согласно закону сохранения энергии, кинетическая энергия электрона должна очень быстро израсходоваться на излучение, и он должен упасть на ядро, как схематически показано на рисунке ниже.
От Резерфорда к Нильсу Бору
Следующий крупный шаг вперед в атомной истории произошел в 1913 году, когда датский ученый Нильс Бор опубликовал описание более детальной модели атома. Она определяла более четко места, где могут находиться электроны. Хотя позже ученые будут развивать и более изысканные атомные конструкции, но планетарная модель атома Бора была в основном правильной, и многое из нее принимается до сих пор. Она имела множество полезных приложений, например с ее помощью объясняют свойства различных химических элементов, характер спектра их излучений и строение атома. Планетарная модель и модель Бора явились важнейшими вехами, обозначившими появление нового направления в физике – физики микромира. Бор получил Нобелевскую премию 1922 по физике за его вклад в наше понимание структуры атома.
Что же нового привнес Бор в модель атома?
Будучи еще молодым человеком, Бор работал в лаборатории Резерфорда в Англии. Поскольку в модели Резерфорда была слабо проработана концепция электронов, Бор сосредоточился именно на них. В результате была существенно доработана планетарная модель атома. Постулаты Бора, которые он сформулировал в своей статье «О строении атомов и молекул», вышедшей в 1913 году, гласят:
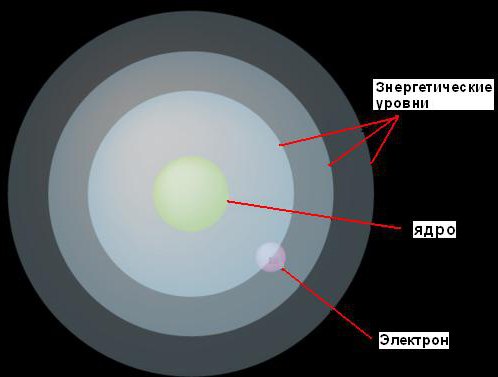
1. Электроны могут двигаться вокруг ядра только на фиксированных расстояниях от него, определяемых тем количеством энергии, которое у них есть. Он назвал эти фиксированные уровни энергетическими уровнями или электронными оболочками. Бор представлял их в виде концентрических сфер, с ядром в центре каждой из них. При этом электроны с меньшей энергией будут найдены на более низких уровнях, ближе к ядру. Те же из них, у кого больше энергии, будут найдены на более высоких уровнях, дальше от ядра.
2. Если электрон поглощает некоторое (вполне определенное для данного уровня) количество энергии, то он будет прыгать на следующий, более высокий энергетический уровень. И наоборот, если он потеряет такое же количество энергии, то вернется назад к исходному уровню. Однако электрон не может существовать на двух энергетических уровнях.
Эта идея иллюстрируются рисунком.
Энергетические порции для электронов
Если энергию сравнить с водой и вы хотите добавить ее к материи в виде стакана, вы не можете просто залить воду непрерывной струей. Вместо этого вы можете добавить ее в небольших количествах, например, по чайной ложке. Бор считал, что если электроны могут поглощать или терять только фиксированные количества энергии, то они должны варьировать свою энергию только этими фиксированными количествами. Таким образом, они могут занимать только фиксированные энергетические уровни вокруг ядра, которые соответствуют квантованным приращениям их энергии.
Так из модели Бора вырастает квантовый подход к объяснению, что же из себя представляет строение атома. Планетарная модель и модель Бора явились своеобразными ступенями от классической физики к квантовой, являющейся основным инструментом в физике микромира, включая и атомную физику.
§ 43. Противоречия планетарной модели атома. Постулаты Бора
Противоречия планетарной модели атома
1. Модель строения атома, предложенная Резерфордом, оказывается в противоречии с основными законами классической физики. Она не могла объяснить устойчивость атомов.
В действительности же атомы достаточно устойчивы и не излучают энергию в невозбуждённом состоянии.
Постулаты Бора
2. Выход из создавшегося положения был найден Бором. В 1913 г. он предложил идею, основанную на квантовых представлениях, которая позволила понять и объяснить стабильность атома. В виде постулатов Бор сформулировал положения новой теории, которые налагали определённые ограничения на классические представления о движении микрочастиц и электромагнитном излучении.
Нильс Хенрик Давид Бор (1885—1962) — датский физик-теоретик, один из основоположников современной физики, член Датского королевского общества, член многих академий и научных обществ мира, иностранный член Академии наук СССР. Внёс значительный вклад в развитие теории атомного ядра и ядерных реакций, процессов взаимодействия элементарных частиц со средой, которая явилась первой квантовой моделью атома; создал теорию во- дородоподобного атома; сформулировал важный для понимания квантовой механики принцип дополнительности, фундаментальное для ядерной физики представление о характере протекания ядерных реакций (модель составного ядра); один из создателей капельной модели ядра; совместно с Дж. Уилером развил теорию деления ядер.
Постулаты Бора гласят:
1. Атом может находиться в особых стационарных состояниях, каждому из которых соответствует определённая энергия Еn. В стационарном состоянии атом не излучает.
2. Излучение света происходит при переходе атома из стационарного состояния с большей энергией Еm в стационарное состояние с меньшей энергией Еn.
Энергия излучённого фотона равна разности энергий атома в стационарных состояниях:
В результате перехода электрона с орбиты m на орбиту n (рис. 142, а) происходит излучение кванта энергии hν. При поглощении энергии атом переходит из стационарного состояния с меньшей энергией Еn в стационарное состояние с большей энергией Еm (рис. 142, б). Энергия поглощённого фотона также равна разности энергий атома в стационарных состояниях: