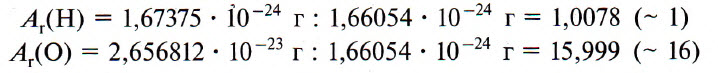В чем выражается атомная масса
Атомная масса
А́томная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12 C, поэтому атомная масса этого изотопа по определению равна точно 12. Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ). Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Зависимость атомной массы изотопа от массового числа такова: избыток массы положителен у водорода-1, с ростом массового числа он уменьшается и становится отрицательным, пока не достигается минимум у железа-56, потом начинает расти и возрастает до положительных значений у тяжёлых нуклидов. Это соответствует тому, что деление ядер, более тяжёлых, чем железо, высвобождает энергию, тогда как деление лёгких ядер требует энергии. Напротив, слияние ядер легче железа высвобождает энергию, слияние же элементов тяжелее железа требует дополнительной энергии.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере. Именно эта атомная масса представлена в периодической таблице Д. И. Менделеева, её используют в стехиометрических расчётах. Атомная масса элемента с нарушенным изотопным соотношением (например, обогащённого каким-либо изотопом) отличается от стандартной. Для моноизотопных элементов (таких как иод, золото и т. п.) атомная масса элемента совпадает с атомной массой его единственного представленного в природной смеси изотопа.
Молекулярной массой химического соединения называется сумма атомных масс элементов, составляющих её, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения. Строго говоря, масса молекулы меньше массы составляющих её атомов на величину, равную энергии связи молекулы. Однако этот дефект массы на 9-10 порядков меньше массы молекулы, и им можно пренебречь.
Определение моля (и числа Авогадро) выбирается таким образом, чтобы масса одного моля вещества (молярная масса), выраженная в граммах, была численно равна атомной (или молекулярной) массе этого вещества. Например, атомная масса железа равна 55,847. Следовательно один моль железа (т. е. количество атомов железа, равное числу Авогадро, 6,022·10 23 ) имеет массу 55,847 г.
Прямое сравнение и измерение масс атомов и молекул выполняется с помощью масс-спектрометрических методов.
История
До 1960-х годов атомную массу определяли таким образом, чтобы нуклид кислород-16 имел атомную массу 16 (кислородная шкала). Однако соотношение кислорода-17 и кислорода-18 в природном кислороде, который также использовался в расчётах атомной массы, приводило к наличию двух разных таблиц атомных масс. Химики использовали шкалу, основанную на том, что естественная смесь изотопов кислорода должна была иметь атомную массу 16, тогда как физики присваивали то же число 16 атомной массе наиболее распространённого изотопа кислорода (имеющего восемь протонов и восемь нейтронов).
В чем выражается атомная масса
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
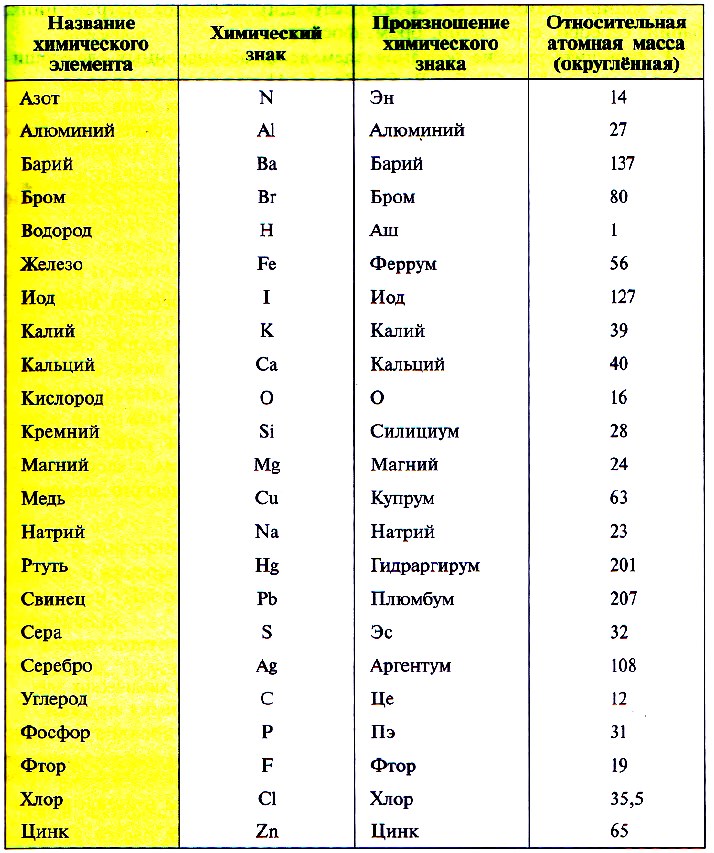
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».
Атомная масса
Полезное
Смотреть что такое «Атомная масса» в других словарях:
АТОМНАЯ МАССА — масса атома, выраженная в атомных единицах массы. Атомная масса меньше суммы масс, составляющих атом частиц (протонов, нейтронов, электронов), на величину, обусловленную энергией их взаимодействия (см., напр., Дефект массы) … Большой Энциклопедический словарь
Атомная масса — Atomic mass масса атома химического элемента, выраженная в атомных единицах массы (а.е.м.). За 1 а.е.м. принята 1/12 часть массы изотопа углерода с атомной массой 12. 1 а.е.м.=1,6605655·10 27 кг. Атомная масса складывается из масс всех протонов и … Термины атомной энергетики
атомная масса — – масса атомов элемента, выраженная в атомных единицах массы. Масса такого количества элемента, в котором содержится то же число атомов, что и в 12 г изотопа 12C. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
АТОМНАЯ МАССА — безразмерная величина. А. м. масса атома хим. элемента, выраженная в атомных единицах (см.) … Большая политехническая энциклопедия
АТОМНАЯ МАССА — (устаревший термин атомный вес), относительное значение массы атома, выраженное в атомных единицах массы (а. е. м.). А. м. меньше суммы масс составляющих атом ч ц на дефект масс. А. м. была взята Д. И. Менделеевым за осн. хар ку элемента при… … Физическая энциклопедия
атомная масса — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN atomic weight … Справочник технического переводчика
Атомная масса — Эту статью следует викифицировать. Пожалуйста, оформите её согласно правилам оформления статей. Атомная масса, относительная атомная масса (устаревшее название атомный вес) значение масс … Википедия
атомная масса — масса атома, выраженная в атомных единицах массы. За атомную массу химического элемента, состоящего из смеси изотопов, принимают среднее значение атомной массы изотопов с учётом их процентного содержания (эта величина приведена в периодической… … Энциклопедический словарь
АТОМНАЯ МАССА — Понятие об этой величине претерпевало длительные изменения в соответствии с изменением представления об атомах. Согласно теории Дальтона (1803), все атомы одного и того же химического элемента идентичны и его атомная масса это число, равное… … Энциклопедия Кольера
атомная масса — santykinė atominė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Cheminio elemento vidutinės masės ir nuklido ¹²C atomo masės 1/12 dalies dalmuo. atitikmenys: angl. atomic mass; atomic weight; relative atomic mass vok. Atommasse … Penkiakalbis aiškinamasis metrologijos terminų žodynas
атомная масса — santykinė atominė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Vidutinės elemento atomų masės ir 1/12 nuklido ¹²C atomo masės dalmuo. atitikmenys: angl. atomic mass; atomic weight; relative atomic mass vok. Atommasse, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Относительная атомная масса
А́томная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12 C, поэтому атомная масса этого изотопа по определению равна точно 12. только для свинца изотопа атомная масса не является целым числом, хотя и близка к массовому числу данного изотопа (т. е. суммарному количеству нуклонов — протонов и нейтронов — в его ядре). Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ). Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Зависимость атомной массы от массового числа такова: избыток массы положителен у водорода-1, с ростом массового числа он уменьшается и становится отрицательным, пока не достигается минимум у железа-56, потом начинает расти и возрастает до положительных значений у тяжёлых нуклидов. Это соответствует тому, что деление ядер, более тяжёлых, чем железо, высвобождает энергию, тогда как деление лёгких ядер требует энергии. Напротив, слияние ядер легче железа высвобождает энергию, слияние же элементов тяжелее железа требует дополнительной энергии.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере. Именно эта атомная масса представлена в периодической таблице, её используют в стехиометрических расчётах. Атомная масса элемента с нарушенным изотопным соотношением (например, обогащённого каким-либо изотопом) отличается от стандартной.
Молекулярной массой химического соединения называется сумма атомных масс элементов, составляющих её, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения. Строго говоря, масса молекулы меньше массы составляющих её атомов на величину, равную энергии связи молекулы. Однако этот дефект массы на 9-10 порядков меньше массы молекулы, и им можно пренебречь.
Определение моля (и числа Авогадро) выбирается таким образом, чтобы масса одного моля вещества (молярная масса), выраженная в граммах, была численно равна атомной (или молекулярной) массе этого вещества. Например, атомная масса железа равна 55,847. Поэтому один моль атомов железа (т. е. их количество, равное числу Авогадро, 6,022·10 23 ) содержит 55,847 граммов.
Прямое сравнение и измерение масс атомов и молекул выполняется с помощью масс-спектрометрических методов.
История
До 1960-х годов атомную массу определяли таким образом, чтобы изотоп кислород-16 имел атомную массу 16 (кислородная шкала). Однако соотношение кислорода-17 и кислорода-18 в природном кислороде, который также использовался в расчётах атомной массы, приводило к наличию двух разных таблиц атомных масс. Химики использовали шкалу, основанную на том, что естественная смесь изотопов кислорода должна была иметь атомную массу 16, тогда как физики присваивали то же число 16 атомной массе наиболее распространённого изотопа кислорода (имеющего восемь протонов и восемь нейтронов).
Атомный вес: что это такое, как рассчитывается и примеры
Содержание:
Термин «вес» в физике означает силу, действующую на гравитационное поле, выраженную в единицах силы, таких как ньютон. Однако с 1908 года используется термин «атомная масса», который сегодня более известен как относительная атомная масса; то есть они синонимы.
Атомы настолько малы, многочисленны и различаются даже для одного и того же элемента, что непросто присвоить им физическую величину, например массу. Точно со временем выбор единицы, представляющей вес или атомную массу химического элемента, изменился.
С 1961 года из-за большого значения атома углерода (C) было решено относить атомный вес к его изотопу C-12. Кроме того, атом C является центральным или ключевым химическим элементом органической химии и биохимии.
Что такое атомный вес?
Как упоминалось в первом разделе, термин атомная масса традиционно используется, но на самом деле это атомная масса. С 1961 года на основе атома углерода-12 его значение 12 было принято за шкалу относительных атомных весов.
При сравнении это означает, что атомы Mg тяжелее атомов H: в 24 раза точнее. Когда требуются значения веса или атомной массы какого-либо химического элемента, их можно получить, обратившись к таблице Менделеева.
Единицы
Одна из первых единиц атомного веса, а.е.м., была выражена как 1/16 (0,0625) веса атома кислорода.
Эта единица изменилась с открытием существования природных изотопов элемента в 1912 году; поэтому изотопы больше нельзя было игнорировать.
В настоящее время стандартная единица атомной массы или дальтон составляет 1/12 веса атома изотопа 12 C. Это более стабильно и обильнее, чем 13 C и 14 С.
Таким образом, относительный атомный вес или атомная масса в настоящее время может быть выражена в граммах на один моль атомов.
Как рассчитывается атомный вес?
Чтобы определить атомный вес, сначала необходимо вычислить атомную массу изотопа, которая является суммой количества протонов и нейтронов, имеющихся у определенного атома.
Количество электронов в нем не учитывается, так как его масса ничтожна по сравнению с массой нейтронов и протонов.
56 (0,93) + 54 (0,05) + 57 (0,02) = 55,92 г / моль атомов Fe
В этом кластере железо имеет атомный вес 55,92. Но как насчет остальной части всей планеты Земля или остальной Вселенной? В кластере всего три изотопа, содержание которых меняется с учетом Земли, где изотопов будет больше и расчеты усложняются.
Соображения
Чтобы рассчитать атомный вес элементов, указанных в периодической таблице, необходимо принять во внимание следующее:
-Изотопы, существующие в природе одного и того же химического элемента. Атомы одного и того же химического элемента с разным числом нейтронов являются изотопами этого химического элемента.
-В образцах, полученных от каждого изотопа, учитывается атомная масса каждого из них.
-Относительное содержание каждого из изотопов определенного элемента в образцах, встречающихся в природе, также имеет значение.
-Можно найти значение атомной массы отдельного атома или присутствующего в естественном образце элемента. Или группы атомов в случае изотопов одного и того же элемента, определяя стандартный или средний атомный вес.
-Для определения стандартной атомной массы химических элементов были рассмотрены один или несколько изотопов одного и того же элемента.
-Есть некоторые химические элементы, такие как франций (Fr), которые не имеют стабильных изотопов и еще не имеют стандартизованного атомного веса.
Примеры
Посмотрев на периодическую таблицу химических элементов, можно узнать атомный вес химического элемента; то есть те, которые были рассчитаны с учетом всех стабильных изотопов (и по этой причине они обычно имеют много десятичных знаков).
Для бора его атомный вес был определен на основе двух изотопов, полученных в природе, и его значение находится в диапазоне от 10,806 до 10821.
Не существует стандартного атомного веса для неприродных или синтетических элементов, не имеющих изотопов в природе; такие как вышеупомянутый случай франция (Fr), полония (Po), радона (Ra), среди других химических элементов.
В этих случаях атомный вес ограничивается суммой количества протонов и нейтронов этого элемента.
Значение атомного веса указано в скобках, что означает, что это не стандартизованный атомный вес. Даже значение стандартного атомного веса может измениться, если будет обнаружено больше изотопов определенного элемента.
Ссылки
6 самых зловещих экспериментов над людьми в США
Гильермо Гонсалес Камарена: биография, изобретения и вклад