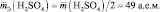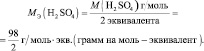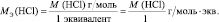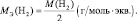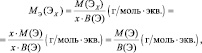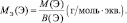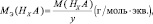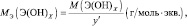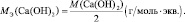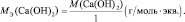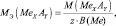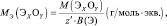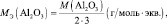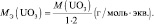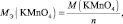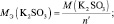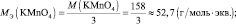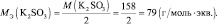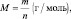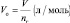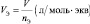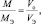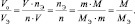В чем выражается эквивалентная масса
ЭКВИВАЛЕНТНАЯ МАССА
Полезное
Смотреть что такое «ЭКВИВАЛЕНТНАЯ МАССА» в других словарях:
эквивалентная масса — 4.1.3 эквивалентная масса: Масса условного ударника, вычисленная путем деления на ускорение свободного падения измеренного значения силы (в ньютонах), направленной вдоль вертикально расположенной оси ударника и необходимой для удержания плеча… … Словарь-справочник терминов нормативно-технической документации
эквивалентная масса — lygiavertė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Daugiadalelės sistemos arba iš kelių dalių sudaryto kūno masė, apskaičiuota pagal tam tikras taisykles arba formules. atitikmenys: angl. equivalent mass vok. äquivalente… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
эквивалентная масса — ekvivalentinė masė statusas T sritis fizika atitikmenys: angl. equivalent mass vok. äquivalente Masse, f rus. эквивалентная масса, f pranc. masse équivalente, f … Fizikos terminų žodynas
ЭКВИВАЛЕНТНАЯ ПЛОТНОСТЬ — масса глаза на единицу площади зрения, спроецированной на оптическую поверхность … Словарь понятий и терминов, сформулированных в нормативных документах российского законодательства
приведенная масса — lygiavertė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Daugiadalelės sistemos arba iš kelių dalių sudaryto kūno masė, apskaičiuota pagal tam tikras taisykles arba formules. atitikmenys: angl. equivalent mass vok. äquivalente… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Приведённая масса — условная характеристика распределения масс в движущейся механической или смешанной (например, электро механической) системе, зависящая от физических параметров системы (масс, моментов инерции, индуктивности и др.) и от её закона движения[1].… … Википедия
Эквивалент вещества — Эквивалент вещества или Эквивалент это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно восстановительных… … Википедия
ГОСТ Р 52762-2007: Методы испытаний на стойкость к механическим внешним воздействующим факторам машин, приборов и других технических изделий. Испытания на воздействие ударов по оболочке изделий — Терминология ГОСТ Р 52762 2007: Методы испытаний на стойкость к механическим внешним воздействующим факторам машин, приборов и других технических изделий. Испытания на воздействие ударов по оболочке изделий оригинал документа: 4.1.2 высота… … Словарь-справочник терминов нормативно-технической документации
Фактор эквивалентности — Эквивалент реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким либо иным образом эквивалентна (то есть равноценна) одному иону H+ в обменных реакциях или одному электрону в окислительно восстановительных … Википедия
Эквивалент (химия) — Эквивалент реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким либо иным образом эквивалентна (то есть равноценна) одному иону H+ в обменных реакциях или одному электрону в окислительно… … Википедия
Эквивалент вещества
Например, в реакции:
NaOH + HCl = NaCl + H2O
эквивалентом будет являться мнимая частица ½Zn(OH)2.
Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число моль вещества, эквивалентное одному моль катионов водорода в рассматриваемой реакции.
Содержание
Эквивалентная масса
Эквивалентная масса — это масса одного эквивалента данного вещества.
Эквивалентная молярная масса вещества
Молярная масса эквивалентов обычно обозначается как 


Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Фактор эквивалентности
Отношение эквивалентной молярной массы к его собственной молярной массе называется фактором эквивалентности (обозначается обычно как 
Число эквивалентности
Число эквивалентности z представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности 

Например, в реакции:
Эквивалентом является частица ½Zn(OH)2. Число ½ есть фактор эквивалентности, z в данном случае равно 2
| вещество | реакция | |||
|---|---|---|---|---|
| простое * | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |
 | число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |
 | характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |

Фактор эквивалентности помогает сформулировать закон эквивалентности.
Закон эквивалентов
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:
См. также
Примечания
| Атомно-молекулярное учение | Закон сохранения массы • Закон постоянства состава (закон кратных отношений) • Закон Авогадро (закон объёмных отношений) • Закон эквивалентов |
|---|---|
| Другие | Периодический закон |
| Разделы химии • Хронология химии | |
Полезное
Смотреть что такое «Эквивалент вещества» в других словарях:
Эквивалент(химия) — Эквивалент вещества его масса (выраженная в углеродных единицах), которая присоединяет или замещает атомную массу водорода (1,008 г) или половину атомной массы кислорода (15,9994/2 г.) Эквивалент кислоты равен ее молярной массе, деленной на… … Википедия
Эквивалент химический — Эквивалент вещества его масса (выраженная в углеродных единицах), которая присоединяет или замещает атомную массу водорода (1,008 г) или половину атомной массы кислорода (15,9994/2 г.) Эквивалент кислоты равен ее молярной массе, деленной на… … Википедия
Эквивалент элемента — Эквивалент вещества его масса (выраженная в углеродных единицах), которая присоединяет или замещает атомную массу водорода (1,008 г) или половину атомной массы кислорода (15,9994/2 г.) Эквивалент кислоты равен ее молярной массе, деленной на… … Википедия
ЭКВИВАЛЕНТ — (1) химический масса хим. элемента, которая присоединяет или замещает массу водорода, равную его атомной массе (1,0079) (или массу кислорода, равную половине его атомной массы). Так, хим. Э. хлора в НСl равен атомной массе хлора (35,45).… … Большая политехническая энциклопедия
Эквивалент — (от позднелат. equivalent «равнозначный», «равноценный»): Электрохимический эквивалент. Эквивалент вещества. Эквивалент сети. Эквивалент антенны. Механический эквивалент тепла. Тротиловый эквивалент … Википедия
Эквивалент (химия) — Эквивалент реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким либо иным образом эквивалентна (то есть равноценна) одному иону H+ в обменных реакциях или одному электрону в окислительно… … Википедия
ЭКВИВАЛЕНТ — (ново лат., от aeque равно, и valere стоить). 1) в химии: число, обозначающее количество какого нибудь вещества, которое может заменить собою другое вещество в известном химическом соединении, причем характер и свойства последнего останутся те же … Словарь иностранных слов русского языка
Эквивалент — – равнозначащий, равносильный продукт. Эквивалентность особенно важна при сравнении товаров и их обмене друг на друга. С этой целью применяются товарные эквиваленты, то есть товары, равноценные другим,… … Энциклопедия терминов, определений и пояснений строительных материалов
Эквивалент — 1. Эквивалент Реальная или условная частица вещества, которая в данной кислотно основной реакции эквивалентна одному иону водорода или в данной окислительно восстановительной реакции одному электрону. Форма записи: Источник: ГОСТ 6055 86: Вода.… … Словарь-справочник терминов нормативно-технической документации
Эквивалент электрохимический — Электрохимический эквивалент количество вещества, которое должно выделиться, согласно закону Фарадея, при прохождении через электролит единицы количества электричества: q=Э/F где Э эквивалент; F постоянная Фарадея … Википедия
Эквивалент. Закон эквивалентов
Материалы портала onx.distant.ru
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н + (одному иону ОН — или единичному заряду), а в данной окислительно- восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn +7 + 5e = Mn +2
в нейтральной среде: Mn +7 + 3e = Mn +4
в щелочной среде: Mn +7 + 1e = Mn +6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
Ответ: 3,73 л.
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
Ответ: 250 мл.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
Ответ: 0,56 л.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
Научная электронная библиотека
§ 2.1.2. Эквивалент
Эквивалент молекулы сложного вещества – это условная часть молекулы, являющаяся носителем одной функциональной связи или одного электрона, участвующего в окислительно-восстановительном процессе.
Эквивалентная масса 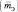
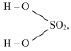
Например, если серная кислота (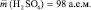
М (Н2 SO4) = 98 г/моль), имеющая структурную формулу:
взаимодействует с NaOH по реакции:
Н2SO4 + 2NaOH = Na2SO4 + 2Н2О, (2.1),
то у неё функциональны две связи Н – О. Вся молекула оказывается носительницей двух функциональных связей, а, значит, двух эквивалентов. Поэтому эквивалентом в данном случае является половина молекулы Н2SO4. Следовательно,
Молярная масса эквивалента (МЭ) – это масса одного моля эквивалента. В данном случае (MЭ(Н2SO4)) для приведённой реакции рассчитывается по формуле:
В аналогичной реакции взаимодействия NaOH с НСl молярная масса эквивалента соляной кислоты численно совпадает с молярной массой НСl:
НСl + NaOH = NaСl + Н2О;
Эквивалент молекулы простого вещества – это условная часть молекулы, являющаяся носителем одной валентности.
Например, молекула водорода состоит из двух атомов, каждый из которых обладает валентностью, равной единице. Поэтому, суммарная валентность молекулы этого простого вещества равна двум. Вся молекула оказывается носительницей двух валентностей, а, значит, согласно последнему определению, двух эквивалентов. Эквивалентом водорода оказывается половина молекулы. Молярная масса эквивалента ((MЭ(Н2)) рассчитывается по формуле:
Следует подчеркнуть, что хотя молекула водорода, также как и молекула соляной кислоты, содержит только одну функциональную связь, однако формулы для расчёта молярных масс эквивалентов этих веществ существенно различаются, потому что одно из них является простым, а другое сложным.
В общем случае, молярные массы эквивалентов (МЭ) рассчитываются следующим образом.
Для простых веществ:
где МЭ(ЭХ) – молярная масса эквивалента простого вещества, состоящего из х атомов элемента Э; М(ЭХ) – молярная масса этого вещества; М(Э) – молярная масса элемента; В(Э) – валентность элемента.
Для элементов (Э), входящих в состав сложного вещества:
То есть, молярные массы эквивалентов простых веществ и молярные массы эквивалентов элементов, входящих в состав сложного вещества, могут рассчитываться по одной и той же формуле.
Для кислот НХА, где А – кислотный остаток:
где y – основность кислоты, т. е. количество ионов H+, принимающих участие в процессе (y ≤ х).
Например, в реакции (2.1) основность серной кислоты равна двум. А для процесса:
Н2SO4 + NaOH = NaНSO4 + Н2О,
основность кислоты равна единице и не совпадает с общим количеством ионов Н+, принимающих участие в процессе.
Для оснований (Э(ОН)Х):
где у’ – кислотность основания, т. е. количество гидроксогрупп, принимающих участие в процессе. (y’ ≤ х).
Например, для реакции:
Са(ОН)2 + 2НСl = СаСl2 + 2Н2О;
Са(ОН)2 + НСl = СаОНСl + Н2О;
Для солей (МеХАу, где Ме – металл):
где В(Ме) – валентность металла; z – количество атомов металла, принимающих участие в процессе (z ≤ х).
где Э – элемент или фрагмент молекулы, неизменяемый в реакции; z′ – количество Э, принимающее участие в процессе.
Например, для реакции:
Аl2O3 + 6HCl = 2АlCl3 + 3H2O;
Э ≡ Al;
UO3 + 2HCl = UO2Cl2 + H2O;
Э ≡ UO2;
Из приведённых примеров видно, что значение молярной массы эквивалента сложных веществ зависит от конкретной реакции, в которой они принимают участие. А значение молярной массы эквивалента элементов, входящих в состав сложного вещества – не зависит от реакции.
Следует подчеркнуть, что рассмотренные выше формулы для нахождения молярных масс эквивалентов сложных веществ, справедливы только в том случае если эти вещества не участвуют в окислительно – восстановительном процессе. Например, в реакции
2КMnO4 + 3 K2SO3 + H2O = 2MnO2 + 3 K2SO4 + 2KOH;
где n – количество электронов, получаемых перманганатом калия
n′ – количество электронов, отдаваемых сульфитом калия. В данном случае
Обобщив, приведённые выше равенства, можно утверждать, что молярную массу эквивалента любого вещества (МЭ) рассчитывают по формуле (2.2):
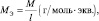
где M – молярная масса вещества, измеряемая в г/моль; l – количество эквивалентов, приходящееся на одну молекулу, численно равное количеству:
– валентностей (для простых веществ);
– функциональных связей (для сложных веществ, не участвующих в окислительно-восстановительном процессе);
– электронов, получаемых или отдаваемых молекулой (для сложных веществ, участвующих в окислительно-восстановительном процессе).
Подобно тому, как молярная масса вещества (М) представляет собой отношение массы (m) к количеству этого вещества (n)
а молярный объём газа (Vo) – отношение объёма (V), занимаемого им при нормальных условиях (p ≈ 105 Па; t °C ≈ 0 °C)[19] к количеству газа (nг):
молярный объём эквивалента газообразного вещества (VЭ) представляет собой отношение V к количеству молярных масс эквивалента nЭ:
из последних двух равенств вытекает соотношение
в котором все величины являются параметрами одного и того же газа.
Задачи для самостоятельного решения
1. Определить молярные массы эквивалентов соединения Н3РО4 в реакциях:
Н3РО4 + 3КОН = К3РО4 + 3Н2О;
Н3РО4 + 2КОН = К2НРО4 + 2Н2О;
Н3РО4 + КОН = КН2РО4 + Н2О.
Рассчитать молярные массы эквивалентов каждого из атомов в Н3РО4.
2. Определить эквивалентную массу Na2SO4 в реакциях:
Na2SO4 + ВаСl2 = ВаSO4 + 2NaСl;
Na2SO4 + H2SO4 = 2NaHSO4.
3. Определить молярную массу эквивалента Na2O в реакциях:
Na2O + 2НСl = 2NaСl + Н2О;
4. Определить эквивалентную массу Аl(OH)3 в реакциях:
2Аl(OH)3 + 3H2SO4 = Аl2(SO4)3 + 6Н2О;
Аl(OH)3 + H2SO4 = АlOHSO4 + 2Н2О.
5. Рассчитать молярную массу эквивалента кислорода и определить объём, занимаемый молярной массой эквивалента кислорода при н.у.
6. Определить эквивалентные массы, молярные массы эквивалента метана (СН4) и хлора в реакции
1. Дайте определения эквиваленту молекулы сложного вещества и эквиваленту молекулы простого вещества?
2. По какой формуле можно рассчитать молярную массу эквивалента любого вещества?
3. Какое уравнение связывает молярную массу, молярный объём, молярную массу эквивалента и молярный объём эквивалента одного и того же газа.