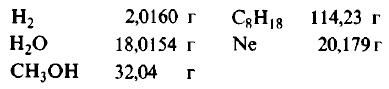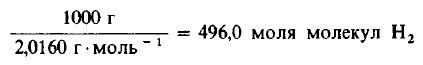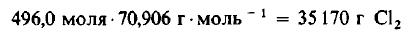В чем выражается моль
Моль (единица)
Моль (обозначение — моль, mol) — единица измерения количества вещества. Соответствует количеству вещества, содержащему столько специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц), сколько содержится атомов в 12 граммах нуклида углерода 12 C.
Количество частиц в одном моле любого вещества постоянно и носит название числа Авогадро (NA).
Кратные и дольные единицы
Десятичные кратные и дольные единицы образуют с помощью стандартных приставок СИ.
| Кратные | Дольные | ||||||
|---|---|---|---|---|---|---|---|
| величина | название | обозначение | величина | название | обозначение | ||
| 10 1 моль | декамоль | дамоль | damol | 10 −1 моль | децимоль | дмоль | dmol |
| 10 2 моль | гектомоль | гмоль | hmol | 10 −2 моль | сантимоль | смоль | cmol |
| 10 3 моль | киломоль | кмоль | kmol | 10 −3 моль | миллимоль | ммоль | mmol |
| 10 6 моль | мегамоль | Ммоль | Mmol | 10 −6 моль | микромоль | мкмоль | µmol |
| 10 9 моль | гигамоль | Гмоль | Gmol | 10 −9 моль | наномоль | нмоль | nmol |
| 10 12 моль | терамоль | Тмоль | Tmol | 10 −12 моль | пикомоль | пмоль | pmol |
| 10 15 моль | петамоль | Пмоль | Pmol | 10 −15 моль | фемтомоль | фмоль | fmol |
| 10 18 моль | эксамоль | Эмоль | Emol | 10 −18 моль | аттомоль | амоль | amol |
| 10 21 моль | зеттамоль | Змоль | Zmol | 10 −21 моль | зептомоль | змоль | zmol |
| 10 24 моль | йоттамоль | Имоль | Ymol | 10 −24 моль | йоктомоль | имоль | ymol |
| применять не рекомендуется | |||||||
Примечание: единица измерения йоктомоль может использоваться лишь формально, так как столь малые количества вещества должны измеряться отдельными частицами (1 имоль формально равен 0,602 частицы).
| Единицы СИ |
|---|
| Основные: метр | килограмм | секунда | ампер | кельвин | кандела | моль |
| Производные: радиан | стерадиан | герц | градус Цельсия | катал | ньютон | джоуль | ватт | паскаль | кулон | вольт | ом | сименс | фарад | вебер | тесла | генри | люмен | люкс | беккерель | грэй | зиверт |
Полезное
Смотреть что такое «Моль (единица)» в других словарях:
Моль (единица кол-ва вещ-ва) — Моль, единица количества вещества, т. е. величины, оцениваемой количеством содержащихся в физической системе тождественных структурных элементов (атомов, молекул, ионов и других частиц или их специфических групп). М. равен количеству вещества… … Большая советская энциклопедия
Моль (единица кол-ва вещ-ва) — Эта статья посвящена единице измерения. См. также: насекомые моли. Моль (обозначение моль, mol) единица измерения количества вещества. Соответствует количеству вещества, содержащему столько специфицированных структурных единиц (атомов, молекул,… … Википедия
моль — 1. МОЛЬ, и; ж. Небольшая бабочка, гусеница которой является вредителем шерстяных вещей, хлебных зёрен и растений. 2. МОЛЬ, и; ж.; МОЛЬ, я; м. Спец. Лес, сплавляемый по реке брёвнами, не связанными в плот. По реке плыла м. Пробираться на лодке… … Энциклопедический словарь
Моль (значения) — Моль многозначное слово: Моль единица измерения количества вещества, Моль представитель молей (под названием «моли» объединяют в нетаксономическую группу мелких насекомых из отряда чешуекрылых). Населённые пункты Моль … … Википедия
МОЛЬ — единица количества вещества в СИ, определяемая как количество вещества, содержащее столько же формульных (структурных) единиц этого вещества (атомов, молекул, ионов, электронов и др.), сколько содержится атомов в 12 г изотопа углерода 12 (12С);… … Большая политехническая энциклопедия
МОЛЬ — • МОЛЬ (Mohl) Хуго фон (1805 1872), немецкий ботаник, пионер в исследовании анатомии и физиологии КЛЕТОК растений. Сформулировал гипотезу о том, что ядро клетки окружено гранулированным коллоидным веществом, которое в 1846 г. он назвал… … Научно-технический энциклопедический словарь
МОЛЬ — МОЛЬ, единица количества вещества в СИ. Обозначение моль. В 1 моле содержится столько молекул (атомов, ионов или каких либо других структурных элементов вещества), сколько атомов содержится в 0,012 кг 12С (углерода с атомной массой 12). число… … Современная энциклопедия
МОЛЬ — единица количества вещества СИ, обозначается моль. В 1 моле содержится столько молекул (атомов, ионов или каких либо др. структурных элементов вещества), сколько атомов содержится в 0,012 кг 12С (углерода с атомной массой 12), т. е. 6,022.1023… … Большой Энциклопедический словарь
Моль — МОЛЬ, единица количества вещества в СИ. Обозначение моль. В 1 моле содержится столько молекул (атомов, ионов или каких либо других структурных элементов вещества), сколько атомов содержится в 0,012 кг 12С (углерода с атомной массой 12). Число… … Иллюстрированный энциклопедический словарь
Моль — Эта статья посвящена единице измерения. У слова «Моль» есть и другие значения: см. Моль (значения). Моль (русское обозначение: моль; международное: mol) единица измерения количества вещества в Международной системе единиц (СИ), одна из семи … Википедия
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
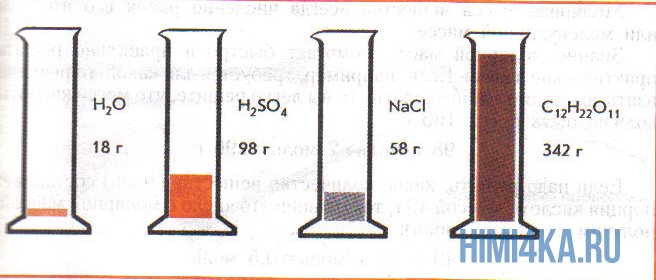
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
зМБЧБ 1. пУОПЧОЩЕ ЪБЛПОЩ ИЙНЙЙ

1.1 уФЕИЙПНЕФТЙЮЕУЛЙЕ ЪБЛПОЩ
оБЙВПМЕЕ ЧБЦОПЕ РТБЛФЙЮЕУЛПЕ ЪОБЮЕОЙЕ ЙНЕАФ УМЕДХАЭЙЕ ЪБЛПОЩ ИЙНЙЙ: УФЕИЙПНЕФТЙЮЕУЛЙЕ Й ЗБЪПЧЩЕ.
лБЦДЩК ИЙНЙЮЕУЛЙК ЬМЕНЕОФ ПФМЙЮБЕФУС ПФ ДТХЗЙИ ОЕ ФПМШЛП ИЙНЙЮЕУЛЙН УЙНЧПМПН (ЛБЮЕУФЧЕООБС ИБТБЛФЕТЙУФЙЛБ), ОП ОЕЛПФПТЩНЙ ЛПМЙЮЕУФЧЕООЩНЙ РБТБНЕФТБНЙ. л ОЙН ПФОПУСФУС, РТЕЦДЕ ЧУЕЗП, БФПНОБС НБУУБ ЬМЕНЕОФБ Й ЪБТСД ЕЗП СДТБ (ЙМЙ РПТСДЛПЧЩК ОПНЕТ ЬМЕНЕОФБ). ьФЙ ИБТБЛФЕТЙУФЙЛЙ ДМС ЛБЦДПЗП БФПНБ ЬМЕНЕОФБ РТЙЧЕДЕОБ Ч рЕТЙПДЙЮЕУЛПК УЙУФЕНЕ ЬМЕНЕОФПЧ д. й. нЕОДЕМЕЕЧБ. пДОБЛП УМЕДХЕФ ПФНЕФЙФШ, ЮФП РТЙЧЕДЕООЩЕ НБУУЩ БФПНПЧ СЧМСАФУС ПФОПУЙФЕМШОЩНЙ ЧЕМЙЮЙОБНЙ (ФБЛ ОБЪЩЧБЕНЩНЙ, БФПНОЩНЙ ЕДЙОЙГБНЙ НБУУЩ ЙМЙ Б.Е.Н.). нПМЕЛХМСТОБС НБУУБИЙНЙЮЕУЛПЗП УПЕДЙОЕОЙС ФБЛЦЕ МЕЗЛП ПРТЕДЕМЙНБ, ФБЛ ЛБЛ ПОБ ТБЧОБ УХННЕ БФПНОЩИ НБУУ УПУФБЧМСАЭЙИ ДБООХА НПМЕЛХМХ БФПНПЧ.
фБЛЙН ПВТБЪПН, МАВПЕ ИЙНЙЮЕУЛПЕ УПЕДЙОЕОЙЕ ИБТБЛФЕТЙЪХЕФУС НБУУПК ПДОПЗП НПМС ЙМЙ НПМШОПК (НПМСТОПК) НБУУПК н, ЧЩТБЦБЕНПК Ч З/НПМШ. ъОБЮЙФ, н(H2O) = 18 З/НПМШ, Б н(H2SO4) = 98 З/НПМШ.
уЧСЪШ НЕЦДХ ЛПМЙЮЕУФЧПН n (Ч НПМСИ) Й НБУУПК m (Ч ЗТБННБИ) ЧЕЭЕУФЧБ ЧЩТБЦБЕФУС ЖПТНХМПК:
чПЪОЙЛБЕФ ЪБЛПОПНЕТОЩК ЧПРТПУ П ОЕПВИПДЙНПУФЙ ЧЧЕДЕОЙС ФЕТНЙОБ «НПМШОБС НБУУБ ЧЕЭЕУФЧБ» Й ЕЗП РТЙНЕОЕОЙС, ЧЕДШ ДМС ЙЪНЕТЕОЙС НБУУЩ ЧЕЭЕУФЧБ ХЦЕ ЙНЕАФУС ЧЕМЙЮЙОЩ, ЧИПДСЭЙЕ Ч УЙУФЕНХ уй: ЛЙМПЗТБНН, ЗТБНН, ФПООБ Й Ф.Д. чПРТПУ ПФРБДБЕФ, ЕУМЙ ТБУУНПФТЕФШ РТЙНЕОЕОЙЕ ДБООЩИ ЧЕМЙЮЙО РТЙ БОБМЙЪЕ ИЙНЙЮЕУЛЙИ ХТБЧОЕОЙК.
ч ПВЭЕН УМХЮБЕ ХТБЧОЕОЙЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ ЪБРЙУЩЧБАФ Ч ЧЙДЕ

ч ЛБЮЕУФЧЕ РТЙНЕТБ ТБУУНПФТЙН РТПУФПЕ ИЙНЙЮЕУЛПЕ ЧЪБЙНПДЕКУФЧЙЕ:
дБООБС ЪБРЙУШ РПЛБЪЩЧБЕФ, ЮФП РТЙ ЧЪБЙНПДЕКУФЧЙЙ ДЧХИ НПМЕЛХМ ЗБЪППВТБЪОПЗП ЧПДПТПДБ о 2 Й ПДОПК НПМЕЛХМЩ ЗБЪППВТБЪОПЗП ЛЙУМПТПДБ п2 ПВТБЪХЕФУС ДЧЕ НПМЕЛХМЩ ЧПДЩ.
йЪ ДБООПЗП РТЙНЕТБ ЧЙДОП, ЮФП ЛПМЙЮЕУФЧП НПМШ ТЕБЗЙТХАЭЙИ Й ПВТБЪХАЭЙИУС Ч ТЕЪХМШФБФЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ ЧЕЭЕУФЧ РТСНПРТПРПТГЙПОБМШОП ЛПЬЖЖЙГЙЕОФБН Ч ХТБЧОЕОЙЙ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ.
ьФП РПЪЧПМСЕФ РТПЧПДЙФШ ЛПМЙЮЕУФЧЕООЩЕ ТБУЮЕФЩ, ЙУРПМШЪХС ХТБЧОЕОЙС ЪБДБООЩИ ИЙНЙЮЕУЛЙИ ТЕБЛГЙК.
рТЙНЕТ: ПРТЕДЕМЙФШ НБУУХПВТБЪХАЭЕКУС ЧПДЩ РТЙ УЦЙЗБОЙЙ 16 ЗТБННПЧ ЧПДПТПДБ Ч ЙЪВЩФЛЕ ЛЙУМПТПДБ.
йУРПМШЪХЕН ХЦЕ ЪОБЛПНПЕ ОБН ХТБЧОЕОЙЕ ТЕБЛГЙЙ Й ТБУУФБЧЙН Ч ОЕН ФТЕВХЕНЩЕ ЧЕМЙЮЙОЩ.
РТЙ УЗПТБОЙЙ 4 ЗТБННПЧ о2 ПВТБЪПЧБМПУШ 36 ЗТБННПЧ о2п
РТЙ УЗПТБОЙЙ 16 ЗТБННПЧ о2 ПВТБЪПЧБМПУШ и ЗТБННПЧ о2п
1.1.2 ьЛЧЙЧБМЕОФОБС НБУУБ (НПМСТОБС НБУУБ ЬЛЧЙЧБМЕОФБ ЧЕЭЕУФЧБ)
mЬЛЧ(ПЛУЙДБ) = нПЛУЙДБ/(ЮЙУМП БФПНПЧ ЛЙУМПТПДБ·2);
mЬЛЧ(ПУОПЧБОЙС) = нПУОПЧБОЙС/ЛЙУМПФОПУФШ ПУОПЧБОЙС;
mЬЛЧ(ЛЙУМПФЩ) = нЛЙУМПФЩ/ПУОПЧОПУФШ ЛЙУМПФЩ;
mЬЛЧ(УПМЙ) = нУПМЙ/(ЮЙУМП БФПНПЧ НЕФБММБ·ЧБМЕОФОПУФШ НЕФБММБ).
нПЦОП ПФНЕФЙФШ, ЮФП Ч ВПМШЫЙОУФЧЕ УМХЮБЕЧ ЛЙУМПФОПУФШ ПУОПЧБОЙС ТБЧОБ ЮЙУМХ ЗЙДТПЛУЙМШОЩИ ЗТХРР Ч ЖПТНХМЕ ПУОПЧБОЙС, Б ПУОПЧОПУФШ ЛЙУМПФЩ ТБЧОБ ЮЙУМХ БФПНПЧ ЧПДПТПДБ Ч ЖПТНХМЕ ЛЙУМПФЩ.
ьЛЧЙЧБМЕОФОЩЕ НБУУЩ ЧЕЭЕУФЧ ЙУРПМШЪХАФ ДМС ЛПМЙЮЕУФЧЕООЩИ ТБУЮЕФПЧ РТЙ ИЙНЙЮЕУЛЙИ ЧЪБЙНПДЕКУФЧЙСИ НЕЦДХ ЧЕЭЕУФЧБНЙ. пЗТПНОЩН РТЕЙНХЭЕУФЧПН РТЙ ЬФПН СЧМСЕФУС ФП, ЮФП ДМС ЬФПЗП ОЕ ОХЦОП ЙУРПМШЪПЧБФШ ХТБЧОЕОЙЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ (ЛПФПТПЕ ЧП НОПЗЙИ УМХЮБСИ ОБРЙУБФШ ЪБФТХДОЙФЕМШОП), ОХЦОП ФПМШЛП ЪОБФШ, ЮФП ДБООЩЕ ИЙНЙЮЕУЛЙЕ ЧЕЭЕУФЧБ ЧЪБЙНПДЕКУФЧХАФ НЕЦДХ УПВПК ЙМЙ ЧЕЭЕУФЧП СЧМСЕФУС РТПДХЛФПН ИЙНЙЮЕУЛПК ТЕБЛГЙЙ.
дМС ЛПМЙЮЕУФЧЕООЩИ ТБУЮЕФПЧ ЙУРПМШЪХЕФУС ЪБЛПО ЬЛЧЙЧБМЕОФПЧ: НБУУЩ ТЕБЗЙТХАЭЙИ Й ПВТБЪХАЭЙИУС ЧЕЭЕУФЧ ПФОПУСФУС ДТХЗ Л ДТХЗХ, ЛБЛ ЙИ ЬЛЧЙЧБМЕОФОЩЕ НБУУЩ.
нБФЕНБФЙЮЕУЛПЕ ЧЩТБЦЕОЙЕ ЪБЛПОБ ЬЛЧЙЧБМЕОФПЧ ЙНЕЕФ УМЕДХАЭЙК ЧЙД:
| m1/m2 = mЬЛЧ(1)/mЬЛЧ(2) | (1.2) |
рТЙНЕТ: ПРТЕДЕМЙФШ НБУУХ УПДЩ (ЛБТВПОБФБ ОБФТЙС) Na2CO3, ОЕПВИПДЙНХА ДМС РПМОПК ОЕКФТБМЙЪБГЙЙ 1,96 ЛЗ УЕТОПК ЛЙУМПФЩ H2SO4.
чПУРПМШЪХЕНУС ЪБЛПОПН ЬЛЧЙЧБМЕОФПЧ
пРТЕДЕМСЕН ЬЛЧЙЧБМЕОФОЩЕ НБУУЩ ЧЕЭЕУФЧ, ЙУИПДС ЙЪ ЙИ ИЙНЙЮЕУЛЙИ ЖПТНХМ:
Что такое моль
В химии часто приходится считать большие количества атомов и молекул. Для быстрого и эффективного подсчета принято пользоваться методом взвешивания. Но при этом надо знать, вес отдельных атомов и молекул. Для того, чтобы узнать молекулярную массу надо сложить массу всех атомов, входящих в соединение.
Например, для сульфата аммония молекулярная масса будет равна:
Вернемся опять к повседневной жизни, в которой мы привыкли пользоваться такими понятиями, как пара, десяток, дюжина, сотня. Все это своеобразные единицы измерения определенных объектов: пара ботинок, десяток яиц, сотня скрепок. Подобной единицей измерения в химии является МОЛЬ.
Все вышесказанное о моле относится к микромиру. Теперь надо увязать понятие моля с повседневным макромиром.
Весь нюанс состоит в том, что в 12 граммах изотопа углерода 12 C содержится 6,022·10 23 атомов углерода, или ровно 1 моль. Таким образом, для любого другого элемента моль выражается количеством граммов, равным атомной массе элемента. Для химических соединений моль выражается количеством граммов, равным молекулярной массе соединения.
Из приведенного примера понятна связь микромира и макромира через моль:
Число Авогадро ↔ МОЛЬ ↔ кол-во граммов, равных атомной (формульной) массе
Приведем несколько практических примеров использования моля:
Задача №1: Сколько молекул воды содержится в 16,5 молях H2O?
Решение: 16,5·6,022·10 23 = 9,93·10 24 молекул.
Задача №2: Сколько молей содержится в 100 граммах H2O?
Решение: (100 г/1)·(1 моль/18,015 г) = 5,56 моль.
Задача №3: Сколько молекул содержит 5 г диоксида углерода?
Молярная масса
Поскольку в 1 моле любого вещества содержится постоянное кол-во частиц, масса которых может быть различной, то и масса 1 моля различных веществ будет также различной. Для отражения этих отличий химики ввели понятие молярной массы.
Молярная масса (М, г/моль) или масса 1 моля вещества совпадает с относительными атомными и молекулярными массами (см. Масса атомов и молекул):
Молярная масса вещества (M) связана с его массой (m) и количеством (n) следующими соотношениями:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
В чем выражается моль
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12 С:
Таким образом, 1 моль вещества содержит 6,02 • 10 23 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 10 23 молекул. Следовательно, количество вещества в этом образце составляет:
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 10 23 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример 
Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
Вычисление ν используется практически в каждой расчетной задаче.
Образцы решения задач
Задача №1. Вычислите массу (г) магния, взятого количеством вещества 0, 5 моль?
M (Mg ) = Ar ( Mg ) = 24 г/моль (из периодической системы)
m ( Mg ) = 24 г/моль · 0,5 моль = 12 г
Задача №2. Вычислите массу (г) 12,04 · 10 23 молекул оксида цинка Zn О ?
n (Zn O )= 12,04 * 10 23 молекул
следовательно, формула для расчёта
M(ZnO) = Ar(Zn) + Ar(O) = 65 + 16 = 81 г / моль
m = 81 г/моль · (12,04 * 10 23 /6.02 · 10 23 1/моль) = 162 г
Задания для закрепления
Заполните таблицу (округляя числа до целых )