В чем выражают активность ферментов
Ферменты
Жизнь любого организма возможна благодаря протекающим в нем процессам обмена веществ. Этими реакциями управляют природные катализаторы, или ферменты. Другое название этих веществ – энзимы. Термин «ферменты» происходит от латинского fermentum, что означает «закваска». Понятие появилось исторически при изучении процессов брожения.

Рис. 1 — Брожение с использованием дрожжей – типичный пример ферментативной реакции
Человечество давно пользуется полезными свойствами этих ферментов. Например, уже много веков из молока с помощью сычужного фермента делают сыр.
Ферменты отличаются от катализаторов тем, что действуют в живом организме, тогда как катализаторы – в неживой природе. Отрасль биохимии, которая изучает эти важнейшие для жизни вещества, называется энзимологией.
Общие свойства ферментов
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию. Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры.
Основные свойства ферментов:
Роль ферментов в организме человека невозможно переоценить. В то время, когда еще только открыли структуру ДНК, говорили, что один ген отвечает за синтез одного белка, который уже определяет какой-то определенный признак. Сейчас это утверждение звучит так: «Один ген – один фермент – один признак». То есть без активности ферментов в клетке жизнь не может существовать.
Классификация
В зависимости от роли в химических реакциях, различаются такие классы ферментов:
Классы
Особенности
Катализируют окисление своих субстратов, перенося электроны или атомы водорода
Участвуют в переносе химических групп из одного вещества в другое
Расщепляют крупные молекулы на более мелкие, добавляя к ним молекулы воды
Катализируют расщепление молекулярных связей без процесса гидролиза
Активируют перестановку атомов в молекуле
Образуют связи с атомами углерода, используя энергию АТФ.
В живом организме все ферменты делятся на внутри- и внеклеточные. К внутриклеточным относятся, например, ферменты печени, участвующие в реакциях обезвреживания различных веществ, поступающих с кровью. Они обнаруживаются в крови при повреждении органа, что помогает в диагностике его заболеваний.
Внутриклеточные ферменты, которые являются маркерами повреждения внутренних органов:
Внеклеточные ферменты выделяются железами во внешнюю среду. Основные из них секретируются клетками слюнных желез, желудочной стенки, поджелудочной железы, кишечника и активно участвуют в пищеварении.
Пищеварительные ферменты
Пищеварительные ферменты – это белки, которые ускоряют расщепление крупных молекул, входящих в состав пищи. Они разделяют такие молекулы на более мелкие фрагменты, которые легче усваиваются клетками. Основные типы пищеварительных ферментов – протеазы, липазы, амилазы.
Основная пищеварительная железа – поджелудочная. Она вырабатывает большинство этих ферментов, а также нуклеаз, расщепляющих ДНК и РНК, и пептидаз, участвующих в образовании свободных аминокислот. Причем незначительное количество образующихся ферментов способно «обработать» большой объем пищи.
При ферментативном расщеплении питательных веществ выделяется энергия, которая расходуется для процессов обмена веществ и жизнедеятельности. Без участия ферментов, подобные процессы происходили бы слишком медленно, не обеспечивая организм достаточным энергетическим запасом.
Кроме того, участие ферментов в процессе пищеварения обеспечивает распад питательных веществ до молекул, способных проходить через клетки кишечной стенки и поступать в кровь.
Амилаза
Амилаза вырабатывается слюнными железами. Она действует на крахмал пищи, состоящий из длинной цепи молекул глюкозы. В результате действия этого фермента образуются участки, состоящие из двух соединенных молекул глюкозы, то есть фруктоза, и другие короткоцепочечные углеводы. В дальнейшем они метаболизируются до глюкозы в кишечнике и оттуда всасываются в кровь.
Слюнные железы расщепляют только часть крахмала. Амилаза слюны активна в течение короткого времени, пока пища прожевывается. После попадания в желудок фермент инактивируется его кислым содержимым. Большая часть крахмала расщепляется уже в 12-перстной кишке под действием панкреатической амилазы, вырабатываемой поджелудочной железой.
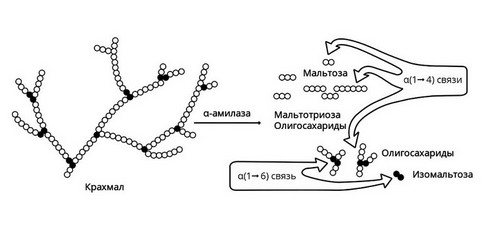
Рис. 2 — Амилаза начинает расщепление крахмала
Короткие углеводы, образовавшиеся под действием панкреатической амилазы, попадают в тонкий кишечник. Здесь с помощью мальтазы, лактазы, сахаразы, декстриназы они расщепляются до молекул глюкозы. Нерасщепляющаяся ферментами клетчатка выводится из кишечника с каловыми массами.
Протеазы
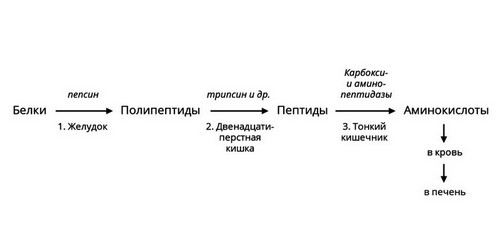
Рис. 3 — Ферментативное расщепление белков
Протеазы расщепляют пищевые белки на более мелкие фрагменты – полипептиды. Ферменты – пептидазы разрушают их до аминокислот, которые усваиваются в кишечнике.
Липазы
Пищевые жиры разрушаются ферментами-липазами, которые также вырабатываются поджелудочной железой. Они расщепляют молекулы жира на жирные кислоты и глицерин. Такая реакция требует наличия в просвете 12-перстной кишки желчи, образующейся в печени.
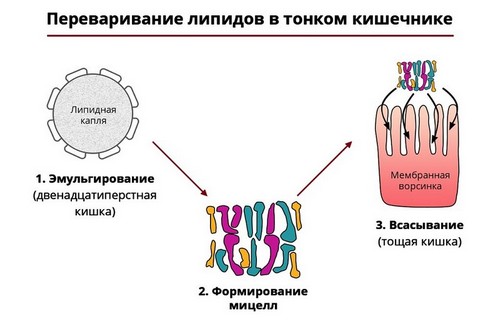
Рис. 4 — Ферментативный гидролиз жиров
Роль заместительной терапии препаратом «Микразим»
Для многих людей с нарушением пищеварения, прежде всего с заболеваниями поджелудочной железы, назначение ферментов обеспечивает функциональную поддержку органа и ускоряет процессы выздоровления. После купирования приступа панкреатита или другой острой ситуации прием ферментов можно прекратить, так как организм самостоятельно восстанавливает их секрецию.
Длительный прием ферментативных препаратов необходим лишь при тяжелой внешнесекреторной недостаточности поджелудочной железы.
Одним из наиболее физиологичных по своему составу является препарат «Микразим». В его состав входят амилаза, протеазы и липаза, содержащиеся в панкреатическом соке. Поэтому нет необходимости отдельно подбирать, какой фермент нужно использовать при разнообразных болезнях этого органа.
Показания для использования этого лекарства:
Прием пищеварительных ферментов с заместительной целью помогает избежать вздутия живота, жидкого стула, болей в животе. Кроме того, при тяжелых хронических заболеваниях поджелудочной железы Микразим полностью принимает на себя функцию по расщеплению питательных веществ. Поэтому они могут беспрепятственно усваиваться в кишечнике. Это особенно важно для детей, страдающих муковисцидозом.
Важно: перед применением ознакомьтесь с инструкцией или проконсультируйтесь с лечащим врачом.
Ферменты и клиническая энзимология
| Сайт: | Образовательный портал МБФ (ВолгГМУ) |
| Курс: | Медицинская биохимия, принципы измерительных технологий в биохимии, патохимия, диагностика, биохимия злокачественного роста. Часть 2. |
| Книга: | Ферменты и клиническая энзимология |
Оглавление
1. Предисловие
Ферме́нты (от лат. fermentum — «закваска»), или энзи́мы[1] (от греч. ζύμη, ἔνζυμον «закваска»), — обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу
2. Номенклатура
3. Классификация
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие перенос электронов, то есть окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа.
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза.
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов, а также обратные реакции.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата с образованием изомерных форм.
КФ 6: Лигазы, катализирующие образование химических связей C—C, C—S, C—O и C—N между субстратами за счёт реакций конденсации, сопряжённых с гидролизом АТФ. Пример: лигаза
КФ 7: Транслоказы, катализирующие перенос ионов или молекул через мембраны или их разделение в мембранах.
Второе число в наименовании фермента отражает подкласс, третье — подподкласс, а четвёртая — порядковый номер фермента в его подподклассе.
Будучи катализаторами, все ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
4. Клиническая классификация
Клеточные ферменты в зависимости от локализации в тканях делят на две группы:
1) неспецифические ферменты, которые катализируют общие для всех тканей реакции обмена и находятся в большинстве органов и тканей;
2)органоспецифические, или индикаторные, ферменты, специфичные только для определенного типа тканей.
В сыворотке крови активность клеточных ферментов низка или вообще отсутствует. При патологических процессах активность ферментов этой группы в сыворотке крови зави¬сит от скорости высвобождения из клеток, которая в свою очередь определяется скоростью повреждения клеток, и от степени повреждения клетки.
Секреторные ферменты (церулоплазмин, псевдохолинэстераза, липопротеиновая липаза) поступают непосредственно в плазму крови и выполняют в ней специфические функции. Эти ферменты синтезируются в печени и постоянно высвобождаются в плазму. Их активность в сыворотке крови выше, чем в клетках или тканях. В клинической практике они представляют интерес, когда их активность в сыворотке крови становится ниже нормы за счет нарушения функции печени.
Экскреторные ферменты образуются органами пищеварительной системы (поджелудочной железой, слизистой оболочкой кишечника, печенью, эндотелием желчных путей). К ним относятся альфа-амилаза, липаза, щелочная фосфатаза и др. В норме их активность в сыворотке крови низка и постоянна. Однако при патологии, когда блокирован любой из обычных путей экскреции, активность этих ферментов в сыворотке крови значительно увеличивается.
5. Изоферменты
Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.
Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности и/или подобны по пространственной конфигурации. Особенно консервативны в сохранении строения активные центры молекул изоферментов. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам.
6. Ферментативная активность
Для количественной оценки активности ферментов Комиссия по ферментам Междуна¬родного биохимического союза рекомендовала стандартную международную единицу (ME). За единицу активности любого фермента принимают то его количество, которое в оптималь¬ных условиях катализирует превращение 1 мкмоль субстрата в 1 минуту (мкмоль/мин).
Об активности фермента судят по скорости катализируемой реакции при определенных температуре, рН среды, концентрации субстрата, поэтому при определении активности фер¬ментов необходимо строго соблюдать одни и те же условия.
Ферментативная реакция чувствительна к изменениям температуры. Обычно фермента¬тивную реакцию принято проводить при температуре, лежащей в пределах 25—40 °С, однако при разной температуре оптимальные значения рН, концентрации буфера, субстрата и дру¬гих параметров различны. Максимальная активность большинства ферментов в организме человека наблюдается при температуре около 37 °С. Поэтому в целях международной стан¬дартизации температуры измерения активности ферментов используется 37 °С [Marks D.B. et al., 1996]. Нормальные величины активности ферментов приведены ниже для 37 «С.
За международную единицу активности принимается количество фермента, способного превратить один микромоль (мкмоль) субстрата за 1 мин. в стандартных условиях. Международные единицы количества фермента отражаются символом Е (U). 1 Е (U) = 1 мкмоль/мин = 16,67 нмоль/с.
Удельная активность фермента равняется его массе (в миллиграммах), которая способна превратить 1 мкмоль субстрату за 1 мин в стандартных условиях, и выражается у мкмоль/(мин • мг) белка.
В пересчете на 1 л биологического материала активность фермента выражают в Е/л, (U/L), кат/л = моль/(с • л).
Например, если активность щелочной фосфатазы 1,9 мккат/л, то в международных единицах она будет равняться 1,9 мккат/л*60 = 114 Е/л (U/L).
Если активность фермента выражена в Е/л (мкмоль/мин • л)), а ее нужно выразить в моль/час • л), нужно значение Е/л умножить на коэффициент 0,06.
7. Внутриклеточная локализация ферментов
В ядре содержатся ферменты, которые принимают участие в процессе репликации ДНК, синтезе никотинамидадениндинуклеотида (НАД).
С митохондриями связанные ферменты пируватдегидрогеназного комплекса, цикла трикарбоновых кислот, окисляют жирные кислоты и некоторые аминокислоты, синтеза мочевины, а также ферменты переноса электронов и окислительного фосфорилирования.
В лизосомах содержатся преимущественно гидролитические ферменты с оптимумом рН в зоне 5. Именно через гидролитический характер действия ферментов эти органеллы назвали лизосомами.
В рибосомах локализуются ферменты белкового синтеза. В этих структурах происходит связывание аминокислот в полипептидные цепи с образованием молекул белка.
В эндоплазматическом ретикуллиуме локализованы ферменты синтеза липидов, а также ферменты, которые принимают участие в реакциях гидроксилирования.
С плазматической мембраной в первую очередь связанные АТФ-аза, что обеспечивает транспортировку ионов Na+ и К+, аденилатциклаза и ряд других ферментов.
В гиалоплазме (недифференцированной части внутриклеточного содержания) локализованные ферменты гликолиза, пентозного цикла окисления углеводов, синтеза жирных кислот, синтеза мононуклеотидов, активации аминокислот, а также много ферментов глюконеогенеза.
8. ПРИНЦИПЫ ЭНЗИМОДИАГНОСТИКИ
3. Метаболические пути в разных тканях очень похожие, потому существует немного тканьспецифичных ферментов (например, кислая фосфатаза предстательной железы, орнитинкарбамоилтрансфераза и гистидаза печени);
4. Более специфическим для тканей является соотношение разных ферментов и изоферментов.
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
9. Причины, приводящие к увеличению количества ферментов в крови
Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности вьпюдиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.
Ферменты и клиническая энзимология
| Сайт: | Образовательный портал МБФ (ВолгГМУ) |
| Курс: | Медицинская биохимия, принципы измерительных технологий в биохимии, патохимия, диагностика, биохимия злокачественного роста. Часть 2. |
| Книга: | Ферменты и клиническая энзимология |
Оглавление
1. Предисловие
Ферме́нты (от лат. fermentum — «закваска»), или энзи́мы[1] (от греч. ζύμη, ἔνζυμον «закваска»), — обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу
2. Номенклатура
3. Классификация
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие перенос электронов, то есть окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа.
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза.
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов, а также обратные реакции.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата с образованием изомерных форм.
КФ 6: Лигазы, катализирующие образование химических связей C—C, C—S, C—O и C—N между субстратами за счёт реакций конденсации, сопряжённых с гидролизом АТФ. Пример: лигаза
КФ 7: Транслоказы, катализирующие перенос ионов или молекул через мембраны или их разделение в мембранах.
Второе число в наименовании фермента отражает подкласс, третье — подподкласс, а четвёртая — порядковый номер фермента в его подподклассе.
Будучи катализаторами, все ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
4. Клиническая классификация
Клеточные ферменты в зависимости от локализации в тканях делят на две группы:
1) неспецифические ферменты, которые катализируют общие для всех тканей реакции обмена и находятся в большинстве органов и тканей;
2)органоспецифические, или индикаторные, ферменты, специфичные только для определенного типа тканей.
В сыворотке крови активность клеточных ферментов низка или вообще отсутствует. При патологических процессах активность ферментов этой группы в сыворотке крови зави¬сит от скорости высвобождения из клеток, которая в свою очередь определяется скоростью повреждения клеток, и от степени повреждения клетки.
Секреторные ферменты (церулоплазмин, псевдохолинэстераза, липопротеиновая липаза) поступают непосредственно в плазму крови и выполняют в ней специфические функции. Эти ферменты синтезируются в печени и постоянно высвобождаются в плазму. Их активность в сыворотке крови выше, чем в клетках или тканях. В клинической практике они представляют интерес, когда их активность в сыворотке крови становится ниже нормы за счет нарушения функции печени.
Экскреторные ферменты образуются органами пищеварительной системы (поджелудочной железой, слизистой оболочкой кишечника, печенью, эндотелием желчных путей). К ним относятся альфа-амилаза, липаза, щелочная фосфатаза и др. В норме их активность в сыворотке крови низка и постоянна. Однако при патологии, когда блокирован любой из обычных путей экскреции, активность этих ферментов в сыворотке крови значительно увеличивается.
5. Изоферменты
Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.
Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности и/или подобны по пространственной конфигурации. Особенно консервативны в сохранении строения активные центры молекул изоферментов. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам.
6. Ферментативная активность
Для количественной оценки активности ферментов Комиссия по ферментам Междуна¬родного биохимического союза рекомендовала стандартную международную единицу (ME). За единицу активности любого фермента принимают то его количество, которое в оптималь¬ных условиях катализирует превращение 1 мкмоль субстрата в 1 минуту (мкмоль/мин).
Об активности фермента судят по скорости катализируемой реакции при определенных температуре, рН среды, концентрации субстрата, поэтому при определении активности фер¬ментов необходимо строго соблюдать одни и те же условия.
Ферментативная реакция чувствительна к изменениям температуры. Обычно фермента¬тивную реакцию принято проводить при температуре, лежащей в пределах 25—40 °С, однако при разной температуре оптимальные значения рН, концентрации буфера, субстрата и дру¬гих параметров различны. Максимальная активность большинства ферментов в организме человека наблюдается при температуре около 37 °С. Поэтому в целях международной стан¬дартизации температуры измерения активности ферментов используется 37 °С [Marks D.B. et al., 1996]. Нормальные величины активности ферментов приведены ниже для 37 «С.
За международную единицу активности принимается количество фермента, способного превратить один микромоль (мкмоль) субстрата за 1 мин. в стандартных условиях. Международные единицы количества фермента отражаются символом Е (U). 1 Е (U) = 1 мкмоль/мин = 16,67 нмоль/с.
Удельная активность фермента равняется его массе (в миллиграммах), которая способна превратить 1 мкмоль субстрату за 1 мин в стандартных условиях, и выражается у мкмоль/(мин • мг) белка.
В пересчете на 1 л биологического материала активность фермента выражают в Е/л, (U/L), кат/л = моль/(с • л).
Например, если активность щелочной фосфатазы 1,9 мккат/л, то в международных единицах она будет равняться 1,9 мккат/л*60 = 114 Е/л (U/L).
Если активность фермента выражена в Е/л (мкмоль/мин • л)), а ее нужно выразить в моль/час • л), нужно значение Е/л умножить на коэффициент 0,06.
7. Внутриклеточная локализация ферментов
В ядре содержатся ферменты, которые принимают участие в процессе репликации ДНК, синтезе никотинамидадениндинуклеотида (НАД).
С митохондриями связанные ферменты пируватдегидрогеназного комплекса, цикла трикарбоновых кислот, окисляют жирные кислоты и некоторые аминокислоты, синтеза мочевины, а также ферменты переноса электронов и окислительного фосфорилирования.
В лизосомах содержатся преимущественно гидролитические ферменты с оптимумом рН в зоне 5. Именно через гидролитический характер действия ферментов эти органеллы назвали лизосомами.
В рибосомах локализуются ферменты белкового синтеза. В этих структурах происходит связывание аминокислот в полипептидные цепи с образованием молекул белка.
В эндоплазматическом ретикуллиуме локализованы ферменты синтеза липидов, а также ферменты, которые принимают участие в реакциях гидроксилирования.
С плазматической мембраной в первую очередь связанные АТФ-аза, что обеспечивает транспортировку ионов Na+ и К+, аденилатциклаза и ряд других ферментов.
В гиалоплазме (недифференцированной части внутриклеточного содержания) локализованные ферменты гликолиза, пентозного цикла окисления углеводов, синтеза жирных кислот, синтеза мононуклеотидов, активации аминокислот, а также много ферментов глюконеогенеза.
8. ПРИНЦИПЫ ЭНЗИМОДИАГНОСТИКИ
3. Метаболические пути в разных тканях очень похожие, потому существует немного тканьспецифичных ферментов (например, кислая фосфатаза предстательной железы, орнитинкарбамоилтрансфераза и гистидаза печени);
4. Более специфическим для тканей является соотношение разных ферментов и изоферментов.
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
9. Причины, приводящие к увеличению количества ферментов в крови
Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности вьпюдиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.