Аэртал мазь или таблетки что лучше
Нестероидные противовоспалительные препараты: список и цены
Нестероидные противовоспалительные препараты используются достаточно широко для подавления воспалительных процессов в организме. НПВП доступны в различных формах выпуска: таблетки, капсулы, мази. Они обладают тремя основными свойствами: жаропонижающими, противовоспалительными и болеутоляющими.
Лучший нестероидный противовоспалительный препарат может подобрать только врач, отталкиваясь от индивидуальных особенностей пациента. Самолечение в данном случае может быть чревато развитие серьезных побочных реакций или же передозировки. Предлагаем ознакомиться со списком препаратов. Рейтинг разработан на основании соотношения цена-качество, отзывов пациентов и мнения специалистов.
Как работают НПВП?
Нестероиды ингибируют агрегацию тромбоцитов. Терапевтические свойства объясняются блокадой фермента циклооксигеназы (ЦОГ-2), а также снижением синтеза простагландина. По мнению специалистов они оказывают влияние на симптомы заболевания, но не устраняют причину его возникновения. Поэтому не следует забывать о средствах, с помощью которых должны быть устранены первичные механизмы развития патологии.
Если у пациента обнаружена непереносимость НПВП, тогда они заменяются лекарствами других категорий. Часто в таких случаях применяют комбинацию противовоспалительного и болеутоляющего средства.
Как показывает практика, нецелесообразно заменять одно лекарство другим той же группы, если при приеме обнаруживается недостаточный терапевтический эффект. Удвоение дозы может привести только к клинически незначительному увеличению воздействия.
Классификация НПВП
Нестероидные противовоспалительные средства классифицируются в зависимости от того, являются ли они селективными для ЦОГ-2 или нет. Таким образом, с одной стороны, есть неселективные НПВП, а с другой – селективные ЦОГ-2.
Инструкция
| Регистрационный номер: | ЛП-001289 |
| Торговое наименование препарата: | Аэртал® |
| Международное непатентованное наименование: | Ацеклофенак |
| Лекарственная форма: | Крем для наружного применения |
Состав на 1 г крема
Действующее вещество: ацеклофенак 100% микронизированный 0,015 г.
Вспомогательные вещества: воск эмульсионный, парафин жидкий, метилпарагидроксибензоат, пропилпарагидроксибензоат, вода.
Описание
Препараты для местного применения при суставной и мышечной боли; нестероидные противовоспалительные препараты для местного применения: ацеклофенак.
Механизм действия
Ацеклофенак представляет собой нестероидный противовоспалительный препарат, обладающий также жаропонижающим и анальгезирующим действием. Препарат подавляет развитие отека и эритемы независимо от этиологии воспаления. Ацеклофенак подавляет образование простагландинов и лейкотриенов за счет обратимого ингибирования циклооксигеназы.
Клиническая эффективность и безопасность
Установленная клиническая эффективность препарата дополняется хорошей переносимостью.
Применение крема Аэртал® целесообразно у пациентов с травматическими повреждениями или воспалительными заболеваниями опорно-двигательного аппарата. Было доказано, что крем Аэртал® обладает противовоспалительным и обезболивающим действием при местном применении при лечении травм опорно-двигательной системы.
Всасывание
После нанесения ацеклофенак всасывается из зоны нанесения, быстро достигая насыщения. Он накапливается в зоне всасывания, что способствует увеличению противовоспалительной активности, и постепенно поступает в системный кровоток в небольших концентрациях, поэтому риск побочного действия, в том числе на желудочно- кишечный тракт, минимизируется.
Распределение
Ацеклофенак распределяется по всему организму.
Выведение
Ацеклофенак метаболизируется в печени и выводится медленно почками и через кишечник, частично в неизмененном виде.
Показания к применению
Лечение местной боли вследствие травматических повреждений и воспалительных заболеваний опорно-двигательного аппарата, в том числе спортивных травм. Препарат может использоваться для уменьшения воспаления сухожилий, связок, мышц и суставов в случаях растяжения, перенапряжения или ушибов, а также для лечения люмбаго, кривошеи и периартрита.
Противопоказания
С осторожностью
Печеночная порфирия (обострение), эрозивно-язвенные поражения ЖКТ (в фазе обострения), тяжелые нарушения функции печени и почек, ХСН; бронхиальная астма, крапивница или острый ринит, спровоцированные приемом АСК или других НПВП; нарушения свертываемости крови (в т.ч. гемофилия, удлинение времени кровотечения, склонность к кровотечениям); пожилой возраст; период лактации.
Применение при беременности и в период грудного вскармливания
Беременность
Крем Аэртал® противопоказан при беременности. Информация о применении крема Аэртал® при беременности отсутствует.
Период грудного вскармливания.
Неизвестно, проникает ли ацеклофенак в грудное молоко. Крем Аэртал® не следует применять во время кормления грудью.
Способ применения и дозы
Способ применения
Крем Аэртал® предназначен только для наружного применения и не должен наноситься под окклюзионные повязки. После нанесения крема необходимо вымыть руки, за исключением тех случаев, когда руки являются местом нанесения препарата. Препарат не должен попадать в глаза или полость рта. Аэртал ® можно наносить только на неповрежденную кожу.
Применение у детей
Опыт применения крема Аэртал® у детей отсутствует, поэтому крем Аэртал® противопоказан к применению у детей.
Пожилые пациенты
Коррекция режима дозирования у лиц пожилого возраста не требуется.
Побочное действие
Аэртал® крем продемонстрировал хорошую переносимость. В ряде случаев описано легкое или умеренное местное раздражение, сопровождающееся гиперемией кожи и зудом, которые исчезают при прекращении лечения. В редких случаях вирус Варицелла-Зостер в сочетании с лечением НПВП может вызывать серьезные осложнения в форме инфекции кожи и мягких тканей. Кроме того, имеются отдельные сообщения о реакциях фоточувствительности (от >1/1000 до 1/10), часто (от >1/100 до 1/1000 до 1/10000 до
Ацеклофенак в терапии остеоартроза
Проведена оценка эффективности, переносимости, безопасности терапии ацеклофенаком по сравнению с диклофенаком больных гонартрозм. Показано, что оба препарата одинаково эффективны по влиянию на боль и функциональное состояние суставов, но лечение ацеклофен
Is carried out the estimation of effectiveness, transference, safety of aceclofenac therapy in comparison to diclofenac treatment of gonartrosis patients. It is shown that both preparations are equally effective on the influence on the pain and functional state of joints, but aceclofenac treatment is safer.
Остеоартроз (ОА) — заболевание, которое развивается в результате взаимодействия различных механических и биологических факторов, нарушающих существующее в норме равновесие между процессами деградации и синтеза всех компонентов матрикса и прежде всего суставного хряща [1]. В настоящее время ОА рассматривают как органное заболевание, поскольку в патологический процесс вовлекается не только хрящ, но и субхондральная кость, синовиальная оболочка, мениски, связки и периартикулярные мышцы.
Распространенность этого заболевания в популяции коррелирует с возрастом, достигая максимальных значений в возрасте старше 65 лет. Женщины болеют почти в 2 раза чаще мужчин. Развитие заболевания приводит к ухудшению качества жизни пациентов, ограничивает их физические возможности, а зачастую и социальные функции, является причиной инвалидности. По последним данным эпидемиологического исследования в России ОА с преимущественным поражением коленных и/или тазобедренных суставов страдает 13,0% населения [2].
Ведущим клиническим симптомом при ОА является боль, которая служит непосредственной причиной обращения больного к врачу. Ревматические заболевания (РЗ) отличаются по патогенезу и клинической картине, но имеют одно общее проявление — болевой синдром. С учетом патофизиологических механизмов предложено различать три основные группы болей: ноцицептивные, нейропатические и психогенные. Для ОА наиболее характерна ноцицептивная боль, которая возникает при раздражении периферических болевых рецепторов — «ноцицепторов», локализованных практически во всех органах и системах. Нейропатическая боль возникает вследствие повреждения различных отделов (периферической и центральной) соматосенсорной нервной системы и также может наблюдаться при ОА. Ноцицептивные болевые синдромы чаще всего являются острыми (ожог, порез, ушиб, ссадина, перелом, растяжение), однако при ОА они носят хронический характер. Ноцицепторами обильно снабжены ткани суставов: синовиальная мембрана, капсула сустава, связочный аппарат, периартикулярные мышцы, субхондральная кость, которые становятся источниками хронической боли при ОА. Одной из особенностей хронических болевых синдромов является рефлекторное вовлечение мышц, сначала на сегментарном поражению уровне, затем более диффузно, формирующем мышечно-тонический синдром, возникающий вследствие ноцицептивной импульсации, идущей от пораженных тканей. При длительной ноцицептивной импульсации тонически напряженная мышца сама становится источником боли и потенциально готова к формированию миофасциального болевого синдрома. Помимо возбуждения афферентными стимулами, мышечные ноцицепторы активируются эндогенными веществами, формирующимися при ее длительном напряжении и вызывающими ощущение боли, типа брадикинина, серотонина и высоких концентраций ионов калия. Брадикинин и серотонин тоже оказывают влияние на кровеносные сосуды и вызывают изменение локального состояния васкуляризации. Длительное напряжение мышц через механизмы нейрогенного воспаления способствует появлению локусов болезненных мышечных уплотнений, что еще более усиливает афферентный поток ноцицептивных импульсов в структуры ЦНС и как следствие этого, сенситизируется большее количество центральных ноцицептивных нейронов. Этот порочный круг играет важную роль в хронизации боли [29]. Интенсивность ее при ОА может зависеть от многих факторов, и, как показали последние исследования, одним из них является нарастание минеральной плотности субхондральной большеберцовой кости [3, 4].
Ведущее место в лечении ОА занимают нестероидные противовоспалительные препараты (НПВП), относящиеся к классу симптом-модифицирующих препаратов. В ревматологии НПВП рассматриваются как необходимый компонент комплексного лечения, что патогенетически обосновано, так как постоянно присутствующий воспалительный процесс является причиной болевого синдрома и прогрессирования заболевания. Обладая противовоспалительными, анальгетическими и жаропонижающими свойствами, они широко используются для уменьшения боли, воспаления, скованности и улучшения функции суставов, не влияя на исход заболевания, но значительно улучшая качество жизни больных. Как показали данные большого числа клинических исследований, при ревматических заболеваниях (РЗ) НПВП значительно эффективнее, чем высокие дозы парацетамола (4 г/сут), и не уступают опиоидным анальгетикам (таким как трамадол) [5, 6]. Однако даже кратковременный прием НПВП у определенной группы больных может приводить к развитию серьезных нежелательных явлений.
Разнонаправленность биологического действия НПВП объясняет не только их противовоспалительное действие, но и определенный спектр класс-специфических осложнений, возникающих на фоне их приема. Наиболее частые побочные эффекты НПВП — поражение желудочно-кишечного тракта (ЖКТ), негативное влияние на систему кровообращения, снижение агрегации тромбоцитов. Потенциально важными осложнениями являются также нефро- и гепатотоксичность.
Развитие НПВП-индуцированных гастропатий определяется в первую очередь системным воздействием НПВП, связанным с подавлением активности циклооксигеназы-1 (ЦОГ-1), определяющей синтез «цитопротективных» простагландинов (ПГ), что приводит к существенному снижению ее защитного потенциала и способствует повреждению слизистой. Снижение агрегации тромбоцитов, ухудшение капиллярного кровотока в слизистой, блокада NO-синтетазы и ферментных систем митохондрий эпителиоцитов, усиление клеточного апоптоза, влияние на желудочную секрецию и нарушение процессов репарации связаны с блокадой ЦОГ-2 и являются дополнительными факторами, связанными с системным воздействием НПВП [8]. НПВП-гастропатии возникают в хронологической связи с приемом НПВП и проявляются эрозиями и язвами верхних отделов ЖКТ, на фоне которых возможны такие осложнения, как желудочно-кишечное кровотечение и перфорация. Негативное влияние этих препаратов может отмечаться во всех отделах ЖКТ, от полости рта до прямой кишки. Поражения печени, ассоциированные с регулярным приемом НПВП, проявляются бессимптомным повышением трансаминаз у 1–5% больных. Клинически выраженные гепатотоксические реакции встречаются существенно реже — около 1 случая на 10 000 больных. Больным, регулярно принимающим НПВП и имеющим возможные факторы риска поражения печени, требуется регулярный контроль биохимического анализа крови.
Кардиоваскулярные побочные эффекты НПВП особенно выражены у лиц пожилого возраста и у больных, страдающих сопутствующими заболеваниями (ишемическая болезнь сердца, сахарный диабет), а также ревматическими воспалительными заболеваниями (в первую очередь ревматоидный артрит (РА)). НПВП являются независимым фактором риска развития артериальной гипертензии (АГ). Результаты рандомизированных клинических исследований и метаанализов свидетельствуют, что прием неселективных (нНПВП) и селективных НПВП (сНПВП) приводит к повышению АД и имеет существенное значение у больных, исходно имеющих АГ [9]. Особое внимание привлечено к потенциальным кардиоваскулярным осложнениям на фоне приема сНПВП, что связано с возможностью этих препаратов снижать ЦОГ-2-зависимый синтез простациклина (РGl2) клетками сосудистого эндотелия и отсутствием влияния на ЦОГ-1-зависимый синтез тромбоксана (ТхА2) тромбоцитами, что потенциально может приводить к нарушению баланса РGl2/ТхА2 и, следовательно, к активации агрегации и адгезии тромбоцитов и увеличению риска тромбообразования. Необходимо отметить, что НПВП, как класс, способны повышать риск развития кардиоваскулярных осложнений, однако этот фактор существенно уступает по значению другим, таким как курение, дислипидемия, ожирение [8, 27].
Тем не менее, при грамотном назначении НПВП можно снизить риск развития нежелательных явлений. При индивидуальном подборе НПВП необходимо учитывать анальгетический эффект препарата, индивидуальный риск развития нежелательных явлений со стороны ЖКТ и сердечно-сосудистой системы. Опасность ЖКТ-осложнений снижается при назначении ингибиторов протонной помпы (ИПП), а кардиоваскулярный риск — при использовании низких доз ацетилсалициловой кислоты [10]. Необходимо помнить, что основными факторами риска являются пожилой возраст (старше 65 лет), наличие в анамнезе язвенной болезни, длительный прием высоких доз НПВП и одновременное применение двух и более различных НПВП, а также сочетанный прием НПВП и гормональных препаратов. В последних международных рекомендациях по лечению больных ОА говорится о том, что терапию НПВП необходимо проводить в минимальных эффективных дозах и, по возможности, не назначать их длительно [7].
В России имеется широкий спектр НПВП и закономерно возникает вопрос о рациональном выборе препарата. Несомненно, он должен основываться на объективном сравнении достоинств и недостатков различных представителей этой группы препаратов. Доказано, что в эквивалентных дозах и при достаточном времени наблюдения все НПВП (селективные и неселективные) демонстрируют одинаковую эффективность [28].
Основной принцип действия НПВП заключается в подавлении ЦОГ — фермента метаболизма арахидоновой кислоты в простагландины. Особое место среди НПВП занимает ацеклофенак (Аэртал), который обладает многокомпонентным действием на воспаление. Ацеклофенак ингибирует и ЦОГ-1 (синтез физиологических ПГ), и ЦОГ-2 (синтез провоспалительных ПГ), приближаясь к селективным НПВП, и поэтому является более безопасным в отношении ЖКТ. Препарат ингибирует синтез провоспалительного цитокина интерлейкина IL-1-бета, который подавляет пролиферацию хондроцитов и активизирует деградацию хряща. Важной способностью ацеклофенака является подавление синтеза фактора некроза опухоли альфа (ФНО-альфа), оксида азота. Кроме этого, препарат угнетает экспрессию молекул клеточной адгезии (L-селектин), подавляет адгезию нейтрофилов к эндотелию, что обеспечивает выраженный противовоспалительный эффект [14, 15]. В настоящее время особое внимание уделяется влиянию НПВП на метаболизм хрящевой ткани. Условно НПВП можно разделить на три группы: хондронегативные, нейтральные по отношению к хрящевой ткани и хондропротективные. Вопрос о негативном влиянии некоторых препаратов из этой группы на прогрессирование ОА широко обсуждается [11–13]. Так, в исследованиях in vitro было показано, что индометацин и салицилаты ингибируют синтез компонентов матрикса хряща, способствуя прогрессированию заболевания, а индометацин оказывает прямое негативное действие, снижая содержание протеогликанов в гиалиновом хряще и повышая потерю вновь образованных протеогликанов. В то же время некоторые НПВП повышают синтез компонентов матрикса и тормозят апоптоз хондроцитов. Ацеклофенак в эксперименте продемонстрировал способность повышать синтез протеогликанов и гиалуроновой кислоты в культуре клеток хряща больных ОА, а также снижать продукцию металлопротеиназ, вызывающих деструкцию костной и хрящевой ткани [14, 15]. Blot L. и соавт., изучая изменения в метаболизме протеогликанов и гиалуронана под влиянием ацеклофенака, диклофенака и мелоксикама в эксплантах хряща, полученных от больных среднетяжелым и тяжелым гонартрозом, показали, что при лечении диклофенаком метаболический баланс между содержанием протеогликанов и гиалуроновой кислоты в экстрацеллюлярном матриксе гиалинового хряща оставался без изменений. Ацеклофенак и мелоксикам, напротив, обладали дозозависимым эффектом и повышали синтез протеогликанов и гиалуроновой кислоты при среднетяжелом ОА [15].
Клиническая эффективность ацеклофенака доказана в 132 опубликованных клинических исследованиях. Переносимость и эффективность этого препарата изучалась в сравнительных исследованиях с различными анальгетиками и НПВП. Так, Battle-Gualda E. и соавт. в двойном слепом рандомизированном 6-недельном исследовании у 168 больных с ОА коленных суставов показали, что ацеклофенак в дозе 200 мг/сут был эффективнее в отношении купирования болевого синдрома при лучшей переносимости по сравнению с парацетамолом 3 г/сут [16]. В более длительном исследовании (период наблюдения составил 12 недель) у больных с гонартрозом, ацеклофенак 200 мг/сут сравнивали с напроксеном 1 г/сут. Оба препарата обладали равным анальгетическим эффектом, однако у ацеклофенака было отмечено значительно меньшее количество нежелательных явлений со стороны ЖКТ [17]. Результаты метаанализа 13 рандомизированных двойных слепых исследований у пациентов с РЗ показали, что при приеме ацеклофенака в течение длительного времени (3–6 месяцев) побочные реакции развивались в 1,38 раза реже, чем при приеме других НПВП [18]. Эффективность ацеклофенака оценивалась в рандомизированных исследованиях и при других РЗ: при РА ацеклофенак в дозе 200 мг/сут был сопоставим с диклофенаком в дозе 150 мг/сут, кетопрофеном в дозе 150 мг/сут, пироксикамом в дозе 20 мг/сут. Также было отмечено, что положительная динамика быстрее развивалась у больных, получавших ацеклофенак. У больных с анкилозирующим спондилоартритом (АС) в сравнительных исследованиях ацеклофенака 200 мг/сут, теноксикама 20 мг/сут, напроксена 1 г/сут и индометацина 100 мг/сут были получены сходные результаты [19].
Больные РЗ, как правило, вынуждены принимать НПВП длительное время, поэтому очень важна хорошая переносимость препарата. Результаты проспективного, открытого, многоцентрового 12-месячного исследования SAMM (Safety Assessment of Marketed Medicines), в котором оценивалась безопасность ацеклофенака и диклофенака у 10 142 больных, страдающих РА, ОА, АС, подтвердили хорошую переносимость ацеклофенака [20]. Ацеклофенак в дозе 200 мг/сут получали 7890 человек и диклофенак 150 мг/сут — 2252 пациента. Исследователями была проанализирована частота побочных реакций: нежелательные явления возникли у 22,4% больных, получавших ацеклофенак, и у 27,1% — принимавших диклофенак. Наиболее частыми из них были реакции со стороны ЖКТ (диспепсия, боли, диарея, тошнота) — в 10,6% и 15,2% (р 40 мм по ВАШ. По демографическим и клиническим параметрам группы были сопоставимы (табл. 1). Первая группа принимала ацеклофенак (Аэртал) 200 мг/сут, вторая — диклофенак 100 мг/сут. Длительность исследования составила 3 месяца. Оценивались: индекс WOMAC, тест «встань и иди», опросник EQ-5D, общий и биохимический анализы крови.
Результаты исследования и обсуждение
Достоверное уменьшение интенсивности боли и улучшение функции суставов, уменьшение суммарного индекса WOMAC отмечалось через месяц терапии в обеих группах больных и сохранялось весь период наблюдения (табл. 2). Более быстрое снижение скованности отмечалось у больных, принимавших ацеклофенак, когда уже на втором визите были получены статистически значимые показатели, к концу лечения отмечалось достоверное снижение скованности в обеих группах больных. Достоверное улучшение показателей общего состояния здоровья и EQ-5 D, а также уменьшение затрачиваемого времени при выполнении теста «встань и иди» наблюдалось в обеих группах со второго визита.
Через месяц «значительное улучшение» и «улучшение» чаще наблюдалось на фоне приема ацеклофенака (86,3%), чем на диклофенаке (66%), через 3 месяца терапии — у 95,8% и у 76,2% соответственно (р
Е. П. Шарапова*, кандидат медицинских наук
Е. А. Таскина*
Т. А. Раскина**, доктор медицинских наук
И. Б. Виноградова***, кандидат медицинских наук, доцент
О. Н. Иванова****, кандидат медицинских наук
Л. В. Меньшикова*****, доктор медицинских наук, профессор
Л. И. Алексеева*, доктор медицинских наук, профессор
*ФГБУ НИИ ревматологии РАМН, Москва
**ГБОУ ВПО КемГМА Минздравсоцразвития России, Кемерово
***ГУЗ ОКБ, Ульяновск
****ГУЗ ОКБ № 1, Воронеж
*****ГБОУ ДПО ИГМАПО Минздравсоцразвития России, Иркутск
Применение Аэртала (ацеклофенака) в клинической практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В ревматологической практике для комплексной терапии воспалительных и болевых синдромов наиболее часто применяются нестероидные противовоспалительные препараты (НПВП), обладающие выраженной противовоспалительной, анальгетической, жаропонижающей, а также антитромботической активностью. Основными показаниями для назначения НПВП являются, прежде всего, воспалительные и дегенеративные заболевания суставов и позвоночника – ревматоидный и реактивные артриты, псориатическая артропатия, острая ревматическая лихорадка, подагра, анкилозирующий спондилит, болезни мягких тканей, боли в нижней части спины (Low Back Pain) и др. НПВП эффективны при лечении приступов мигрени, почечной и печеночной колики, дисменореи и воспалительных заболеваний придатков, посттравматической и послеоперационной боли. В последнее время область применения НПВП значительно расширилась – их стали широко использовать для профилактики раннего развития атеросклероза у больных, страдающих аутоиммунными ревматическими заболеваниями, лечении болезни Альцгеймера, а также для профилактики развития рака толстого кишечника у больных с наследственным аденоматозом толстой кишки и метастазов при злокачественных опухолях различной локализации.
Группа НПВП включает большое количество препаратов, которые различаются по анальгетической и противовоспалительной активности, путям введения препарата в организм, спектру нежелательных явлений и др. В связи с этим подходы к их назначению различаются в зависимости от клинических проявлений заболевания, возраста больных, прогнозируемой длительности лечения и т.д. При этом необходимо учитывать, что при приеме НПВП, особенно длительном, возможно развитие нежелательных явлений – тошноты, неприятных ощущений и болей в эпигастральной области, метеоризма, диареи, а также эрозивно–язвенных поражений, кровотечений и перфораций стенки желудка, 12–перстной кишки и кишечника. Назначение НПВП у некоторых больных может спровоцировать развитие бронхоспазма, головокружения, бессонницы, нарушение костномозгового кроветворения, проявляющееся снижением количества эритроцитов, лейкоцитов и тромбоцитов в периферической крови, которые, впрочем, встречаются нечасто. Некоторые НПВП способствуют повышению АД, на фоне их приема снижается эффективность ингибиторов АПФ, диуретиков и b –адреноблокаторов [2].
Одним из побочных эффектов НПВП является их возможное неблагоприятное воздействие на суставной хрящ, что особенно актуально при лечении больных с суставным синдромом (ревматоидный артрит, остеоартроз и др.). Так, некоторые неселективные НПВП (индометацин, ибупрофен и др.) при длительном применении угнетают пролиферацию хондроцитов, вызывая тем самым усиление процессов деградации хрящевой ткани [6]. Считается доказанным также различное влияние НПВП на синтез протеогликанов хондроцитами. В частности, Dingle J.T. и M. Parker (1997) все НПВП подразделили на 3 группы в зависимости от их влияния на синтез компонентов матрикса хряща in vitro: ингибирующие (индометацин, напроксен, ибупрофен, нимесулид), нейтральные (пироксикам, набуметон) и стимулирующие (тенидап, ацеклофенак) [9]. Имеются также данные о нарастании частоты деструктивных изменений суставного хряща при приеме индометацина и напроксена, выявляемых рентгенологически [4].
Различная степень эффективности и ингибирования ЦОГ, а также вариабельность фармакодинамических и фармакокинетических свойств НПВП, по–видимому, и лежит в основе объяснения (если не объясняет полностью) весьма широкого спектра их фармакологической активности. Такая функциональная гетерогенность применима также и к анальгетической эффективности этих препаратов, хотя определение НПВП как «слабых анальгетиков» не совсем корректно, учитывая тот факт, что при послеоперационных болях некоторые НПВП оказывают значительно лучший обезболивающий эффект, чем опиоидные анальгетики [7]. За последние годы были накоплены данные, свидетельствующие о том, что анальгетический эффект НПВП не всегда можно объяснить только их способностью ингибировать синтез простагландинов в периферических тканях. В частности, было установлено, что некоторые препараты из группы НПВП, проникающие через гематоэнцефалический барьер, препятствуют обработке ноцицептивных сигналов в спинном мозге. Предполагаемыми мишенями НПВП в ЦНС являются нейромедиаторы возбуждения, в частности глутамат, G–белки, серотонинэргические и опиатные пути, а также полиамины. Кроме того, было показано, что некоторые НПВП могут ингибировать синтез простагландинов непосредственно в ЦНС [1].
Одним из препаратов, который получил широкое применение в ревматологической практике, является ацеклофенак ( Аэртал ) – дериват фенилуксусной кислоты, обладающий коротким периодом полужизни (4 часа) и хорошей эффективностью, сопоставимой с другими «стандартными» НПВП [3,14]. Доказано, что ацеклофенак ингибирует оба изофермента циклооксигеназы с преимущественным угнетением ЦОГ–2, а также подавляет синтез ряда провоспалительных цитокинов, в частности, ИЛ–1 [13]. Ацеклофенак быстро всасывается в организме – пиковая концентрация препарата в крови достигается уже через 1–3 часа после приема, при этом в синовиальной жидкости она составляет около 50% от плазменной. Элиминация препарата осуществляется преимущественно (до 66%) с мочой [8]. Лечебная доза Аэртала составляет 200 мг в сутки, поддерживающая – 100 мг в сутки [5].
Фармакокинетика Аэртала (ацеклофенака) не меняется с возрастом, что очень важно при назначении его пожилым больным, а биодоступность не снижается при приеме с пищей [24]. Кроме того, не выявлено взаимодействия препарата с другими фармакологическими средствами, в частности, с диуретиками, ингибиторами АПФ, антикоагулянтами и др. В частности, при сочетанном назначении ацеклофенака и диуретиков не отмечено изменений артериального давления и осмолярности мочи. Не было выявлено также отрицательных клинических эффектов при совместном приеме ацеклофенака с антидиабетическими препаратами, вместе с тем при длительном приеме НПВП все же иногда необходима коррекция дозы сахароснижающих препаратов. Совместный прием ацеклофенака и варфарина приводил к некоторому повышению плазменной концентрации последнего, однако существенного влияния на показатели коагулограммы это не оказывало. Не выявлено каких–либо изменений при совместном приеме ацеклофенака и метотрексата, широко использующегося в комплексной терапии ревматических заболеваний [3].
С учетом того, что Аэртал широко используется в клинической практике с 1992 года (в России препарат был зарегистрирован в 2002 году), то к настоящему времени накоплен большой практический опыт по его применению при различных ревматических заболеваниях. Во многих клинических исследованиях была продемонстрирована сходная эффективность ацеклофенака и других неселективных НПВП (диклофенака, пироксикама, напроксена) при ревматоидном артрите, остеоартрозе, анкилозирующем спондилите и др. В экспериментах на животных было показано, что ацеклофенак при равной эффективности со стандартными НПВП оказывает гораздо меньшее повреждающее действие на слизистую ЖКТ. Так, его ульцерогенная доза в эксперименте оказалась примерно в 4 раза выше, чем у диклофенака, индометацина и напроксена. Проведенное сравнительное исследование ацеклофенака и селективных НПВП (целекоксиба и рофекоксиба) в отношении подавления активности ЦОГ–1 и ЦОГ–2 в цельной крови человека показало, что ацеклофенак ингибирует оба изофермента, но преимущественно экспрессию ЦОГ–2 и, таким образом, по механизму действия приближается к селективным [17].
Доказана способность Аэртала (ацеклофенака) ингибировать синтез ряда провоспалительных цитокинов (ФНО– α и ИЛ–1 β ), что имеет важное значение при использовании его как при воспалительных заболеваниях суставов (ревматоидный артрит, подагрический артрит, анкилозирующий спондилит и др.), так и при остеоартрозе. Результаты исследования Y. Henrotin и соавт. (2001) свидетельствуют о потенциальной способности ацеклофенака оказывать влияние на процессы деградации матрикса хряща за счет ингибирования активности ИЛ–1 β и стимуляции синтеза глюкозаминогликанов (ГАГ) в хряще при остеоартрозе [13]. Как известно, ИЛ–1 β подавляет синтез хондроцитов и инициирует процессы деградации хряща в результате усиления высвобождения протеолитических ферментов. Установлено также стимулирующее влияние ацеклофенака на синтез антагониста рецепторов ИЛ–1 β в человеческих хондроцитах и подавление продукции металлопротеиназ [4]. Таким образом, назначение ацеклофенака в этих случаях оказывает как симптомо–модифицирующий, так и в некоторой степени патогенетический эффект. В частности, в клинических исследованиях был продемонстрирован ингибирующий эффект ацеклофенака на продукцию ПГЕ 2 в синовиальной жидкости больных с гонартрозом.
Важным также является установленный факт, свидетельствующий о том, что анальгетический эффект ацеклофенака у пациентов с ОА сопоставим с другими НПВП, в том числе диклофенаком, пироксикамом и напроксеном. Так, в исследовании D.E. Ward и соавт. (1995) было продемонстрировано, что у двух групп больных с ОА коленных суставов (n=397) через 12 недель терапии ацеклофенаком (200 мг/сут.) и диклофенаком (150 мг/сут.) отмечалось значимое уменьшение болевого синдрома, оцениваемого по 100–мм визуальной аналоговой шкале (ВАШ), при этом в группе ацеклофенака интенсивность боли уменьшилась на 75%, в группе диклофенака – на 70% [23]. Другие параметры заболевания – общее самочувствие, боль при движении и функциональная активность также значимо улучшились в обеих группах, однако, согласно данным опроса, большее предпочтение пациенты отдавали ацеклофенаку (71% против 59%, p=0,005).
В другом 8–недельном двойном слепом исследовании у пациентов с ОА коленных суставов (n=240) использовался ацеклофенак и пироксикам. На фоне терапии в обеих группах отмечалось существенное уменьшение интенсивности боли и улучшение функции суставов согласно индекса тяжести остеоартроза LOSI (Lequense Osteoarthritis Severity Index), однако лучший результат наблюдался у больных, получавших ацеклофенак [21]. Аналогичные результаты были получены и в другом сравнительном исследовании ацеклофенака и пироксикама у больных с гонартрозом [22].
В 12–недельном исследовании, в котором принимали участие 374 больные с ОА коленных суставов, была установлена сопоставимая терапевтическая эффективность ацеклофенака (200 мг/сут., 1–я группа) и напроксена (1000 мг/сут., 2–я группа). К концу курса терапии большинство обследованных пациентов отмечали уменьшение болей в покое и при движении, при этом объем движений в пораженных суставах увеличился у 81% больных 1–й группы и 84% 2–й группы, а улучшение общего состояния отметили 73 и 69% пациентов соответственно [15].
У больных ревматоидным артритом при назначении ацеклофенака наблюдался хороший противовоспалительный и анальгетический эффект, сравнимый с приемом «стандартных» НПВП – диклофенака, индометацина и теноксикама. Так, в многоцентровом двойном слепом 6–месячном исследовании было проведено сравнение ацеклофенака (200 мг/сут., 170 больных) и диклофенака (150 мг/сут., 173 больных) в параллельных группах [19]. Оба препарата достоверно снижали выраженность боли, индекс Ричи и утреннюю скованность уже через 15 дней от начала терапии, при этом достигнутый положительный эффект сохранялся в течение всего периода лечения. По оценке больных, хороший или очень хороший результат терапии был у 70,3% пациентов при лечении ацеклофенаком и у 65,6% – диклофенаком, а по оценке исследователя – у 76,3 и 69,6% больных соответственно.
С учетом того, что при серонегативных спондилоартропатиях НПВП являются основой медикаментозной терапии, то к их эффективности и переносимости предъявляются особые требования. Проведенные исследования эффективности ацеклофенака и стандартных НПВП у больных анкилозирующим спондилитом (АС) показали их эквивалентность, однако лучший профиль переносимости и безопасности продемонстрировал ацеклофенак. Так, в рандомизированном контролированном исследовании назначение ацеклофенака в дозе 200 мг/сут. и напроксена в дозе 1000 мг/сут. одинаково эффективно снижали интенсивность болей и способствовали улучшению функциональной активности у 126 больных АС [20]. В другом исследовании была продемонстрирована равная терапевтическая эффективность ацеклофенака и других НПВП (индометацина, теноксикама и напроксена) в отношении купирования боли, уменьшения продолжительности утренней скованности и улучшения двигательной активности при болезни Бехтерева [10].
Как известно, целесообразность применения того или иного препарата в клинической практике невозможна без всестороннего изучения его переносимости. Одним из серьезных побочных эффектов НПВП, ограничивающих их применение, является развитие НПВП–индуцированных гастропатий, проявляющихся эрозиями (часто множественными) и язвами антрального отдела желудка. Основными факторами риска их развития являются пожилой возраст больных, наличие в анамнезе язвенной болезни, желудочно–кишечного кровотечения или мелены, длительный прием высоких доз НПВП, прием одновременно НПВП и препаратов других фармакологических групп (глюкокортикоидов, антикоагулянтов и др.) [2].
Данные многочисленных клинических исследований свидетельствуют о том, что частота возникновения неблагоприятных явлений со стороны органов ЖКТ при приеме подавляющего большинства неселективных НПВП достигает 30%, а госпитализация пациентов пожилого возраста из–за развития пептической язвы в 4 раза выше по сравнению с лицами той же возрастной группы, не принимающих НПВП.
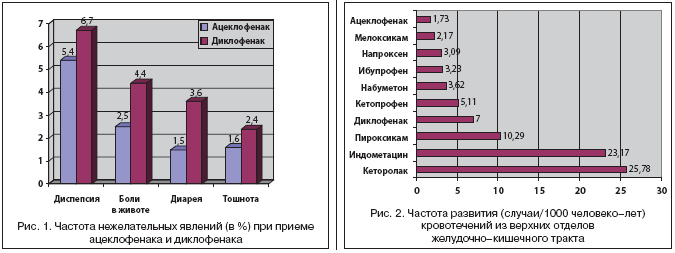
На сегодняшний день общепринятым считается факт, что нет абсолютно безопасных НПВП, в связи с чем они могут быть условно подразделены на 2 группы: с высоким и низким риском развития побочных эффектов со стороны органов ЖКТ. Спектр нежелательных явлений при лечении ацеклофенаком оказался близок таковому при лечении другими НПВП, однако существенно различался по частоте их развития. Это было продемонстрировано в исследовании SAMM (Safety Assessment of Marketed Medicines), в котором принимали участие 10142 больных (7890 пациентам был назначен ацеклофенак, 2252 пациентам – диклофенак), страдающие ревматоидным артритом, остеоартрозом и анкилозирующим спондилоартритом [12]. Результаты исследования свидетельствовали о лучшем профиле переносимости ацеклофенака в сравнении с диклофенаком (рис. 1). Авторы сформулировали вывод о том, что применение ацеклофенака сопровождалось меньшим риском развития НПВП–гастропатий и лучшей переносимостью даже с учетом того, что среди больных, получавших ацеклофенак, было значительно больше пациентов с патологией ЖКТ в анамнезе.
В исследовании А. Yanagawa и соавт. (1998) изучалось возможное побочное действие ацеклофенака и диклофенака на слизистую оболочку 12–перстной кишки (по результатам фиброгастродуоденоскопии) в двойном слепом плацебо–контролируемом исследовании [25]. Эндоскопические изменения после 2–х недельного приема ацеклофенака, диклофенака и плацебо достоверно чаще наблюдались в группе диклофенака. При этом было установлено, что у пациентов, получавших диклофенак, содержание гексозамина (фактора, оказывающего цитопротективное действие) и локальный кровоток в слизистой оболочке желудка и 12–перстной кишки были значимо снижены, в то время как при лечении ацеклофенаком эти показатели достоверно не отличались от группы плацебо.
Результаты этих исследований корреспондируют с работой M.J. Llorente Melero и соавт. (2002), в которой был представлен сравнительный популяционный анализ частоты желудочно–кишечных кровотечений при приеме различных НПВП по данным медицинских учреждений Испании (были изучены данные по 180995 пациентам за 4–летний период) [18]. Как видно из рисунка 2, прием ацеклофенака и мелоксикама сопровождался наименьшим риском развития кровотечений из верхних отделов ЖКТ, в то время как при назначении кеторолака и индометацина риск желудочно–кишечных кровотечений был выше более чем в 10 раз.
Исходя из представленных данных, можно констатировать, что ключевым моментом в выборе НПВП врачом–ревматологом является его высокая клиническая эффективность, безопасность, а также хорошая переносимость. В этом плане интересны результаты Европейского обсервационного когортного исследования, в котором анализировалась эффективность применения ацеклофенака у 23407 больных с воспалительными и дегенеративными ревматическими заболеваниями [16]. В этом исследовании оценивалась степень выраженности боли на фоне проводимой терапии, общая удовлетворенность лечением, а также уровень комплаентности. Полученные результаты продемонстрировали быстрый и продолжительный анальгетический эффект ацеклофенака, при этом улучшение общего состояния наблюдалось у 84% обследованных пациентов, а 93,5% больных отметили удовлетворенность лечением по окончанию исследования.
Таким образом, суммируя данные по эффективности и переносимости ацеклофенака, полученные в многочисленных контролируемых клинических исследованиях, можно заключить, что ацеклофенак (Аэртал) является высокоэффективным НПВП и имеет при этом ряд преимуществ перед другими «стандартными» НПВП : быстрый период полураспада (4 часа), что снижает возможность кумуляции препарата и, соответственно, риск развития побочных эффектов; высокая биодоступность, которая не зависит от приема пищи; сравнимая фармакокинетика у лиц различных возрастных групп; сопоставимая эффективность с диклофенаком, индометацином, напроксеном и кетопрофеном при лечении дегенеративных и воспалительных заболеваний суставов; лучшая желудочно–кишечная переносимость в сравнении с другими «стандартными» НПВП по данным клинико–эндоскопических исследований; возможность сочетанного приема с препаратами других фармакологических групп (непрямыми антикоагулянтами, гипогликемическими препаратами, диуретиками); отсутствие доказательств отрицательного влияния на хрящ.



.gif)