Афлатоксин что это простыми словами
Афлатоксикоз
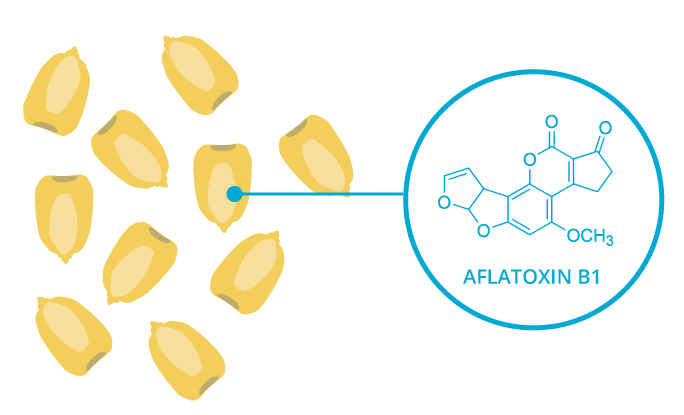
Что такое афлатоксины и их источники
Известно около 20 афлатоксинов, наиболее опасными из них считают тип В1 и его метаболиты. Источниками афлатоксинов являются определенные продукты питания, зараженные плесневыми грибками и хранившиеся в условиях, способствующих продуцированию токсинов. Это могут быть:
Соединения термостабильны, то есть не разрушаются под воздействием высоких температур при кулинарной обработке продукта.
Свойства афлатоксинов
Основным органом-мишенью является печень. При попадании в организм больших доз возможно развитие необратимых явлений в печени и, как следствие, летальный исход.
В частности, токсическое действие соединений на организм человека может выражаться в следующем:
При хроническом отравлении возможно развитие цирроза и карциномы печени.
Симптомы
Острый афлатоксикоз развивается в течение 30 минут после употребления зараженных продуктов и характеризуется следующими симптомами:
При хроническом отравлении регулярное попадание этих токсинов в организм может привести к развитию рака печени.
Лечение
Как и любое пищевое отравление, афлатоксикоз требует немедленной медицинской помощи. В противном случае могут быть тяжелые и порой необратимые поражения печени и нервной системы. Лечение, как правило, состоит из нескольких этапов.
Очищение организма. Это промывание желудка и постановка очистительных клизм.
Прием энтеросорбентов. Они необходимы для связывания и выведения токсических соединений.
Детоксикация. Парентеральное капельное введение растворов и диуретиков.
Прием противогрибковых препаратов. Прием лекарственных средств, эффективных в отношении грибков рода Аспергилл.
Прием иммуностимуляторов. Поддерживают иммунную систему.
Прием гепатопротекторов. Фосфоглив * и другие препараты-фосфолипиды могут способствовать восстановлению работы печени, нормализации обменных процессов и предупреждению цирроза и фиброза.
Прием витаминно-минеральных комплексов. Оказывают общее укрепляющее действие и снижают риск развития осложнений.
Стоит помнить, что чем раньше будет оказана медицинская помощь и начато лечение, тем благоприятнее прогноз заболевания.
Афлатоксин что это простыми словами
Афлатоксин В1 (AFB1) может достигать в кукурузе концентрации 10—900 мкг/кг. По данным FDA, 6 % кукурузы на корню в проблемных областях содержит его более 20 мкг/г.
Хотя доказательств, как правило, нет, считается, что афлатоксины вызывают печеночно-клеточный рак, острую печеночную недостаточность и синдром Рейе. Квашиоркор, серьезное и широко распространенное в тропиках детское заболевание, вполне вероятно, обусловлено приемом афлатоксинов младенцами. Воздействие этих веществ может быть пренатальным, длиться в период грудного вскармливания и продолжаться до взрослого возраста включительно. Не исключено, что афлатоксины:
(а) играют определенную роль в этиологии квашиоркора,
(б) увеличивают неонатальную чувствительность к инфекции и желтухе,
(в) повышают вероятность инфекций и злокачественных заболеваний у детей,
(г) препятствуют нормальной реакции на профилактические интоксикации ядами животных,
(д) каким-то образом участвуют в патогенезе различных расстройств у героиновых наркоманов.
Потребление афлатоксинов варьирует в различных странах от 0 до 30 000 нг/кг в сутки, а в большинстве регионов составляет 10—200 нг/кг в сутки. В грудном молоке уровень афлатоксинов может составлять от 3 до 84 нг/л. Если младенец с массой тела 5 кг пьет в сутки пол-литра загрязненного этими веществами молока, получаемая им ежедневно доза доходит до 8 нг/кг. В одном исследовании сывороточный уровень AFB, возрос после еды с 33,6 до 218 пг/л.
а) Метаболизм афлатоксинов. В печени взрослого человека AFB, превращается цито-хромным ферментом Р450 IIIAY (в печени плода — Р450 IIIА6) в свой главный метаболит — AFQ1. К другим важным его метаболитам у человека относятся AFM1, афлатоксикол (AFL), AFLH1, AFP1, АРВ2-альфа и AFBr 2,2-дигидриол. Примерно 80 % общей дозы AFB, экскретируется в течение 1 нед. Период полужизни в плазме составляет 36,5 мин, объем распределения — 14 % массы тела, а общий клиренс — 1,25 л/кг в час. AFM, выводится главным образом в течение 48 ч после приема AFB, и, по-видимому, соответствует 1—4 % его количества.
Возможно, количественное определение этого метаболита позволяет достаточно точно судить о недавней дозе афлатоксина.
Поскольку AFM конъюгируется и легко выводится с мочой, это вещество, вероятно, полезно для оценки процесса конъюгации афлатоксина. Активируется он до гидрофильного АFB1-2,3-эпоксида, возможно, самого важного с канцерогенной точки зрения своего производного. Это вещество с высокой реактивной способностью соединяется с основаниями ДНК, в частности гуанином, приводя к ее изменениям.
б) Переход через плаценту. Исследование китайской популяции на Тайване с высокой смертностью от первичного печеночно-клеточного рака показывает, что в сыворотке пупочного канатика присутствуют продукты соединения афлатоксина В1 с ДНК, т. е. трансплацентарный перенос AFB, может играть определенную роль в предрасположенности новорожденных к этому заболеванию.
В 1988 г. вспышка пищевого отравления привела к смерти 13 детей в Малайзии во время китайского праздника девяти богов-императоров. Ее причинами считают афлатоксины и борную кислоту. Клиническая картина включала ранние симптомы, напоминающие синдром Рейе, в том числе рвоту, жар, понос, боль в животе, анорексию, эпилептические припадки и кому. Больные умирали от острой почечной и печеночной недостаточности. В различных органах у них обнаружены высокие уровни афлатоксинов B1, В2, G1, М1 и М2, а также афлатоксикола.
Возможно, анализ мутаций кодона 249Ser гена р53 позволит делать выводы о вероятности печеночно-клеточного рака после экспозиции к афлатоксину, а концентрация соединения афлатоксина с гуанином в моче послужит количественным показателем риска этого заболевания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
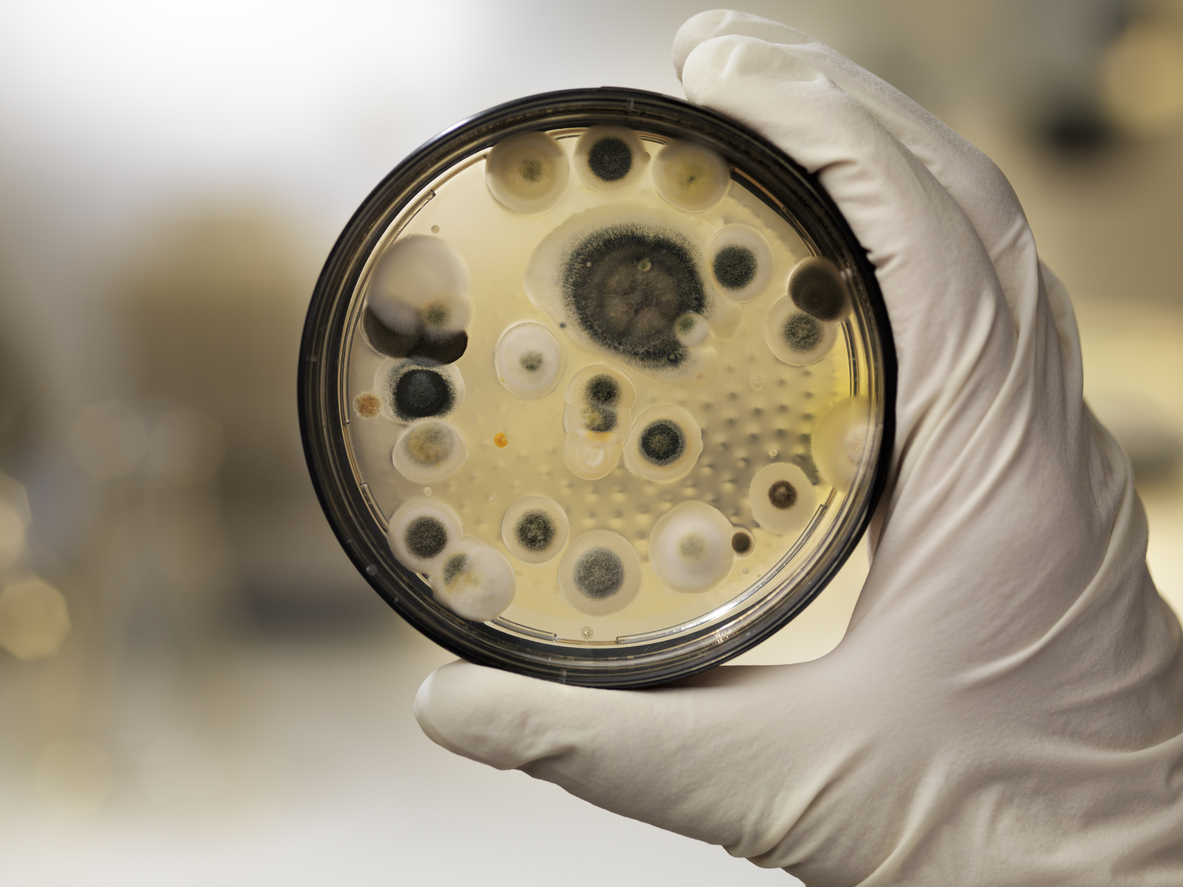
Плесень. Микотоксины. Лабораторные исследования
Афлатоксин В1 в природных условиях чаще и в наибольших количествах обнаруживается в арахисе и различных орехах, кукурузе, семенах масличных культур, пшенице, ячмене, зернах какао и кофе.
Афлатоксин М1-обнаруживается в молоке коров, получавших загрязненный афлатоксином В1 корм. При приготовлении сыра из зараженного молока содержание афлатокисна М1 может в 3-5 раз превосходить уровень загрязнения исходного молока
Как уберечь себя и своих близких от опасного действия микотоксинов?
Не следует есть или использовать для приготовления пищи (варенья, компота) наполовину испорченные ягоды и фрукты, особенно яблоки: здоровая на вид часть подпорченного яблока может быть сильно заражена микотоксином. А еще помните, что плесень не любит сухость и чистоту.
ФБУЗ «Центр гигиены и эпидемиологии в Рязанской области» выполняются исследования пищевых продуктов на содержание микотоксинов в рамках обеспечения государственного санитарно-эпидемиологического надзора. Эта работа проводится по Плану Управления Роспотребнадзора по Рязанской области при проведение плановых и внеплановых проверо. Вместе с этим наша организация может выполнять такие исследования на договорной основе по заявкам. Мы предлагаем следующие услуги по проведению лабораторных исследований пищевых продуктов на содержание в них афлатоксинов (В1, М1), микотоксинов: дезоксиниваленол (ДОН), зеараленон, патулин, охратоксин А.
По вопросам проведения исследований обращайтесь по телефону: 25-25-49
(c) Федеральное бюджетное учреждение здравоохранения «Центр гигиены и эпидемиологии в Рязанской области», 2006-2021 г.
Адрес: 390046, Рязанская область, город Рязань, ул. Свободы, дом 89
Афлатоксин что это простыми словами
Выпуски по годам
УДК 543.544.5.068.7
ББК 24.46
Цикуниб А. Д.
Дзыбов Р. М.
Лаборатория нутрициологии и экологии НИИ комплексных проблем АГУ
СОВРЕМЕННЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ АФЛАТОКСИНА B1 В ПИЩЕВЫХ ПРОДУКТАХ
Аннотация: на основании анализа отечественной и зарубежной литературы даны современные представления о строении, физико-химических свойствах и методах определения афлатоксина B1 в пищевых продуктах.
Ключевые слова: афлатоксин В1, высокоэффективная жидкостная хроматография (ВЭЖХ), тонкослойная хроматография (ТСХ), масс-спектрометрия (МС).
Tsikunib A. D.
Dzybov R. M.
Nutrition and Environment Laboratory, of Scientific Research Institute of complex Problеms of Adyghe State University
MODERN METHODS for the DETERMINATION of AFLATOXIN B1 IN FOOD
Abstract: on the basis of analysis domestic and foreign literature the modern views on the structure, physico-chemical properties and methods of determination of aflatoxin B1 in food products.
Key words: aflatoxin B1, high performance liquid chromatography (HPLC), thin layer chromatography (TLC), mass spectrometry (MS).
Наиболее опасным и часто встречающимся в продуктах питания токсичным веществом является афлатоксин В1 – вторичный метаболит микроскопических плесневелых грибов рода Aspergillus Flavus и Aspergillus Parasiticus [1]. Он плохо растворяется в воде, но хорошо в менее полярных растворителях, таких как метанол, диметилсульфоксид, хлороформ. Соединение в растворе стабильное, однако в химически чистом виде относительно неустойчивое и чувствительное к действию воздуха и света, особенно к УФ-излучению [14]. При детектировании в УФ свете флуоресцирует сине-голубым цветом [2]. Строение и физико-химические свойства афлатоксина B1 представлены на таблице 1.
Таблица 1. Строение и физико-химические свойства афлатоксина B1.
 | ||
| Строение афлатоксина B1 было установлено в 1967 году, а в 1969 году подтверждено лабораторным синтезом [8] | Молярная масса | 312,2798 г/моль |
| Температура плавления. | 269 °C | |
| Растворимость в воде | 10-20 мкг/мл | |
| λ макс, нм | 265,362 | |
| Агрегатное состояние | бесцветный или светло-желтый кристаллический порошок |
Афлатоксин B1 обладает сильнейшей гепатотоксичностью и гепатоканцерогенной активностью [20]. При воздействии афлатоксина B1 на организм, он гидроксилируется до эпоксида, который воздействует на ДНК печени [18] и вызывает рак печени [20].
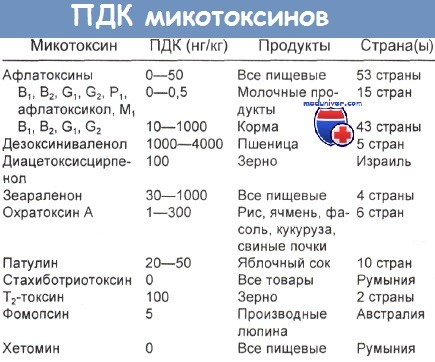
Предотвратить загрязнение продуктов питания афлатоксинами практически невозможно, поэтому необходим строгий контроль данных веществ в пищевых продуктах растительного и животного происхождения [9]. Предельно допустимые концентрации афлатоксина B1 [6] регламентируются в продовольственном сырье и пищевых продуктах растительного происхождения: в России – 0,005 мг/кг, Германии – 0,01, США – до 0,02 мг/кг [7].
Для определения афлатоксина В1 в продуктах питания применяют в основном хроматографические методы [20]. Общая схема методов определения афлатоксина B1 представлена на рис. 1.

Рис. 1. Общая схема методов определения афлатоксина B1.
Описаны методы выявления и определения содержания афлатоксина В1 тонкослойной хроматографией (ТСХ) и высокоэффективной жидкостной хроматографией (ВЭЖХ) с флуоресцентным детектированием, основанные на экстракции из зерновых, зернобобовых, орехов, кондитерских изделий, хлебопродуктов и концентратов, плодовых и овощных консервов 10 % раствором хлорида натрия и ацетоном; из какао-бобов, какао-порошка и шоколада гексаном и раствором азотнокислого серебра-хлороформа (1:5); из растительных масел и животных жиров раствором гексана, 4 % раствором хлорида натрия и ацетонитрила (1:5:10); из молочных продуктов раствором хлорида натрия, лимонной кислоты и хлороформа (10:1,2:5). Диапазон измеряемых содержаний афлатоксина B1 во всех продуктах 0,003-0,02 мг/кг [2].
Наиболее быстрый, дешевый, весьма эффективный, надежный и безопасный процесс выделения и очистки афлатоксина из пробы – метод QuEChERS – (Quick, Easy, Cheap, Effective, Rugged, Safe), основанный на извлечении афлатоксинов из пробы смесью ацетонитрил-вода и добавлении буферирующих неорганических солей. В результате такой экстракции афлатоксины переходят в органическую фазу, а более полярные примеси – в водный слой. Примеси (некоторые сахара и жирные кислоты), оставшиеся в ацетонитриле, могут быть удалены на дисперсионном сорбенте, содержащем амины (PSA сорбент) [11].
Для совместного определения афлатоксина В1, зеараленона, Т-2 токсина и дезоксиниваленола, содержащихся в одних и тех же продуктах, предложено использовать смесь ацетонитрила и раствора хлорида калия с массовой долей 4% в соотношении 9:1 [3].
При разделении афлатоксина на хроматографических пластинках «Силуфол» с силикагелевым покрытием хроматографирование проводилось смесью растворителей гексан-ацетон (1:1). При этом величина Rf для афлатоксина В1 – 0,45. В отдельных случаях предложено использование подтверждающего теста водным раствором азотной кислоты, при этом флуоресценция меняется с оттенков голубого и синего на ярко-желтую. Такой подход позволил ускорить выдачу результата и экономно расходовать реактивы и хроматографические пластинки [5].
Описан метод определения афлатоксина B1 с помощью ТСХ, когда на пластинку наносят 5 мкл основного раствора и 5 мкл стандартного раствора смеси афлатоксинов. Сначала пластинку помещают в камеру, насыщенную парами системы толуол-этилацетат-85%-ная муравьиная кислота (5:4:1), затем хлороформ-метанол (99:1). Пластинку просматривают в УФ-лучах (365 нм). Rf афлатоксина B1 равно 0,39. Вместо системы хлороформ-метанол (99:1) можно использовать систему четыреххлористый углерод-ацетон-уксусная кислота (20:10:1). Rf афлатоксина B1 в этом варианте будет 0,38 [6]. Обобщенные данные об Rf афлатоксина B1 в разных системах растворителей приведены в таблице 2.
Таблица 2. Обобщенные данные об Rf афлатоксина B1 в разных системах растворителей.
Rf афлатоксина B1
Система растворителей
Источник литературы
Для подтверждения присутствия афлатоксина на пластинке, ее обрабатывают парами йода. Если при этом не произошло гашения флуоресценции пятен, пластинку опрыскивают йодом и раствором серной кислоты и рассматривают ее под ультрафиолетом. Изменение окраски пятен свидетельствует о наличии афлатоксина. Затем можно провести полуколичественное определение по минимально детектируемым веществам: на пластинку наносится ряд пятен возрастающего объема из исходного экстракта (1, 3, 5,7 и 9 мкл) и пятна стандарта (2-3 мкл) [8].
Для определения афлатоксинов обычно используют обращенно-фазовую ВЭЖХ с флуоресцентным детектированием. Применяют колонки, заполненные сорбентом из силикагеля с привитыми алкильными группами С18 и С8. В качестве подвижной фазы используют смеси воды с метанолом или ацетонитрилом [11]. Так, с применением данного метода возможно определение афлатоксинов В1 в зерновых, фруктах, орехах. Афлатоксин экстрагируют метанолом, затем очищают экстракт на иммуноаффинных колонках. В качестве подвижной фазы применяют смесь метанол-вода-ацетонитрил (9:32:9). Детектируют при 440 нм, предел обнаружения составляет 0.1 мкг/кг.
Для более достоверной идентификации, афлатоксин B1 определяют после предварительного перевода его в производное. Перевод основан на насыщении двойных связей в фурановом кольце. Переводят афлатоксин в производные до разделения на колонке реакцией с трифторуксусной кислотой (ТФУК) или после разделения на колонке реакцией с йодом или бромом [10]. Использование ТФУК основано на переводе афлатоксина В1 в производное В2а, который по сравнению с первым интенсивно флуоресцирует. Реакция дериватизации в зависимости от способа приготовления производных может протекать с разной скоростью. Для определения токсинов в арахисе, орехах, семенах тыквы, кукурузы и в арахисовом масле [19] применяют предколоночную дериватизацию с ТФУК, в качестве подвижной фазы используют смесь вода-ацетонитрил-метанол (70:17:17). Проводят флуоресцентное детектирование с длинами волн возбуждения и детектирования 360 и 440 нм соответственно. Предел обнаружения составляет 0.3 мкг/кг [13].
Чаще афлатоксин B1 переводят в производное после хроматографического разделения [14]. Получение таких производных возможно при наличии второго изократического насоса. Производные, полученные при взаимодействии афлатоксинов с йодом, детектируются с наивысшей чувствительностью. Раствор йода вводят в поток выходящего элюента, далее смесь прокачивают через катушку из нержавеющей стали, где поддерживается высокая температура (75°С) для протекания реакции, и уже далее образовавшийся продукт регистрируют флуориметрическим детектором.
Разработана методика определения афлатоксинов с переводом их в йод-производные. Разделение проводили на колонке Spherisorb ODS с использованием подвижной фазы вода-ацетонитрил-метанол (60:30:10) и длины волн возбуждения и детектирования 365 и 440 нм соответственно [18]. Аналогично определяют афлатоксины при анализе кукурузы, арахисового масла, сорго и солода. Афлатоксин В1 бромируют добавлением гидробромидапиридиния или электрохимически генерированного брома введением в подвижную фазу KBr и HNO3.
Разработана методика определения афлатоксина B1 в различных специях [12]. Для извлечения микотоксинов применяли смесь метанола и воды, очищали экстракты на иммуноаффинных колонках. Проводили постколоночную дериватизацию c гидробромидпиридином. В качестве подвижной фазы применяли 40%-ную смесь (5:4) метанол-ацетонитрил и воду. Разделение проводили на колонке Spherisorb ОDS2 при длинах волн возбуждения 362 нм и детектирования 418 нм. Пределы обнаружения токсинов составили 0,06 мкг/кг.
Разработан метод определения афлатоксинов для хлебных злаков с применением постколоночной фотохимической дериватизации. Афлатоксин B1 извлекали смесью метанола и фосфатного буферного раствора, очищали твердофазной микроэкстракцией. В качестве подвижной фазы применяли смесь вода-ацетонитрил-метанол (54:38:8), колонку с адсорбентом C18 при длинах волн возбуждения и детектирования 366 и 440 нм. Пределы обнаружения составили 0,035–0,2 мкг/кг [16, 17].
Разработан метод определения афлатоксина B1 в зерновых культурах, орехах и продуктах переработки с помощью ВЭЖХ с обращенной фазой, с очисткой на иммуноаффинной колонке и послеколоночной дериватизацией. Предел количественного определения афлатоксина В1 – 8 мкг/кг. Метод применим в отношении кукурузы с содержанием 24,5 мкг/кг, арахисового масла с содержанием 8,4 мкг/кг и сырых арахисовых орехов с содержанием 16 мкг/кг общей суммы афлатоксинов [9]. Метод может использоваться для масличных культур, сушеных фруктов и продуктов их переработки, и основан на экстрагировании пробы смесью метанола и воды, ввода его в колонку для аффинной хроматографии, содержащую антитела. Пробу отделяют от антител при помощи метанола. Афлатоксины определяют количественно при помощи ВЭЖХ с обращенной фазой с определением флуоресценции и послеколоночной дериватизацией [15].
Разработан метод идентификации афлатоксина B1 методом иммуноферментного анализа (ИФА) с использованием моноклональных антител (МкАт), однако он не обладает высокой специфичностью, так как наблюдается высокая перекрестная активность МкАт-4 с афлатоксинами B1, B2 и G1. Это позволяет предложить МкАт в качестве реагента для группового определения афлатоксинов B и G ряда. Отмечено также незначительное перекрестное взаимодействие МкАт с афлатоксином G2 (2,5%-4,5%) [11].
Благодаря быстрому росту технологических и научных знаний, в современном мире стали возможны быстрые и одновременно чувствительные методы обнаружения афлатоксинов в пищевых продуктах, которые используются для контроля качества продуктов питания и кормов, а также обеспечения здоровья человека. Самым популярным и чувствительным методом по обнаружению афлатоксина B1 является ВЭЖХ, однако, в силу дороговизны оборудования и реактивов. Актуальными остаются методы ТСХ проверенные временем и менее затратные.
Примечания:
1. Другов Ю.С., Родин А.А. Анализ загрязненных биосред и пищевых продуктов. М.: БИНОМ. Лаборатория знаний, 2007. 294 с.
2. ГОСТ 30711-2001 Продукты пищевые. Методы выявления и определения содержания афлатоксинов В(1) и М(1).
3. ГОСТ 31748-2012 (ISO 16050:2003) Продукты пищевые. Определение афлатоксина B(1) и общего содержания афлатоксинов B(1), B(2), G(1) и G(2) в зерновых культурах, орехах и продуктах их переработки. Метод высокоэффективной жидкостной хроматографии (с поправками).
4. Буркин М.А., Яковлева И.В., Свиридов В.В. Определение афлатоксина B ИФА с использованием моноклональных антител // Успехи медицинской микологии. 2003. № 1. С. 127-130.
5. Мокшина Н.Я., Селеменев В.Ф., Скопинцева В.Л. Определение микотоксинов в пищевых продуктах методом ТСХ // Сорбционные и хроматографические процессы. 2005. Т. 5, вып. 2. С. 254.
6. Методы ветеринарной клинической лабораторной диагностики: справочник / И.П. Кондрахин, А.В. Архипов, В.И. Левченко [и др.]; под ред. В.Н. Сайтаниди. М.: Колос, 2004. 520 c.
7. СанПиН 2.3.2.1078-01 Гигиенические требования безопасности и пищевой ценности пищевых продуктов: санитарно-эпидемиологические правила и нормы. – М.: Академия, 2002.
8. Цикуниб А.Д. Устойчивость семян рапса к токсигенной микрофлоре и разработка рекомендаций по улучшению биологической ценности получаемых продуктов: дис. … канд. техн. наук. М., 1992.
9. Амелин В.Г., Карасева Н.М., Третьяков А.В. Хроматографические методы определения микотоксинов в пищевых продуктах // Журнал аналитической химии. 2013. Т. 68, № 3. С. 212–223.
10. Abdulkadar A.H.W., Abdulla A.Al. Ali, Afrah M.Al. Mycotoxins in food products available in Qatar // Food Control. 2004. Vol. 15. P. 543.
11. Immunoaffinity Column Cleanup with Liquid Chromatography for Determination of Aflftoxin B 1 in Corn Samples: Interlaboratory Study / C. Brera, F. Debegnach, V. Minardi [et al.] // J. AOAC Int. 2007. Vol. 90, № 3. P. 765.
12. Garner R.C., Whattam M.M., Taylor P.J.L., Stow M.W. Analysis of United Kingdom purchased spices for aflatoxins using immunoaffinity column clean up procedure followed up by high-performance liquid chromatographic analysis and post-column derivatization with pyridium bromide perbromide // J. Chromatogr. 1993. Vol. 648. P. 485.
13. Guevara Gonzаlez R.G. Aflatoxins – Biochemistry and Molecular biology. Сroatia: InTech, 2011. Р. 439.
14. Glutathione-S-transferase A3 knockout mice are sensitive to acute cytotoxic and genotoxic effects of aflatoxin B 1 / Z. Ilic, D. Crawford [et al.] // Toxicol. Appl. Pharmacol. 2010. Vol. 242. P. 241–246.
15. Liquid Chromatography for the Determination of Mycotoxins in Foods / R. Romero-González, A. Garrido Frenich, J.L. Martínez Vidal [et al.] // J. Сhromatogr. 2011. Vol. 1218. P. 1477.
16. Determination of aflatoxins in cereal flours by solid-phase microextraction coupled with liquid chromatography and post-column photochemical derivatization-fluorescence detection
/ M. Quinto, G. Spadaccino, C. Palermo, D. Centonze // J. Chromatogr. A. 2009. Vol. 1216. P. 8636.
17. Tarter E.J., Hanchay J.P., Scott P.M. Improved liquid chromatographic method for determination of aflatoxins in peanut butter and other commodities // J. Assoc. Off. Anal. Chem. 1984. Vol. 67. P. 597.
18. Environmental and chemical carcinogenesis / G. Wogan, S. Hecht, J. Felton, A. Conney, L. Loeb // Seminars in Cancer Biology. 2004. Vol. 14. P. 473-486.
19. Simultaneous determination of pesticide residues, mycotoxins and plant toxins in soya meal samples employing UHPLC-MS / M. Zachariasova, J. Hajslova, M. Kostelanska [et al.] // Anal.Сhim. Аcta. 2008. V. 625. P. 77.
20. Human skin penetration of selected model mycotoxins // Toxicology. Vol. 301 (1-3). P. 21–32. DOI:10.1016/ j.tox.2012.06.012. PMID 22749975.
Снижение риска гепатокарциномы с помощью лакто- и пропионовокислых бактерий
Пропионовокислые бактерии и лактобациллы снижают риск рака печени
Пробиотическая добавка снижает биомаркер повышенного риска развития рака печени у молодых мужчи н из Южного Китая
Афлатоксины – самая опасная группа микотоксинов для человека и животных, обладают сильнейшим канцерогенным действием. Этот микотоксин является мощным гепатотропным ядом, который поражает клетки печени.
Негативное воздействие афлатоксинов на организм проявляется: канцерогенным действием – способствует развитию онкологических заболеваний печени; мутагенным действием – вызывает мутации; тератогенным действием – приводит к порокам эмбрионального развития.
В процессе приготовления пищи они не разрушаются. Встречаются в сырье, богатым крахмалом, – пшеница, овес, ячмень, рожь, рис, кукуруза; зафиксированы случаи наличия микотоксина в продуктах животного происхождения (молоко, мясо).
Проблема микотоксинов как потенциальных загрязнителей продуктов питания имеет особую значимость. Чтобы избежать распространения плесневых грибов необходимо уделять особое внимание профилактическим мерам и борьбе с плесневыми грибами. Основной задачей служб, контролирующих качество сельскохозяйственной и любой другой пищевой и кормовой продукции, является выявление наличия микотоксинов и сравнение обнаруженного количества с существующими во многих странах нормативами предельного содержания.
Дизайн: Девяносто здоровых молодых людей из Гуанчжоу, Китай, были случайным образом распределены на 2 группы; одна группа получила смесь штаммов Lactobacillus rhamnosus LC705 и Propionibacterium freudenreichii subsp. shermanii 2 раза/сут в течение 5 недель, а другая группа получала препарат плацебо. Испытуемые сдавали 4 образца мочи: в исходном состоянии, через 3 и 5 недель после начала приема добавок и в конце 5-недельного постинтервенционного периода.
Заключение: пробиотическая добавка снижает биологически эффективную дозу воздействия афлатоксина и тем самым может предложить эффективный диетический подход для снижения риска развития рака печени.
ВСТУПЛЕНИЕ
Гепатоцеллюлярная карцинома (в просторечии рак печени ) — наиболее распространённая первичная злокачественная опухоль печени. Результат малигнизации (злокачественной трансформации) гепатоцитов. Заболеваемость раком печени, т.е. гепатоцеллюлярной карциномой ( ГЦК ), широко варьируется во всем мире. У мужчин самые высокие показатели заболеваемости наблюдаются в Восточной Азии, особенно в Китае, где ГЦК является третьей по распространенности причиной смерти от рака (1). Хроническая инфекция вирусом гепатита В (HBV) является самым сильным фактором риска развития ГЦК во всем мире (2, 3). Однако популяции с одинаковой распространенностью HBV-инфекции имеют различную частоту встречаемости ГЦК (3), что говорит о наличии других важных факторов риска.
Примечание редактора:
Рис.2. Афлатоксин В1 в продуктах
Можно задаться вопросом, почему в исследовании использовали смесь штаммов лакто- и пропионовокислых бактерий?
Вероятно, это связано с желанием гарантированно получить детоксицирующий эффект, т.к. обе бактерии проявляли способность связывания и вывода из организма афлатоксин В1. Причем об этой способности пропионовокислых бактерий было известно ранее, тогда как необходимые штаммы лактобацилл были выделены самими исследователями.
В ниже представленном списке даются ссылки на исследования, в которых показан детоксицирующий эффект пропионибактерий в отношении афлатоксина В1:
Что же качается лактобацилл, то исследователи данной работы указали следующее:
Наша предыдущая работа с >250 штаммами молочнокислых бактерий, выделенных либо из молочных продуктов, либо из здоровой микробиоты человека, показала, что 2 штамма лактобацилл Lactobacillus rhamnosus, LGG и LC705 (оба обладают пробиотическими свойствами), были наиболее эффективными штаммами в связывании ряда микотоксинов, включая афлатоксины (16–19). Одна жизнеспособная бактерия способна связывать >10 7 молекул афлатоксина B1 (AFB1), и связывание, по-видимому, происходит на поверхности бактерий преимущественно посредством гидрофобных взаимодействий между молекулами AFB1 и углеводными и белковыми компонентами бактериальной клеточной стенки (20). Результаты in vitro привели к исследованию способности этих штаммов связывать AFB1 in vivo и проверке, была ли сила связывания достаточной для снижения биодоступности AFB1. Оба штамма Lactobacillus rhamnosus GG и LC705 связывали AFB1 и снижали его поглощение (снижение поглощения AFB1 тканями двенадцатиперстной кишки на 74%) из петель двенадцатиперстной кишки цыплят 1-недельного возраста (21).
ПРЕДМЕТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Изучаемая популяция
Исследуемая популяция была родом из Гуанчжоу, провинция Гуандун, которая расположена на юге Китая, где воздействие афлатоксина через прием пищи является обычным явлением. Студенты мужского пола (n = 300) из Университета Сунь Ятсена были обследованы на наличие гидроксилированного метаболита AFB1 афлатоксина М1 (AFM1), в точечном образце мочи. Из тех, у кого обнаруживалась концентрация AFM1 (>0,008 нг/мл), для проведения вмешательства было отобрано 90 человек. Поскольку субъекты были отобраны на основе определяемых концентраций AFM1 в моче, они не отражают общее воздействие афлатоксина на население в регионе, а на группу, подвергшуюся воздействию.
Субъекты прошли полное медицинское обследование, включая следующие: история болезни, статус курения, физикальное обследование, рутинные гематологические и клинические биохимические тесты на функцию печени и почек, а также тесты на антигены вируса гепатита B (14 субъектов дали положительный результат на вирус гепатита B). Клинические химические измерения и определение поверхностного антигена гепатита В проводились в Университете Сунь Ятсена в соответствии со стандартными протоколами. Исключение субъектов основывалось на ненормальных гематологических показателях и отдаленных концентрациях AFM1 ( 20 нг/мл). Потребление источников афлатоксинов в рационе оценивали с использованием опросника по частоте приема пищи. Все предметы проживали в студенческих общежитиях и потребляли основное питание (завтрак, обед и ужин) в студенческом ресторане, управляемом университетом. Антибиотики или традиционные китайские лекарства и травы, или и то и другое, использовались в течение предыдущих 2 месяцев 21 студентом (25%), которые были равномерно распределены между 2 группами исследования. Протокол был одобрен Этическими комитетами Университета Куопио (Финляндия) и Университета Сунь Ятсена (Китай). Применяемые процедуры соответствовали Хельсинкской декларации 1975 года, пересмотренной в 1983 году.
Дизайн исследования
Дизайн исследования представлял собой рандомизированное двойное слепое плацебо-контролируемое исследование с двумя параллельными группами. Испытуемые были случайным образом распределены на 2 группы (n = 45 в каждой группе); одна группа получала пробиотический препарат, а другая-плацебо-препарат. Испытуемые получали письменные и устные указания принимать по 2 капсулы в день непосредственно перед основными приемами пищи (завтрак и ужин). Пробиотический препарат содержал смесь штаммов Lactobacillus rhamnosus LC705 и Propionibacterium freudenreichii subsp. shermanii (1:1, wt:wt) в дозе 2-5 × 10 10 колониеобразующих единиц/сут. Капсулы плацебо содержали только целлюлозу. Используемые пробиотические штаммы относятся к классу, который обычно признается безопасным и широко используется в производстве различных молочных продуктов.
В течение 5-недельного интервенционного периода испытуемые употребляли свою обычную диету. Потребление пищевых источников афлатоксинов оценивалось с помощью структурированного пищевого частотного опросника. Испытуемые сдавали один ранний утренний анализ мочи в течение 3-й и 5-й недель интервенционного периода и после 5-недельного постинтервенционного периода. Соответствие протоколу исследования оценивалось на основании наличия Lactobacillus rhamnosus LC705 в пробах кала, взятых в те же точки времени, что и пробы мочи.
Анализы на афлатоксин
Статистический анализ
Результаты
Таблица 1. Еженедельный прием основных продуктов питания в рационе здоровых китайских студентов мужского пола, получавших либо пробиотик, либо плацебо 1