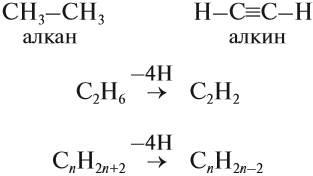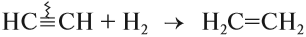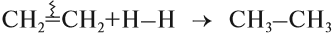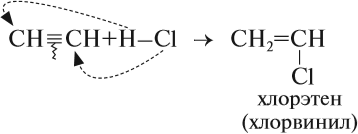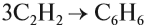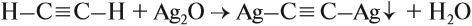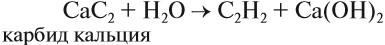алкины в жизни человека
Алкины. Свойства алкинов.
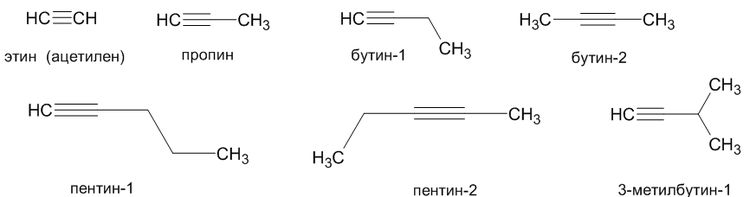
Алкины – это непредельные углеводороды, молекулы которых содержат тройную связь. Представитель – ацетилен, гомологи его:
Строение алкинов.
Атомы углерода, которые образуют тройную связь, находятся в sp—гибридизации. σ-связи лежат в плоскости, под углом 180 °С, а π-связи образованы путем перекрывания 2х пар негибридных орбиталей соседних атомов углерода.
Изомерия алкинов.
Для алкинов характерна изомерия углеродного скелета, изомерия положения кратной связи.
Пространственная изомерия не характерна.
Физические свойства алкинов.
В нормальных условиях:
С17 и более – твердые вещества.
Температуры кипения алкинов выше, чем у соответствующих алканов.
Растворимость в воде незначительна, немного выше, чем у алканов и алкенов, но все равно очень мала. Растворимость в неполярных органических растворителях высокая.
Получение алкинов.
1. Отщепление 2х молекул галогенводорода от дигалогенавконов, которые находятся либо у соседних атомов углерода или у одного. Отщепление происходит под воздействием спиртового раствора щелочи:
2. Действие галогеналканов на соли ацетиленовых углевородородов:
Реакция протекает через образование нуклеофильного карбаниона:
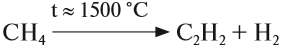
3. Крекинг метана и его гомологов:
В лаборатории ацетилен получают:
Химические свойства алкинов.
Химические свойства алкинов объясняет наличие тройной связи в молекуле алкина. Типичная реакция для алкинов – реакция присоединения, которая протекает в 2 стадии. На первой происходит присоединение и образование двойной связи, а на второй – присоединение к двойной связи. Реакция у алкинов протекает медленнее, чем и алкенов, т.к. электронная плотность тройной связи «размазана» более компактно, чем у алкенов, и поэтому менее доступна для реагентов.
1. Галогенирование. Галогены присоединяются к алкинам в 2 стадии. Например,
Алкины также как алкены обесцвечивают бромную воду, поэтому эта реакция является качественной и для алкинов.
2. Гидрогалогенирование. Галогенводороды присоединяются к тройной связи несколько тружднее, чем к двойной. Для ускорения (активации) процесса используют сильную кислоту Льюиса – AlCl3. Из ацетилена при таких условиях модно получить винилхлорид, который идет на производства полимера – поливинилхлорида, имеющего важнейшее значение в промышлености:

Если же галогенводород в избытке, то реакция (особенно у несимметричных алкинов) идет по правилу Марковникова:
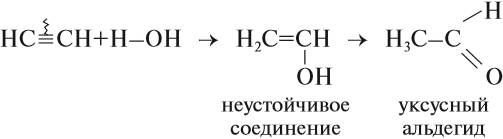
3. Гидратация (присоединение воды). Реакция протекает только в присутствии солей ртути (II) в качестве катализатора:
На 1ой стадии образуется непредельный спирт, в котором гидроксигруппа находится у атома углерода, образующего двойную связь. Такие спирты называются виниловыми или фенолами.
Отличительная черта таких спиртов – неустойчивость. Они изомеризуются в более стабильные карбонильные соединения (альдегиды и кетоны) вследствие переноса протона от ОН-группы к углероду при двойной связи. При этом π-связь рвется (между атомами углерода), и образуется новая π-связь между атомомами углерода и атомом кислорода. Такая изомеризация происходит из-за большей плотности двойной связи С=О по сравнению с С=С.
Эта реакция носит названия – реакции Кучерова.
4. Те алкины, которые имеют концевую тройную связь, могут отщеплять протон под действием сильных кислотных реагентов. Такой процесс обусловлен сильной поляризацией связи 
Причиной поляризации служит сильная электроотрицательность атома углерода в sp-гибридизации, поэтому алкины могут образовывать соли – ацетилениды:
Ацетилениды меди и серебра легко образуются и выпадают в осадок (при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди). Эти реакции являются качественными на концевую тройную связь:
Полученные соли легко разлагаются под действием HCl, в результате выделяется исходный алкин:
Поэтому алкины легко выделить из смеси других углеводородоров.
5. Полимеризация. При участии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий, могут образовываться различные продукты. Например, под воздействием хлорида меди (I) и хлорида аммония:
Винилацетилен (полученное соединение) присоединяет хлороводород, образуя хлорпрен, который служит сырьем для получения синтетического каучука:
6. Если ацетилен пропускать через уголь при 600 ºС, получают ароматическое соединение – бензол. Из гомологов ацетилена, получают гомологи бензола:
7. Реакция окисления и восстановления. Алкины легко окисляются перманганатом калия. Раствор обесцвечивается, т.к. в исходном соединении есть тройная связь. При окислении происходит расщепление тройной связи с образованием карбоновой кислоты:
В присутствие металлических катализаторов происходит восстановление водородом:
Применение алкинов.
На основе алкинов производят много различных соединений, имеющих широкое применение в промышленности. Например, получают изопрен – исходное соединения для производства изопренового каучука.
Ацетилен используют для сварки металлов, т.к. процесс его горения весьма экзотермичный.
История открытия
В 1836 году двоюродный брат химика-англичанина Гемфри Дэви — Эдмунд — получил первый ацетилен.
Для этого он нагрел древесный уголь вместе с уксуснокислым калием, добавил в раствор воду. В результате образовался карбид калия. Дэви назвал полученный газ двууглеродистым водородом.
Второй раз вещество получил немецкий врач Велер в 1862 году. Он воздействовал на карбид калия водой, в результате получил ацетилен. А через год французский химик Бертло провел ряд других опытов. Он пропустил водород над графитовыми электродами, которые предварительно раскалил электрической дугой. Назвал он образовавшийся газ ацетиленом. Это слово состоит из двух корней латинского и греческого языков, в переводе означает уксусное дерево. А в русском языке название появилось благодаря Дмитрию Менделееву.
В конце девятнадцатого века изучением непредельных углеводородов занялся Фаворский, а в 1895 году Ле Шателье обнаружил одно интересное свойство, которым они обладают. Ацетилен во время сгорания в кислороде дает горячее пламя, благодаря чему его впоследствии начали использовать в сварке и резке металлов. Согласно номенклатуре, названия веществ образуются как производные от алканов путем замены суффикса.
Простейший непредельный углеводород — это этин, он превращается в этан. Гомологический ряд алкинов включает:
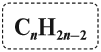
У всего структурного ряда алкинов формула общая — С (n) Н (2 n — n).
Физические свойства
У алкинов есть определенные физические свойства. Они могут находиться в нескольких агрегатных состояниях:
Вещества закипают при температуре, которая гораздо выше той, что необходима для нагрева других производных. Растворимость в воде очень мала, хотя и больше, чем у алканов и алкенов. Но алкины легко расщепляются на атомы в неполярных органических жидкостях.
Есть несколько способов получения углеводорода, их разделяют на промышленные и лабораторные. В условиях производства используют карбидный метод, пиролиз или крекинг.
При первом нужно в электрической печи прокалить смесь кокс с оксидом кальция, постоянно поддерживая температуру 1800−2000 градусов. В результате получится карбид кальция, который вступает во взаимодействие с водой, образуя ацетилен и гидроксид.
В лабораторных условиях ацетилен добывают с помощью прямого синтеза. Это исторический метод, который применял еще Бертло в 1863 году. Он нагревал водород с углеродом при большой температуре. Кекуле в 1864 получал вещество с помощью электролиза малеата натрия и фумарата. А также можно поддать его реакции дегидрогалогенирования, а в качестве агента-галогеналкана лучше использовать аммиачный амид натрия. В лабораториях ученые алкилируют ацетилен, а также используются группировки Кучерова, Кори-Фукса, Фрича-Буттенберга-Вихелля.
Химические особенности
Алкины вступают в реакции с другими веществами лучше, чем алкены и алканы. Терминальные соединения, у которых тройная связь расположена в конце цепи, подвергаются замещениям. Водород с атомами углерода, гибридизированными в sp, могут проходить протонизацию, благодаря чему они и получают кислую природу.
Основным химические свойства алкинов:
При гидрировании активные катализаторы никель или платина восстанавливают алкины до состояния алканов, а процесс с гомологами ацетилена дает цис-олефины. Галогенирование происходит в два этапа, водород вступает в реакцию с хлором. Во время гидрогалогенирования на первом шаге образуется хлористый винилацетилен, на втором — дихлорэтан. Уравнение составляется по правилу Марковникова.
Гидратация образует ацетальдегид и кетоны из его гомологов, процесс протекает по реакции Кучерова. Спирты и меркаптаны присоединяются к водороду под воздействием едкого калия и монозамещенных ацетиленов. Для уксусной кислоты потребуется гетерогенный катализ, полученный винилацетат полимеризируется. К нему присоединяется синильное вещество, что образует акрилонитрил.
Для димеризации необходимы соли Купрума, затем происходит взаимодействия с соляной кислотой. Так получают хлоропреновый каучук, изобутилен, катализатором выступает никель с хлоридом цинка. Тримеризация требует активный уголь и температуры в 600 градусов, в результате образуется бензол.
На тетрамеризацию влияют комплексные соли никеля, а для окисления нужно использовать раствор пергаманата калия и карбоновые кислоты. Качественный раствор становится розовым, но через несколько минут обесцвечивается. При соблюдении мягких условий окисления связи не разрываются. Продуктом реакции становится щавелевая кислота, но в нейтральной среде процесс можно остановить на стадии появления дикетонов. Если алкины горят, то они окисляются полностью до воды и углекислого газа. В результате экзотермической реакции выделяется много тепла.
Взаимодействия с веществами
Изомеры вступают в реакцию с другими веществами. Они взаимодействуют с разными солями и щелочами:
Качественная реакция с солями тяжелых металлов приводит к появлению нерастворимых осадков ацетиленидов. Монозамещенные гомологи взаимодействуют при этом с оксидами полухлористой меди и серебра. Первое вещество белое или бесцветное, второе — красно- или желто-бурое. Ацетилениды могут взрываться, под действием кислот происходит их разложение на металлические соли и ацетилен.
Гомологи вступают в реакцию со щелочными металлами, которые берут из жидкого аммиака. Производные натрия действуют по правилам реактива Иоцича или Ревьяра, поэтому их часто используют в органическом синтезе. Под небольшим давлением вещество взаимодействует с едким калием и кетонами, такую реакцию изучал Фаворский.
Ацетилинед меди также реагирует с гомологами и дает в результате бутиндиол. Перегруппировка Фаворского происходит только во время нагревания ацетиленов с натрием, тройная связь из центра цепи переместится в конец.
А если она изначально занимает это положение, то во время реакции со спиртовым щелочным раствором перейдет в середину молекулы.
Применение углеводородов
Из всех непредельных углеводородов ацетилен имеет наибольшее применение. Он используется как один из главных видов химического сырья. Вещество применяют для синтеза нескольких видов продуктов:
При хлорировании ацетилена получаются дихлорэтилен, тетрахлорэтан и трихлорэтилен, которые используют в качестве сильных растворителей. Акрилонитрил добывают при изомерии вещества с циановодородом, так образуется полиакрилонитрил. Полиакриламид можно получить в результате конденсации ацетилена с аммиаком и углекислым газом. Сырье для уретановых полимеров делают из тетрагидрофурана.
Поливинилхлорид получается в результате гидрохлорирования вещества, а уксусная кислота превращает его в характерный поливинилацетат. Класс альдегидов образуется при гидратации ацетилена, что дает возможность изготовить ацетон, уксусную кислоту и другую продукцию. Синтез полимеров осуществляется с помощью винилацетилена — результата димеризации вещества. Каучуки содержат хлоропрен и бутадиен.
Ацетилен во время горения выделяет тепло, его используют для сварки и резки тугоплавких металлов. В начале прошлого века применялись светильники, сырьем для которых служил карбид кальция — дешевое вещество. Их можно было увидеть на вечерних улицах, в домах, на водном и железнодорожном транспорте. Сегодня их используют туристы как походное снаряжение, хотя изготовляют в небольших количествах.
Алкины в жизни человека
Из алкинов особое значение имеет ацетилен.
Ацетилен из-за достигаемой высокой температуры пламени широко используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена).
При его горении в кислороде пламя его достигает температуры 2800 0 С.
Простота получения, относительно низкая стоимость, имическая активность сделали ацетилен важнейшим сырьем для многочисленных промышленных синтезов:
1. Хлорированием ацетилена получают дихлорэтилен и трихлорэтилен, применяемые в качестве растворителей. А также получают тетрахлорэтан, который применяется как растворитель (жиров, смол, каучука и др.), для получения фреонов, как экстрагент, в медицине.
2. Димеризацией ацетилена с последующим гидрохлорированием получают хлоропрен – мономер для хлоропренового каучука.
3. Гидрохлорированием ацетилена получают винилхлорид – мономер для получения поливинилхлорида (основа линолеума, разнообразной упаковки, труб и др.).
4. Гидратацией ацетилена получают уксусный альдегид, идущий на получение уксусной кислоты.
5. Присоединением циановодорода к ацетилену получают акрилонитрил – мономер для получения синтетического волокна «нитрон».
6. Присоединением к ацетилену уксусной кислоты получают винилацетат – мономер для получения поливинилацетата (ПВА).
Поливиилацетат – основа для клеев, водоэмульсионных и акриловых красок, используется в производстве лаков.
Нахождение в природе и физиологическая роль алкинов
Реферат
Тема: алкины
Уч-ся гр.№ 54
Попова Наталия
Преподаватель
Ордынское 2012
2. история открытия
3. номенклатура алкинов
4. структура тройной связи
5. физические свойства
6. нахождение в природе и физиологическая роль алкинов
7. идентификация алкинов
Алкины
История открытия
Номенклатура алкинов
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил».
Ниже представлены некоторые представители алкинов и их названия:
Различают внутреннюю тройную связь (пример: бут-2-ин) и концевую (пример: бут-1-ин).
Гомологический ряд алкинов:
Структура тройной связи
Физические свойства
| Физические свойства некоторых алкинов | |||||
| № | Название | Формула | Т плавления,°С | Т кипения,°С | Плотность, d 20 4 |
| Этин | С2H2 | −81,8 | −75 | 0,565* | |
| Пропин | C3H4 | −101,5 | −23 | 0,670* | |
| Бут-1-ин | HC≡C−CH2CH3 | −125,9 | 8,1 | 0,678* | |
| Бут-2-ин | CH3−C≡C−CH3 | −32,3 | 27,0 | 0,694 | |
| Пент-1-ин | HC≡C−C3H7 | −90,0 | 39,3 | 0,695 | |
| Пент-2-ин | CH3−C≡C−C2H5 | −101,0 | 55,0 | 0,714 | |
| 3-Метилбут-1-ин | HC≡C−CH(CH3)CH3 | н/д | 28,0 | 0,665 | |
| Гекс-1-ин | HC≡C−C4H9 | −132,4 | 71,4 | 0,719 |
Нахождение в природе и физиологическая роль алкинов
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги
Идентификация алкинов
Качественной реакцией на алкины с концевой тройной связью является взаимодействие с аммиакатом серебра или меди (подробнее смотри подраздел: Образование алкинидов ).
Для подтверждения наличия тройной связи в соединении используют методы спектроскопии. ИК спектры асимметричных алкинов имеют характеристические полосы при 2260—2100 см −1 (валентные колебания тройной связи), 3310-3300 см −1 (колебания С-Н связей) и деформационные колебания C-H при 700—610 см −1 [
Применение
Ацетилен использует для синтеза следующих продуктов:
Литература
· Миллер С. Ацетилен, его свойства, получение и применение / Пер. с английского. — М.: «Наука», 1969. — 680 с.
· Общая органическая химия. Стереохимия, углеводороды, галогенсодержащие соединения = Comprehensive Organic Chemistry / Под ред. Д.Бартона и В.Д.Оллиса. — М.: «Химия», 1981. — Т. 1. — С. 257-270.
· Темкин О.Н., Шестаков Г.К., Трегер Ю.А. Ацетилен: Химия. Механизмы реакций. Технология. — М.: «Химия», 1991. — 416 с. — ISBN 5724505746
· Темкин О.Н., Флид Р.М. Каталитические превращения ацетиленовых соединений в растворах комплексов металлов. — М.: «Наука», 1968. — 212 с.
· Трофимов Б.А. Гетероатомные производные ацетилена. — М.: «Наука», 1981. — 319 с.
· Henning Hopf Polyynes, Arynes, Enynes, and Alkynes / Houben-Weyl Methods of Organic Chemistry. Series Science of synthesis (V. 43). — 5. — Thieme Medical Pub, 2008. — 850 p. — ISBN 9783131189615
Урок 20. Алкины
Определение. Гомологический ряд, номенклатура, изомерия
Алкины — это нециклические углеводороды, в молекулах которых есть одна тройная связь, а остальные связи простые.
Алкины относят к группе непредельных ненасыщенных углеводородов. Для того чтобы вывести общую формулу гомологического ряда алкинов, сравним состав алканов и алкинов:
Таким образом, алкины образуют гомологический ряд, общая формула которого
Вопрос. Какие ещё углеводороды имеют такую же общую формулу гомологического ряда?
Значит, алкины и алкадиены с одинаковым числом атомов углерода являются изомерами.
Первый член гомологического ряда С2Н2 называется ацетилен. Поэтому алкины относятся к ацетиленовым углеводородам.
Вопрос. Почему в названиях ацетиленовых углеводородов появился суффикс ИН? (См. урок 17.7.)
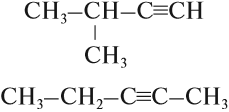
Задание 20.1. Составьте молекулярную и графическую формулы алкина с n = 4.
Выполнив последнее задание, вы убедитесь, что для этого алкина можно составить две графические формулы:
Значит, изомерия алкинов связана с положением тройной связи в молекуле. Кроме того, изомерия связана со строением углеводородного радикала:
Задание 20.2. Составьте молекулярные формулы этих соединений и убедитесь, что это изомеры. Назовите эти вещества.
Строение молекул
В состав молекулы любого алкина входит одна тройная связь, поэтому особенности свойств этих соединений будут связаны с особенностями тройной связи. Это сложная, неоднородная связь. Её составляют одна простая σ-связь и две π-связи.
Вопрос. Какая из этих связей легче разрушается в химических реакциях? Почему?
Значит, как и у алкенов, в химических реакциях будет прежде всего разрушаться менее прочная π-связь. Алкины тоже легко вступают в химические реакции, но, в отличие от алкенов, большинство реакций за счёт π-связи идут в две стадии: сначала разрывается одна π-связь, потом вторая π-связь. Характерной реакцией является реакций присоединения, хотя возможны и другие типы реакций.
Свойства алкинов
Физические свойства
По физическим свойствам алкины мало отличаются от алкенов и алканов. Так, простейший алкин ацетилен — газ без вкуса и запаха, плохо растворимый в воде. Среди гомологов ацетилена есть и жидкие, и твёрдые вещества: чем больше молекулярная масса, тем выше температуры кипения и плавления алкинов.
Химические свойства
Для алкинов, как и для алкенов, характерны реакции присоединения. Они идут в две стадии:
Вопрос. Возможна ли для полученного соединения реакция присоединения?
Поскольку полученный этилен содержит двойную связь, возможна вторая стадия этого процесса:
Вопрос. Возможна ли реакция присоединения для полученного вещества? Почему?
Таким образом, в результате реакции гидрирования из ацетилена можно получить и этилен, и этан. Всё зависит от условия процесса и от соотношения исходных веществ. Например, реакцию присоединения хлороводорода к ацетилену часто прерывают на первой стадии:
Дело в том, что хлорвинил применяется для получения полимера полихлорвинила.
Задание 20.3. Составьте уравнения реакции полимеризации хлорвинила.
Изделия из полихлорвинила (–СНСl–СН2–)n имеют разнообразное применение.
Так, полихлорвинил (ПХВ, или ПВХ) является основой для получения искусственной кожи, различной посуды одноразового пользования, полимерной тары, клеёнок, отделочных материалов и т. д. Многие пластмассовые изделия, которые мы используем каждый день, обивка салонов автомобилей, вагонов, самолётов, — сделаны из ПВХ. Он также используется для электроизоляции проводов.
Аналогично идут и другие реакции присоединения. Например, ацетилен, как и этилен, обесцвечивает бромную воду. Кроме того, он обесцвечивает и раствор перманганата калия, т. е. вступает в реакции окисления.
Задание 20.4. Составьте уравнения реакции ацетилена с бромом.
Таким образом, ацетилен тоже даёт качественные реакции на π-связь. Поэтому правильнее говорить, что реакции обесцвечивания бромной воды и перманганата калия — это качественные реакции на кратную связь. Другими словами, при помощи этих реакций можно обнаружить непредельные соединения, содержащие кратную связь, которая содержит π-связь.
Большое практическое значение имеет реакция присоединения воды к ацетилену — гидратация ацетилена. Поскольку эту реакцию открыл и изучил российский ученый М. Г. Кучеров*, она носит название «реакция Кучерова»:
* Кучеров Михаил Григорьевич (3.06.1850–26.06.1911) — русский химик-органик. Открыл (1881) реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений.
Уксусный альдегид нужен для получения уксусной кислоты. Ацетилен горит.
Задание 20.5. Составьте уравнение реакции горения ацетилена.
При неполном окислении ацетилена (раствором перманганата калия) образуется смесь кислот.
Для ацетилена возможна реакция полимеризации, причём в эту реакцию может вступать небольшое число молекул. Так, при тримеризации ацетилена (соединяются три молекулы) образуется циклическое соединение — бензол:
Для алкинов характерна подвижность атомов водорода у тройной связи. За счёт этих атомов происходят реакции замещения таких атомов водорода:
Аналогичная реакция замещения происходит и с оксидом меди (I), и со щелочными металлами. В результате обеих реакций выделяется осадок, поэтому их считают качественными реакциями на алкины, в молекулах которых имеется атом водорода у тройной связи. Такая же реакция замещения происходит и со щелочными металлами.
Получение и применение ацетилена
Ацетилен в небольших количествах входит в состав природных газов. Его получают крекингом метана:
В небольших количествах, например для сварки металлов и в лаборатории, его получают из карбида кальция:
Ацетилен, полученный карбидным способом, используется для сварки и резки металлов, поскольку температура пламени автогена (горение ацетилена в кислороде) достигает 3000 °C.
Ацетилен и его производные используются для получения пластмасс, каучуков, уксусной кислоты, растворителей.
Выводы
Алкины — это непредельные углеводороды, содержащие тройную связь. Для таких веществ характерны реакции: