Архитектоника это в медицине что
Архитектоника это в медицине что
а) Терминология. Нарушение архитектоники легких:
— Смещение бронхов, сосудов, междолевых щелей или перегородок вследствие диффузного или локального фиброза
— Типично для интерстициального фиброза
б) Рентгенография:
— Ретикулярные затемнения; затемнения по типу узелков и объемных образований
— Объемное уменьшение легких
— Смещение корней легких вследствие объемного уменьшения легких
— Бронхоэктазы вследствие объемного уменьшения легких
в) КТ:
— Смещение легочных сосудов и бронхов вследствие фиброза легочной ткани
— Ретикулярные затемнения, утолщение междольковых перегородок, внутридольковые линии
— фиброателектаз; может проявляться узелками или объемным образованием
— Тракционные бронхоэктазы, изменения в легком по типу «пчелиных сот»
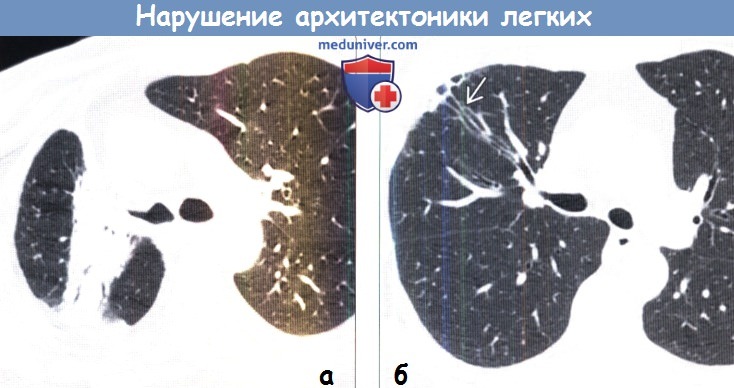
При КГ с контрастным усилением определяется выраженное объемное уменьшение верхней доли правого легкого со сближением сосудов и формированием бронхоэктазов. Такое нарушение архитектоники легких можно охарактеризовать как фиброателектаз.
(б) У женщины 54 лет после лучевой терапии по поводу рака правой молочной железы при нативной КТ в верхней доле правого легкого определяется субплевральный постлучевой фиброз с формированием тракционных бронхоэктазов и бронхиолоэктазов.
г) Дифференциальная диагностика:
• Фиброз легочной ткани:
— Идиопатический легочный фиброз (ИЛФ)
— Неспецифическая интерстициальная пневмония (НСИП)
• Поздние стадии саркоидоза
• Хронический гиперчувствительный пневмонит
• Лучевой фиброз
д) Морфология:
• Интерстициальный фиброз легочной ткани
• Формирование «пчелиных сот»
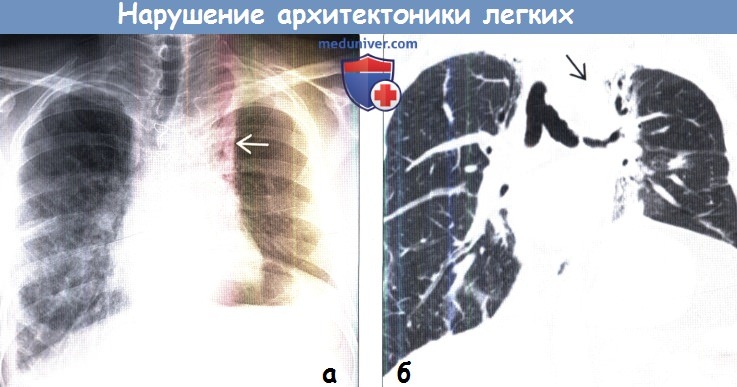
(б) У того же пациента при нативной КТ на реконструкции в коронарной плоскости визуализируются объемное уменьшение левого легкого и нарушение архитектоники парамедиастинальных отделов обоих легких с наличием воздушной бронхограммы и кальцификатов в средостении вследствие лечения лимфомы.
Редактор: Искандер Милевски. Дата публикации: 22.1.2019
Архитектоника это в медицине что
РНЦХ им. акад. Б.В. Петровского РАМН
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
ФГБУ «Российский научный центр хирургии им. акад. Б.В. Петровского» РАМН, Москва
Архитектоника, нормальная и патологическая физиология сосудистой стенки
Журнал: Кардиология и сердечно-сосудистая хирургия. 2014;7(6): 59-63
Белов Ю. В., Комаров Р. Н., Винокуров И. А. Архитектоника, нормальная и патологическая физиология сосудистой стенки. Кардиология и сердечно-сосудистая хирургия. 2014;7(6):59-63.
Belov Iu V, Komarov R N, Vinokurov I A. Architectonics, normal and pathological physiology of the vascular wall. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2014;7(6):59-63.
РНЦХ им. акад. Б.В. Петровского РАМН
РНЦХ им. акад. Б.В. Петровского РАМН
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
ФГБУ «Российский научный центр хирургии им. акад. Б.В. Петровского» РАМН, Москва
Для более полного понимания сути проблемы и патогенеза развития заболеваний крупных сосудов необходимо подробно знать анатомо-физиологические аспекты строения сосудистой стенки. Она состоит из трех оболочек: интимы (внутренняя оболочка), медии (средняя оболочка) и адвентиции (наружная оболочка). Каждая из них несет определенную функцию и, как следствие, имеет свою, строго индивидуальную, структуру.
Адвентиция обеспечивает сосудистую стенку (СС) кислородом и питательными веществами, поэтому она пронизана множеством мелких сосудов, которые ее питают (vasa vasorum) и благодаря которым удаляются избыточные продукты естественного метаболизма и элементы, участвующие в патологических процессах в СС. С другой стороны, по vasa vasorum разносятся патологические микроорганизмы, которые могут поражать СС и благодаря которым происходит накопление клеточных элементов, борющихся с инфекцией и воспалительным процессом как таковым (макрофаги, нейтрофилы, лимфоциты). Таким образом осуществляется реализация механизма «снаружи внутрь», по которому обеспечивается защита СС от какого-либо воспалительного процесса [21].
Следующей оболочкой является медия. Ее основная функция каркасная, поэтому она достигает 80% общей толщины СС. Именно на эту оболочку приходится наибольшее гемодинамическое напряжение, и, чтобы его компенсировать, она содержит большое количество эластина и коллагена, а также гладкомышечные клетки (ГМК). Густое скопление эластических волокон находится на границе между интимой и медией, а также медией и адвентицией, тем самым образуя внутреннюю и наружную пластинки, пространство между ними пронизано большим количеством ГМК, перекрещивающихся с эластином и коллагеном. Стоит отметить, что наиболее толстый слой эластических волокон находится в восходящей аорте и ее дуге (артерии эластического типа) и постепенно уменьшается к бифуркации (артерии мышечно-эластического типа); в противоположность этому происходит увеличение числа ГМК. Такие изменения необходимы для поддержания достаточно высоких цифр артериального давления (АД) и, соответственно, проталкивания крови в нижележащие отделы организма.
После ознакомления с общим планом строения СС необходимо перейти к морфологическим элементам каждого слоя, так как именно изменения в этих элементах и приводят к развитию патологического процесса.
1. Эндотелий сосудов
Для питания крупных артерий, на которые приходится основная гемодинамическая нагрузка, необходимы структуры, содержащие множество капилляров, благодаря которым происходил бы забор крови из кровеносного русла для питания сосудистой стенки. Таким элементом является эндотелий. Он практически полностью состоит из капилляров, которые обеспечивают макромолекулярный транспорт и диффузию крови к базальной мембране и медии.
Долгое время считалось, что эндотелий является гомогенным, инертным, пассивным контейнером для крови, но исследования показали его взаимодействие с клетками иммунной системы и молекулами, которые обеспечивают поддержание АД, проницаемости сосудистой стенки и гомеостаза. Это привело к более полному пониманию активной роли эндотелия в здоровой СС и при ее патологии [3, 12, 13, 17].
Следующим свойством эндотелия является его избирательная проницаемость для жидкостей и питательных веществ к средней оболочке артерии. При этом происходят секреция, фильтрация и абсорбция воды, ионов и солей [17, 37]. Прерывается эндотелий только в костном мозге, селезенке и синусах печени. Через слой эндотелия непрерывно могут проходить элементы с диаметром от 1 до 4 нм, для более крупных элементов необходимы специальные транспорты, которые способствуют преодолению этого барьера [43].
Высвобождение NO происходит под действием ацетилхолина, вазопрессина, а в некоторых случаях в связи с сильным стрессом [16, 18]. Количество механизмов, влияющих на высвобождение NO, а тем самым расслабляющих гладкую мускулатуру сосудов велико, однако это компенсируется хорошей лабильностью реакции на такое высвобождение. Постоянное высвобождение NO стимулирует пролиферацию и миграцию ГМК [25], что приводит к ремоделированию сосудистой стенки в этой области.
Действуя на циклооксигеназу, PGI 2 осуществляет вазодилатацию за счет активации метаболического пути арахидоновой кислоты в эндотелии. Кроме того, такой же процесс происходит и в тромбоцитах, что препятствует их агрегации, но не влияет на адгезию [9, 28, 29, 35].
Эндотелий выступает как иммуномодулирующий орган. Кроме того, он обладает барьерной функцией. На него постоянно воздействуют бактериальные агенты, которые могут попасть в кровь, клетки иммунного воспаления (моноциты, макрофаги, нейтрофилы, лимфоциты), а также различные патогенетические молекулы (цитокины, хемокины и др). Эндотелий интенсивно поддерживает противовоспалительную среду, однако постоянное присутствие агрессора может нарушить его защитную функцию, вследствие чего начинает развиваться патологический процесс. Для своей защиты эндотелий способен вырабатывать различные цитокины, использовать растворимые в крови факторы, а также активировать гены цитопротективных агентов, таких как оксидредуктаза [43].
Важным является тот факт, что 1 раз активировав эти механизмы, эндотелий может быстро стимулировать противовоспалительные процессы, что определяется высоким числом цитокиновых и хемокиновых рецепторов, которые регулируют взаимодействие между лейкоцитами и эндотелиальными клетками [32]. В ответ на активацию и избыточный синтез провоспалительных элементов активируется механизм «down-регуляции», в результате которого происходит ограничение воспалительного ответа и, в конце концов, реакция прекращается, тем самым предотвращая неадекватную патологическую активацию в эндотелии.
Эндотелий играет важную роль в регуляции васкулогенеза, ангиогенеза и ремоделировании СС [40]. У здорового взрослого человека пролиферация в СС очень низкая, что создает стабильность сосудистого русла, посредником которой выступает эндотелий. Длительное влияние различных внешних факторов может нарушить стабильность эндотелия, это приводит к развитию гиперплазии интимы. Кроме того, через поврежденный эндотелий начинают проникать липиды с последующей инфильтрацией моноцитами и Т-лимфоцитами [38]. Вследствие этого процесса развивается атеросклероз.
2. Гладкомышечные клетки сосудов
Гладкомышечные клетки сосудов участвуют в поддержании АД, в адаптационных механизмах СС и в процессах ее восстановления. Преимущественно ГМК находятся в медии сосудов, при этом чем дистальнее находится артерия, тем большее количество ГМК содержится в ее стенке.
Интересно, что длительное воздействие клеточных элементов воспаления или активного кислорода на ГМК приводит к экспрессии различных факторов роста, а соответственно к пролиферации клеток. Из-за этого может происходить постоянный миогенез. Продукция и активация факторов роста осуществляются за счет эндотелиальных клеток, поэтому сдерживание гемодинамического напряжения происходит во взаимодействии двух структур [10, 11, 33]. Современная теория гласит, что ГМК являются клетками широкого спектра действия, которые несут функциональную нагрузку. Пластичность ГМК осуществляется за счет изменения структуры в ответ на агрессивные факторы окружающей среды.
На биологию ГМК влияет их фенотипически высокая изменчивость. Они состоят из множества нитей актина и миозина, что способствует их сокращению; на более глубоком уровне основой являются эндоплазматический ретикулум и комплекс Гольджи [6]. Фенотипическую изменчивость используют для объяснения гетерогенности и множества функций ГМК. На изменчивость ГМК в процессе их развития влияет множество факторов, начиная от повреждения экстрацеллюлярного матрикса (ЭМ), до прямого воздействия на них эндотелия.
Основные процессы, которые происходят в системе ГМК, имеют характерные особенности и подразделяются на несколько категорий: 1) восстановление и расширение; 2) дифференцировка; 3) ремоделирование. В результате происходит разделение нового сосуда на артерии и вены.
Наиболее интересны на практике процессы ремоделирования СС за счет изменения ГМК, так как они включаются не только в ангиогенезе, но и при патологических состояниях. Эти процессы начинают работать при активации факторов роста и, что важно, в ответ на физическое или химическое воздействие. Подобное влияние может оказывать, например, эндотелиальный сосудистый фактор роста. Из примеров физического воздействия можно описать увеличение тока крови и давления в сосуде. В этот момент происходит выброс NO для компенсации перерастяжения мышц. Ангиогенез также происходит под действием хронической гипоксии, за счет активации гипоксия-индуцированного фактора, что помогает регулировать данный процесс [7]. Таким образом, основным процессом, которым отвечают ГМК на любое внешнее раздражение, является ремоделирование СС.
Регуляция основной функции ГМК (поддержания тонуса сосудов) происходит под действием различных факторов (Анг-2, тромбин, протромбин и др.). Повышение локальной экспрессии факторов и увеличение количества рецепторов к ним приводит к динамической регуляции тонуса сосуда. Новые молекулярные технологии помогают определять факторы, которые приводят к расширению просвета сосуда [2]. Одним из отличительных признаков ГМК является их пластичность в ответ на расширение. Существует три основных вида ответа ГМК на избыточное расширение СС: 1) гиперплазия; 2) гипертрофия; 3) апоптоз. Большинство заболеваний сосудов связано с одним из них.
При избыточном давлении на сосудистую стенку (например, при артериальной гипертензии) происходит гипертрофия ГМК. Ингибиторы ангиотензин-превращающего фермента действуют профилактически на гипертрофию ГМК за счет снижения АД [36], а антагонист рецепторов ангиотензина (лозартан) уменьшает гипертрофию ГМК, несмотря на повышенное АД [41]. При этом действие β-адреноблокаторов оказывается незначительным. Отсюда можно сделать вывод, что гипертрофия ГМК сосудов происходит под действием ренин-ангиотензиновой системы, что делает препараты, воздействующие на нее, предпочтительными при патологии, сопровождающейся гипертрофией ГМК.
Апоптоз возникает при воздействии какого-либо воспалительного фактора и играет ключевую роль в создании механизмов восстановления ткани и ремоделирования. Объем ГМК, подвергающихся апоптозу, зависит от степени развития атеросклеротической бляшки или диспластических нарушений, а также от локализации процесса [23], и, кроме того, играет важную роль в формировании аневризмы аорты [20]. Известно, что ГМК могут уничтожаться макрофагами, которые в больших количествах скапливаются в средней оболочке артерий при таких поражениях СС. При активном апоптозе в качестве компенсации происходит нарастание синтеза коллагена, который производится ГМК. Это приводит к дестабилизации атеросклеротической бляшки, а также нарушает упругость и усиливает ломкость СС, что является причиной расширения сосуда. Мертвые клетки не могут обезвреживать тромбин, и это приводит к нарастанию тромботических масс вокруг образовавшейся атеромы.
Необходимо отметить, что ГМК сосудов отвечают на большинство изменений особым образом, что делает их важными элементами в понимании процессов, происходящих при патологии сосудов.
3. Элементы соединительной ткани сосудов
Молекула коллагена является основным элементом коллагеновой ткани, она представляет собой палочковидные образования, которые образуют полипептидные α- цепи. Коллаген 1-го и 3-го типов обладает примерно одинаковой структурой. Даже синтез этих двух типов коллагена осуществляется одинаковыми клетками, которые синтезируют один или другой тип коллагена в зависимости от типа ткани, возраста и множества других параметров [4, 45]. В норме метаболизм коллагена идет чрезвычайно медленно, а при быстром нарастании этой ткани происходит резкое ремоделирование СС. В обычном состоянии коллаген является очень устойчивой молекулой, но при повреждениях его молекулы хорошо распадаются под широким спектром протеаз. Из специфических протеаз, которые могут воздействовать на коллаген, можно назвать матриксные металлопротеиназы [34]. Они разрушают целостность молекулы коллагена, в результате чего она начинает самопроизвольно распадаться в течение некоторого времени.
Если коллаген обеспечивает жесткостные свойства СС, то для ее упругости существуют эластические волокна.
Таким образом, очевидно, что структурные компоненты ЭМ несут на себе основную нагрузку в стенке сосуда. Его разрушение ведет к развитию слабости стенки сосуда, при этом образуются компенсаторные процессы в виде гипертрофии и гиперплазии ГМК, которые в свою очередь не могут полностью компенсировать нагрузку, из-за чего начинается их апоптоз. Как результат взаимодействия этих процессов, развиваются атеросклероз, стенозы и аневризмы сосудов.
Архитектоника это в медицине что
Развитие. Образование примитивной оболочки мозга начинается с единичных клеток нервного гребня. На 23-25 сутки образуется закладка оболочки, в которой через пару суток обнаруживаются псевдоворсинки твердой мозговой оболочки (ТМО), которые впоследствии редуцируются. 38-39-е сутки являются ключевым моментом формирования архитектоники ТМО. Далее, когда эмбрион достигает размера 15 мм, архитектоника оболочечной системы головного мозга начинает приобретать элементы дефинитивной структуры.
ТМО с самого начала эмбриогенеза обуславливает «футлярное развитие» центральной нервной системы в соответствии с принципом осевой симметрии [1].
Анатомическое строение. Dura mater encephali представляет собой оболочку беловатого цвета из плотной фиброзной ткани с большим количеством эластических и коллагеновых волокон, не содержит сосудов и состоит из двух листков. Служит одновременно внешней оболочкой головного мозга и тесно контактирует с внутренней надкостницей костей черепа. У детей ТМО прочно соединяется с костями черепа, а у взрослых она во многих местах соединяется не так прочно. В определенных местах выражено расщепление durae mater на два листка. В них располагаются венозные синусы, полость полулунного узла и эндолимфатического мешка. Так же в головном мозге она образует многочисленные отростки. Их принято делить на наружные и внутренние. Наружными отростками являются оболочки черепных нервов. Внутренние отростки делят полость черепа на несколько отделов [9].
Сагиттальные отростки называются серповидными. Поперечные же образуют палатку мозжечка и диафрагму турецкого седла. Оба серповидных отростка сходятся в области protuberantia occipitalis interna, образуя крест. Внутренняя гладкая поверхность durae mater encephali соединятся с другими оболочками при помощи мозговых вен, вливающихся в венозный синус ТМО, и так называемых арахноидальных ворсинок. Ворсинки развиваются постепенно и прорастая в твёрдую оболочку, не выпячивая стенки синуса, а прободая ее и вступая в непосредственное соприкосновение с эндотелием венозного синуса. Таким образом, пахионовы грануляции располагаются вдоль синусов головного мозга. Это образования, встречающиеся только в головном мозге, больше всего их на поверхностях полушарий мозга и гораздо меньше в мозжечке. Имеются исследования о том, что количество пахионовых грануляций возрастает при различных заболеваниях, таких как: эпилепсия, пороки сердца, слабоумие, также при хроническом алкоголизме.
Самым крупным образованием является серп большого мозга (falx cerebri), он находится в сагиттальной плоскости и проникает между полушариями мозга. Имеет вид серповидной изогнутой пластинки в виде двух листков. Начинается от заднего края петушиного гребня и почти вплотную примыкает к мозолистому телу и у верхнего края намета мозжечка заканчивается. Около линии сращения намета мозжечка и серпа большого мозга располагается прямой синус, посредством которого соединяются между собой верхний и нижний сагиттальные, поперечные и затылочные синусы [11]. Серп мозжечка (falx cerebelli) так же, как и серп большого мозга, располагается в сагиттальной плоскости. В его основании образуется затылочный синус. Передний край проникает между полушариями мозжечка, а задний идет до заднего края большого затылочного отверстия.
Важными образованиями являются синусы, которые образуются за счет расщепления оболочки на 2 листка.
Синусы ТМО представлены:
Особенности синусов (sinus durae matris):
Еще одним образованием является каменисто-наклоненная связка, в образовании которой участвуют волокна, которые идут к заднему наклоненному отростку от верхушки пирамиды. По Доленсу выделяют также фиброзные кольца, которые отвечают за фиксацию внутри пещеристого синуса внутренней сонной артерии. Отростки durae mater encephali образуют полость, называемую тройничной, в которой расположены корешок и узел тройничного нерва. Эти отростки также образуют манжеты, которые охватывают сосуды, а также черепные нервы на выходе их из мозга. Они очень хорошо выражены у нервов, которые выходят из яремного отверстия. Также под турецким седлом расположена диафрагма седла (diaphragmа sellae), которая образует его крышу. Под ней залегает гипофиз.
Между костями свода черепа и durae mater encephali имеется щелевидное пространство, которое названо эпидуральным и содержит эпидуральную жидкость. Внутренняя ее поверхность со стороны субдурального пространства выстлана эндотелием. Конечно, оно значительно уступает эпидуральному пространству позвоночного канала, но все же существует.
Несмотря на то, что ТМО считается бессосудистой, все же в ней имеются сосудистые сети: внутренняя и наружная капиллярные и артериовенозная. Внутренняя сеть находится под эндотелием ТМО, артериовенозная сеть расположена в толще оболочки и состоит из венозной и артериальной части. В наружную часть жидкость оттекает из эпидурального пространства [7].
Некоторые заболевания связанные с патологией ТМО. Субдуральная гематома возникает, когда существует скопление крови между твердой и арахноидальной мозговыми оболочками, обычно в результате разрыва соединительных вен, в качестве последствий травмы головы. Эпидуральная гематома представляет собой совокупность крови между твердой мозговой оболочкой и внутренней поверхностью черепа и обычно вызвана артериальным кровотечением. Интрадуральные процедуры, такие как удаление опухоли головного мозга или лечение невралгии тройничного нерва с помощью микрососудистой декомпрессии, требуют разреза ТМО. Для достижения герметичного восстановления и предотвращения возможных послеоперационных осложнений твердая оболочка обычно закрывается швами. В случае дефицита собственной ткани ТМО для замены оболочки можно использовать дуральный заменитель. Небольшие промежутки в твердой оболочке могут быть покрыты хирургической пленкой для герметичности.
Эпидуральный абсцесс – это инфекция внутри эпидурального пространства в любом месте головного или спинного мозга. Твердая мозговая оболочка образует внутреннюю оболочку костного черепа, и в нормальных условиях между черепом и твердой мозговой оболочкой нет места. Повышение внутричерепного давления (ВПД), связанное с инфекциями, воспалением или опухолями, открывает эпидуральное пространство и отделяет кость от ткани. Это новообразованное эпидуральное пространство может содержать кровь, гной или абсцесс. Ниже большого отверстия эпидуральное пространство расширяет длину позвоночника. Он имеет 2 отделения: истинное пространство сзади и сбоку от спинного мозга, содержащее амортизирующий слой жира, заключенный в проникающие артерии и обширное венозное сплетение, и потенциальное переднее пространство, где твердое тело прилипает к задней поверхности тела позвонка. Эпидуральные абсцессы возникают в результате инфекций, вовлекающих спинномозговое или краниальное эпидуральное пространство. Внутричерепные эпидуральные абсцессы (ВЭА) являются осложнениями черепной хирургии или травмы; они также могут осложнять оториноларингологические инфекции или другие процедуры на шее и грудной клетке. Спинальный эпидуральный абсцесс (СЭА) может иметь острое и хроническое проявление. Эта простая категоризация коррелирует с определенными клиническими и лабораторными проявлениями, бактериологическими и спинномозговыми жидкостями, анатомическими деталями и патологией. Острый СЭА обычно длится менее 2 недель с лихорадкой и признаками системного воспаления из гематогенного источника. Это контрастирует с тонкой, лихорадочной и давней хронической СЭА, возникшей в результате прямого распространения остеомиелита позвонков. Оба присутствуют с болями в спине и корешке, но лейкоцитоз (в сыворотке и ЦСЖ) чаще встречается в острой форме, а не в хронической. Острые формы расположены позади спинного мозга, но хронические формы обычно являются передними к спинному мозгу. Общая патология гнойная и экссудативная при острой, но с грануляционной тканью при хронической.
В 2011 году исследователи обнаружили соединительнотканный мостик между шейной частью durae mater encephali и m. rectus capitis posterior major. Различные клинические проявления могут быть связаны с этими анатомическими отношениями, такие как головные боли, невралгия тройничного нерва и другие симптомы, связанные с шейной частью ТМО. M. rectus capitis posterior minor имеет аналогичную связь [6].
Оболочечно-мышечные, оболочечно-связочные соединения в верхнем шейном отделе позвоночного столба и затылочных областях могут давать ответы на вопросы о причинах цервикогенной головной боли с точки зрения анатомии и физиологии. Это предположение будет также объяснять эффективность манипуляций при лечении цервикогенной головной боли [5].
Дуральная эктазия – это расширение durae mater encephali и распространена она при нарушениях развития соединительной ткани, таких как синдром Марфана и синдром Элерса-Данлоса. Эти состояния иногда обнаруживаются в связи с мальформацией Арнольда-Киари [10].
Спонтанная утечка цереброспинальной жидкости – это потеря жидкости и давления в цистернах мозга из-за отверстий в dura mater encephali.
Также, одним из частых патологических состояний является тромбоз венозных синусов головного мозга. Его диагностика сопряжена с МРТ, МР- и КТ- веносинусографии.
Заключение. Таким образом, знание архитектоники dura mater encephali, особенностей строения синусов ТМО, циркуляции венозной крови в них, а также особенностей развития некоторых патологических состояний связанных с нарушением строения dura mater является основополагающим фактором эффективной диагностики в практике врача.
