Архитектоника сосудов что это
Архитектоника сосудов что это
Введение. Морфологии вен почек человека посвящены немногочисленные исследования [9,12-14]. Как правило, они разноречивы или являются дополнением при описании артериальной системы почек.
Одной из наиболее спорных и малоизученных остается проблема соотношения возрастных и патологических изменений в интраорганных венозных сосудах почек, особенно при сердечно-сосудистых заболеваниях, при которых сама почка является важнейшим экстракардиальным звеном патогенеза сердечно-сосудистой недостаточности. В литературе крайне недостаточно работ, посвященных изучению артериального и микроциркулярного русла почек при сердечно-сосудистых заболеваниях [3, 4, 7, 10, 11], и единичные публикации, посвященные изучению венозных сосудов почек при ишемической болезни сердца [5, 6].
Цель исследования – определить возрастные особенности относительного содержания венозных сосудов почек, изменения этого показателя при острой и хронической ишемической болезни сердца; определить характер возрастных и патологических изменений венозного отдела микроциркуляторного русла почек.
Материал и методы исследования. Нами изучены 20 почек людей зрелого и пожилого возраста, погибших от механической асфиксии (контрольная группа) и 30 почек людей, умерших от сердечно-сосудистой недостаточности на фоне ИБС. При выборе секционного материала мы учитывали следующие критерии нормы по А.М. Вихерту с соавт. [2]: 1) насильственный характер смерти; 2) отсутствие указаний на наличие хронических заболеваний сердца и почек; 3) вес сердца не более 400 г у мужчин и не более 300 г у женщин; 4) отсутствие на вскрытии рубцов в миокарде и следов нарушения мозгового кровообращения.
В группе лиц, умерших от сердечно-сосудистой недостаточности на фоне ИБС, учитывали отсутствие данных об артериальной гипертензии в историях болезни и протоколах вскрытий.
Для инъекции почечных вен использовали водную взвесь черной туши в разведении 1:3 [8]. Препараты фиксировали в 10% растворе нейтрального формалина и на замораживающем микротоме приготавливали срезы толщиной 90 мкм. При определении относительного содержания венозных сосудов использовали рекомендации Г.Г. Автандилова [1]. Цифровые данные обработаны вариационно-статистическим методом.
В контрольной группе относительное содержание венозных сосудов увеличивается с увеличением возраста как в корковом веществе почек, составляя 7,41±0,31 у.е. в 1 зрелом возрасте и 7,92±0,22 у.е. – в пожилом, так и в мозговом веществе – 5,25± у.е. и 6,21±0,25 у.е. соответственно.
При ИБС, как показали проведенные нами исследования, изменения в сосудах почек зависят от продолжительности заболевания. Так при острой ишемической болезни сердца (ОИБС) относительное содержание венозных сосудов в корковом веществ почек людей 1 зрелого возраста составляет 5,0±0,24, а при хронической (ХИБС) этот показатель равен 7,64±0,38 у.е. В пожилом возрасте при ОИБС и ХИБС обсуждаемый показатель незначительно увеличивался до 5,5±0,33 и 8,17±0,28 у.е. соответственно. При ОИБС в мозговом веществе почек людей 1 зрелого возраста относительное содержание венозных сосудов составляет 6,74±0,27 у.е., незначительно уменьшаясь с увеличением возраста до 6,41±0,33 у.е., а при ХИБС этот показатель составляет 6,29±0,34 и 6,46±0,29 у.е. соответственно.
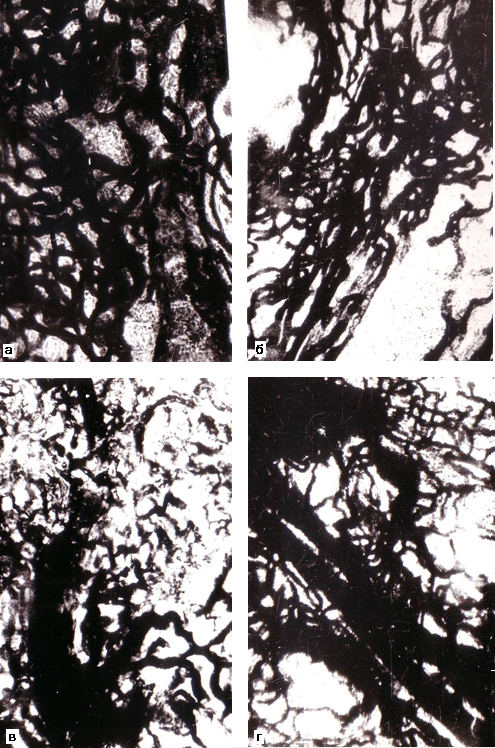
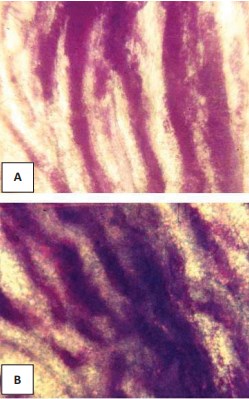
Установлено, что в контрольной группе нарушения венозного отдела микроциркуляторного русла проявляются по типу юкстамедуллярного шунтирования в 18% случаев, по типу чрезмерного венозного полнокровия (рис 1-а) в 64% случаев, а в 18% случаев (рис 1-б) изменений не обнаружено, что объясняется причиной смерти – механической асфиксией. При ОИБС доминирует нарушение венозного отдела по типу юкстамедуллярного шунтирования (рис. 1-в, г) с типичным при этом запустением капилляров и венул в корковом веществе и резким расширением прямых венул в мозговом, и составляет 89% случаев, а по типу чрезмерного венозного полнокровия – 11% случаев. При ХИБС нарушения венозного отдела микроциркуляторного русла почек по типу юкстамедуллярного шунтирования отмечены в 42% случаев, а по типу чрезмерного венозного полнокровия (рис.2-а, б) с расширением капилляров и венул как коркового, так и мозгового вещества – в 44% случаев В 14% случаев при ХИБС не было выявлено ни юкстамедуллярного шунтирования, ни чрезмерного венозного полнокровия (рис 2-в, г). В этих случаях отмечено запустение венозных микрососудов как в корковом, так и в мозговом веществе почек.
Рис. 1. Взаимоотношение и форма венозных сосудов в корковом (а, в) и мозговом (б, г) веществе почки женщины 42 лет (а, б) контрольной группы и мужчины 39 лет (в, г) с острой ишемической болезнью сердца. Инъекция сосудов черной тушью. Об. 15, ок. 7.
Рис.2. Взаимоотношение и форма венозных сосудов в корковом (а, в) и мозговом веществе (б, г) почки при хронической ишемической болезни сердца женщины 54 лет (а, б) и мужчины 70 лет (в, г). Инъекция сосудов черной тушью. Об. 15, ок. 7.
Заключение. Полученные нами данные морфометрического изучения внутриорганных вен почек в контрольной группе позволяют выявить с увеличением возраста незначительное увеличение относительного содержания венозных сосудов в корковом и мозговом веществе почек. Изменения венозных сосудов почек при ИБС идентичны выявленным процессам в сосудах интраорганного артериального русла почек [6,7]. Так усиление при ОИБС венулярного компонента юкстамедуллярного шунта, так же как и артериолярного является проявлением срочной адаптации к изменившимся условиям гемоциркуляции. При ХИБС, когда имеет место длительное воздействие этих изменений, были обнаружены нарушения микроциркуляции почек по типу чрезмерного венозного полнокровия, что указывает на долговременную адаптацию. В ряде случаев при ХИБС отсутствует как юкстамедуллярное шунтирование, так и чрезмерное венозное полнокровие, что, по мнению некоторых авторов[11], связано со склеротическими и деструктивными процессами как в корковом, так и в мозговом веществе почек. Снижение адаптационных возможностей венозного русла почек с увеличением возраста интегрирует с патологическими и приводит к срыву адаптации.
Архитектоника сосудов что это
Печень имеет четко выраженное сегментарное строение, которое в основном определяется архитектоникой печеночных вен и сопутствующих им желчных протоков.
Для хирургии повреждений имеет значение тот факт, что каждый сегмент печени и каждая доля имеют в большинстве случаев одну сосудисто-секреторную ножку, окруженную соединительно-тканной оболочкой (капсула Глиссона), что при вмешательстве по поводу ранения печени дает возможность быстро выделить ножку сегмента.
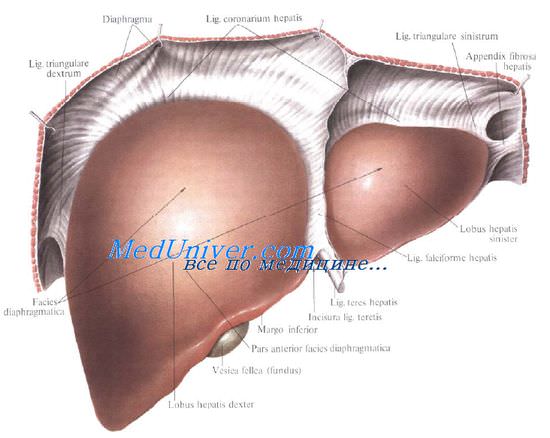
Правая печеночная вена структурирует два заднебоковых сегмента (VI и VII) и два переднемедиальных (V и VIII). Левая печеночная вена определяет границы двух передних сегментов (III и IV) и одного заднего (II). Что касается I сегмента (так называемая доля Шпигеля), то этот задний сегмент прилежит непосредственно к нижней полой вене. Каждому сегменту соответствует свой желчный проток, которые потом сливаются в правый и левый долевые желчные протоки.
Морфологически печеночные вены представляют собой тонкостенные бесклапанные сосуды, идущие сегментарно в паренхиме, к задней поверхности печени, где уже через 2 см впадают в нижнюю полую вену, которая на протяжении 8-10 см располагается позади печени. Средняя печеночная вена в 85% случаев впадает не непосредственно в нижнюю полую вену, а в левую печеночную.
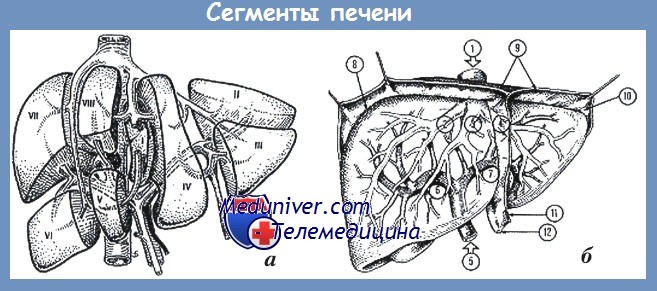
1 — нижняя полая вена.
Печеночные вены: 2 — правая; 3 — средняя, 4 — левая.
Воротная вена: 5 — основной ствол; 6 — правая ветвь; 7 — левая ветвь.
Связки печени: 8 — левая треугольная; 9 — коронарная; 10 — правая треугольная; 11 — серповидная; 12 — круглая
Воротная вена представляет собой также бесклапанный тонкостенный сосуд диаметром около 8 мм, через который проходит 75% всей поступающей в печень крови. В воротах печени она делится на правую и левую ветви, которые затем переходят в сложную капиллярную систему, обеспечивая основные обменные процессы.
При ранениях живота следует учитывать взаимоотношение ствола воротной вены и головки поджелудочной железы: в 35 % случаев вена находится позади головки, в 42% случаев — частично в паренхиме головки и в 23% случаев она проходит в толще паренхимы головки поджелудочной железы.
Артериальное кровоснабжение печени осуществляется через общую печеночную артерию, которая, являясь крупной ветвью (0,5-0,8 см в диаметре) чревного ствола, проходит по правой внутренней ножке диафрагмы вдоль верхнего края поджелудочной железы до печеночно-двенадцатиперстной связки, где на уровне привратника, не доходя на 1-1,5 см до стенки общего желчного протока, делится на a. gastroduodenalis и собственно печеночную артерию (a. hepatica propria).
Диаметр собственной печеночной артерии колеблется от 3 до 6 мм, длина от 0,5 до 3 см. В самом начале от нее отходит правая желудочная артерия, а собственная печеночная артерия идет в составе иеченочно-двенадцатиперстной связки глубже холедоха и впереди воротной вены, разделяясь затем на правую и левую ветви. Правая печеночная артерия диаметром 2-4 мм и длиной от 2 до 4 см снабжает правую долю печени и желчный пузырь, левая (несколько тоньше и короче) снабжает левую долю.
Следует помнить, что в воротах печени на уровне глиссоновой капсулы обе ветви печеночной артерии дают множество мелких ветвей, образующих густую сеть коллатералей, что требует тщательного выполнения гемостаза в этой области.
Кроме того, архитектоника сосудов печени и их взаимоотношение с желчными протоками (особенно это касается правой печеночной артерии) достаточно изменчивы, и при хирургических манипуляциях в области ворот необходимо предельное внимание и тщательная препаровка под контролем зрения.
Учебное видео сегментарное строение печени на схеме
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Юкстамедуллярный путь кровотока
О.А. Каплунова
ФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ; Ростов-на-Дону, Россия
Диссертация приват-доцента оперативной хирургии и топографической анатомии Императорского Казанского Университета Василия Захаровича Голубева (1894) «О кровеносных сосудах в почках млекопитающих и человека» [1] была выполнена в гистологической лаборатории под руководством К.А. Арнштейна. Этот фундаментальный труд содержал наиболее полное и достоверное изложение закономерностей распределения тончайших кровеносных сосудов в корковом и мозговом веществе почки и их взаимосвязях. Исследование В.З. Голубева послужило дальнейшему развитию учения о микроангиоархитектонике почек и их потенциальных ресурсах
Прежде всего, В.З. Голубев расшифровал строение двух капиллярных сетей в корковом веществе почек: гломерулярной и перитубулярной. Гломерулярные сети образуют приносящие клубочковые артериолы, ответвляющиеся от междольковых артерий. От последних ответвляются и боковые веточки без сосудистых клубочков, формирующие перитубулярную капиллярную сеть коркового вещества. От дуговых или междольковых артерий начинаются внутренние перфорирующие артерии, которые имеют мало клубочков или их совсем их не имеют, и направляют кровь по кратчайшему пути от дуговых артерий к сосудистой сети фиброзной или жировой капсулы. Эти данные подтверждаются современными исследованиями с помощью микрокомпьютерной томографии [2].
Мозговое вещество почки кровоснабжается истинными и ложными прямыми артериолами. В.З. Голубев показал, что истинные прямые артериолы отходят непосредственно от дуговых артерий или от проксимальных частей междольковых артерий, а от выносящих артериол юкстамедуллярных клубочков начинаются ложные прямые артериолы. Проникнув в мозговое вещество, прямые артериолы образуют сосудистые пучки, которые спускаются к сосочку почки и разветвляются на капилляры, оплетающие мочевые канальцы. В составе прямых сосудов мозгового вещества В.З. Голубев выявил истинные прямые артериолы, ложные прямые артериолы и прямые венулы пирамид.
Особой новизной характеризуются данные В.З. Голубева о «новых чудесных сетях» – клубочковых капиллярных образованиях, расположенных по ходу дугообразных артерий в пограничном слое почки. В отличие от клубочков почечных телец, они не окружены капсулами, а их приносящие и выносящие артериолы расположены на противоположных полюсах. В.З. Голубев отнес эти образования к околососудистому руслу. В пограничной (юкстамедуллярной) зоне почки «новые чудесные сети» соединяют сосуды коркового и мозгового вещества, и регулируют почечный кровоток. В.З. Голубев писал: «Представляя запасный кровяной резервуар, чудесная сеть может игрой мышц, заложенных в стенках ее ветвей и приводящего и отводящего ствола, двинуть кровь вперед или задержать ее на месте, смотря по обстоятельствам, или же окольным боковым путем направить ее в ближайший район и тем до известной степени устранить вред нарушенного кровообращения».
Большое значение в механизме гемоциркуляции в почке В.З. Голубев отводил истинным прямым артериолам, которые «помимо своего физиологического значения, могут быть регуляторами кровообращения, будучи снабжены чудными сетями».
Данные В.З. Голубева о сосудистых анастомозах кортикомедуллярной (юкстамедуллярной) зоны почки, прямых артериолах мозгового вещества и его гениальное предположение об их физиологическом значении в регуляции внутрипочечного кровообращения были подтверждены экспериментальными работами J. Trueta et. al. [3]. Авторы установили, что юкстамедуллярные клубочки, прямые сосуды и связанные с ними сосудистые элементы составляют мозговой шунт, через который кровь, оттекая из коркового вещества, идет от почечных артерий к почечным венам. К юкстамедуллярному шунту, по мнению авторов, относятся: проксимальная часть междольковых артерий, первые ветви междольковых артерий, приносящие и выносящие сосуды юкстамедуллярных клубочков и сами клубочки, прямые артериолы в мозговом веществе, петли прямых артериол, межканальцевые капилляры, формирующие часть системы прямых артериол, прямые венулы, проксимальная часть междольковых вен.
В обычных условиях по юкстамедуллярному шунту проходит всего 20% почечной крови. При волнениях, тяжёлой физической нагрузке и особенно при патологических состояниях (кардиогенный или другой шок) большая часть крови (до 80%) сбрасывается по мозговым сосудам. Значительное усиление и продолжительность шунтирования приводят к тяжёлым нарушениям кровоснабжения поверхностных слоёв коркового вещества почки и острой почечной недостаточности [4].
В регуляции почечного кровообращения участвуют приспособительные образования в крупных артериях, которые выступают в просвет сосудов [5, 6, 7].
Почки принимают участие в регуляции системного артериального давления и как эндокринный орган [9, 10]. Одни почечные гормоны обладают сосудосуживающим (вазопрессорные системы), другие сосудорасширяющим действием (вазодепрессорные системы). Характерная особенность указанных систем состоит в том, что они действуют не только на отдельные органы-мишени, но и непосредственно на почку (местные или тканевые регуляторы). Юкстагломерулярный аппарат, секретирующий ренин, и интерстициальные клетки мозгового вещества, вырабатывающие простагландины, тесно взаимодействуют в регуляции почечного кровотока, распределяя его между корковым и мозговым веществом [10].
Наиболее универсальной реакцией сосудов коркового вещества почки является вазоконстрикция [4]. Она наблюдается при ортостазе, эмоциональном напряжении, физической нагрузке, гипоксии и т. д. Подвержены вазоконстрикции и приносящие сосуды клубочков. Кровоток в мозговом веществе почек при этом увеличивается [10]. Поскольку продукция депрессорных веществ (простагландинов) находится в прямой зависимости от уровнямедуллярного кровотока, то эту реакцию можно рассматривать как один из важных факторов, препятствующих чрезмерной вазоконстрикции сосуд, и стабилизации повышенного артериального давления [8]. Наблюдаемый при большинстве воздействий спазм сосудов коркового вещества почек имеет приспособительное адаптационное значение, которое заключается в ликвидации реально существующей или предупреждение ожидаемой гиповолемии и гипотонии. При этом в почках сброс основной массы крови происходит по шунту J. Trueta. Однако, эта реакция не всегда целесообразна, так как при ее многократном повторении развивается кортикальный некроз. Почки, как бы жертвуя собственным кровообращением, сохраняют условия для кровоснабжения других органов, нормализуя общее кровообращение [4].
Отсутствие эффективной регуляции в почках мозгового кровотока при артериальной гипертензии способствует транссудации и развитию гиалиноза стромы мозгового вещества [13]. При склерозе мозгового вещества почек наблюдается редукция и блок юкстамедуллярного шунта [14], что, в свою очередь, потенцирует повреждающее действие артериальной гипертензии на структуры коркового вещества в связи с усилением гемодинамической нагрузки [12].
Наши исследования [7] показали, что архитектоника сосудов микроциркуляторного русла почек при сердечно-сосудистых заболеваниях характеризуется уменьшением диаметров сосудистых клубочков, уменьшением клубочковой массы в корковом веществе и общего количества клубочков в почке. Наблюдаются также запустение и деформация перитубулярных капилляров, расширение и деформация прямых артериол мозгового вещества. Наиболее выражены указанные изменения при вазоренальной гипертензии, сочетании гипертонической болезни с хронической ишемической болезнью сердца и при гипертонической болезни по сравнению с ишемической болезнью сердца и атеросклерозом брюшной аорты.
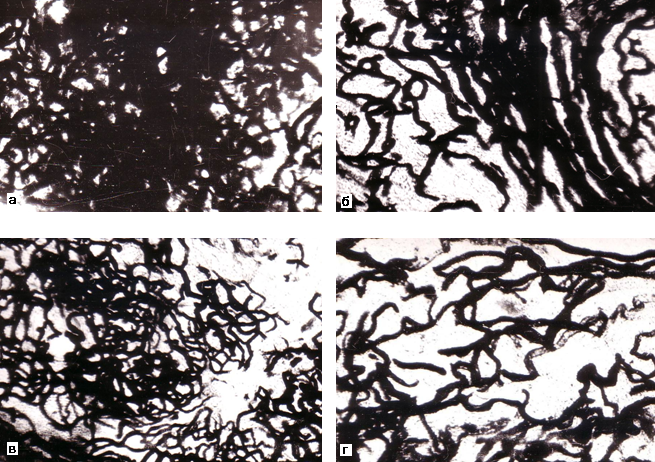
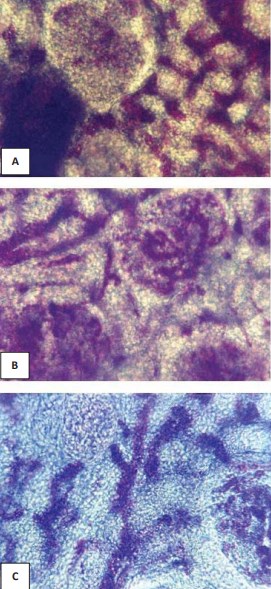
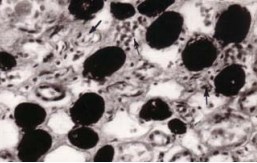
Рисунок 1. Артериальные сосуды в средней зоне коркового вещества: A – в почке мужчины 37 лет, контрольная группа; B – спавшиеся перитубулярные капилляры в почке мужчины 68 лет, хроническая ишемическая болезнь сердца; C – склерозированные и деформированные клубочки и сосуды в почке женщины 71 года, вазоренальная гипертензия (атеросклероз почечной артерии). Окраска эритрозином по Г.В.Ковалевскому. Об.15, ок. 7.
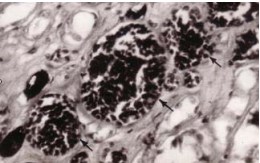
Рисунок 3. Расширенные прямые артериолы, просветы которых заполнены черной тушью, и венулы с форменными элементами крови (показаны стрелками) в мозговом веществе почки мужчины 58 лет. Хроническая ишемическая болезнь сердца. Инъекция сосудов черной тушью. Окраска по Вейгерту. Об. 40, ок. 10.
Рисунок 4. Прямые артериолы, просветы которых заполнены черной тушью, и расширенные венулы с форменными элементами крови (показаны стрелками) в мозговом веществе почки мужчины 41 года. Гипертоническая болезнь 2-й стадии. Инъекция сосудов черной тушью. Окраска по Вейгерту. Об. 40, ок. 10.
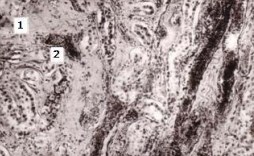
Рисунок 5. Участок мозгового вещества почки женщины 71 года с хронической ишемической болезнью сердца, вторичной гипертензией, атеросклерозом брюшной аорты. Очаги склероза мозгового вещества (1) и деформация прямых артериол (2). Окраска по ван Гизон. Об. 16, ок.10.
Итак, при острых сердечно-сосудистых заболеваниях возрастает значение юкстамедуллярного пути кровотока, наблюдается юкстамедуллярное шунтирование. При хронических сердечно-сосудистых заболеваниях вначале усиливается юкстамедуллярное шунтирование, а на поздних стадиях заболевания склероз мозгового вещества почек вызывает редукцию и блок юкстамедуллярного пути кровотока, ухудшается как юкстамедуллярный, так и кортикальный путь кровотока, что приводит к срыву адаптации интраорганного артериального русла почек.
Современные сведения о путях почечной гемоциркуляции, подготовленные исследованиями В.З. Голубева, позволяют объяснить механизм развития различных патологических состояний: острой кровопотери [17], гидронефроза [18], вазоренальной гипертензии, гломерулонефрита, пиелонефрита [8], нефроурологических заболеваниях [19], кардиогенного шока [20, 21], мочекаменной болезни [22], кардиоренального синдрома при острой ишемической болезни сердца [23], артериальной гипертензии [7, 24, 25], внезапной коронарной смерти [26] и др. Таким образом, В.З. Голубев создал научную основу для изучения микроангиоархитектоники почек. Принципы, изложенные в его диссертации, предвосхитили появление работ, изучающих юкстамедуллярный кровоток и почечную гемомикроциркуляцию в норме и при патологии.
Литература
Статья опубликована в журнале «Вестник урологии» № 1 2019, стр. 45-52
Магнитно-резонансная ангиография: что это за процедура и для чего она нужна?
Что такое ангиография сосудов?
Магнитно-резонансная ангиография позволяет оценить функциональность сосудов, скорость кровотока, выявить врожденные аномалии, исследовать пути кровообращения и сосудистую сеть. С помощью исследования получаютизображение вен, артерий и лимфососудов.
Показания к обследованию
Черепно-мозговая травма
Если при черепно-мозговой травме существует риск повреждения сосудов, назначают МР-ангиографию. Современный метод исследования позволяет диагностировать ложные аневризмы и нарушения у пациентов с огнестрельными ранениями в первые несколько дней после реанимации. Обследование проводят, чтобы исключить расслоение и повреждение сонных и позвоночных артерий.
Атеросклероз, воспаление стенок, патологическое расширение сосудов
С помощью этого метода можно определить малейшие нарушения в структуре стенок сосудов. Создается визуализация артериального круга головного мозга, получаемая посредством воздействия на зону обследования радиоволнами во внешнем магнитном поле. На ангиограммах хорошо видны задние, передние, средние и сонные мозговые артерии, а также базилярная артерия. МР-ангиография интракраниальных артерий позволяет быстро увидеть нарушения архитектоники сосудов, а также проблемы с кровотоком, причиной которых является атеросклероз, опухоли, аневризма. Одновременно может проводиться исследование артерий шеи. Процедура направлена на выявление патологии в структуре сосудистых стенок. МР церебральная ангиография сосудов мозга дает полную картину функций кровотока.
Расслоение аорты
Методика дает возможность определить точное место расслоения и где изменено движение крови. Противопоказанием к диагностике является наличие у пациента металлического клапана.
Синдром внешнего сдавления сосуда
Магнитно-резонансная, или МРТ, ангиография назначается при синдроме внешнего сдавления сосуда. В условиях диагностического центра пациенту вводят в артерию контрастное вещество и делают трехмерные изображения сосудов, подвергшихся деформации.
Врожденный порок сердца
Ангиография является основным методом исследования больных, имеющих врожденные пороки сердца. Во время процедуры измеряют градиент давления и насыщение кислородом крови.В результате рассчитывают потоки, сопротивления и шунты внутри сердца, точно оценивают функцию и анатомию этого органа.
Методика и предварительная подготовка
В основе методики лежит воздействие магнитного поля и электромагнитных волн. В результате исследования получают многомерные изображения сосудов определенной области. Особенно ценной является диагностика сосудов шеи и головного мозга. Длительность МР-ангиографии составляет 30-40 минут.
Процедура может быть выполнена с введением контрастного вещества или без. Перед проведением ангиографии выполняется аллергопроба на контрастное вещество. За 8 часов до процедуры не рекомендуется принимать пищу. Врача нужно заранее предупредить о приеме лекарств. Перед процедурой необходимо снять все металлосодержащие изделия.
Среди подготовительных мероприятий:
Состояние пациента после процедуры и возможные осложнения
В течение суток рекомендован постельный режим. Лечащий врач следит за общим состоянием пациента (осмотр области вмешательства, измерение температуры). Если состояние человека удовлетворительное, на второй день снимают повязку и отпускают домой. Риск осложнений минимальный. Для большинства людей исследование не представляет опасности.
Особенности ангиографии различных органов
Ангиография сосудов головного мозга
Это наиболее распространенный способ диагностики нарушений в кровоснабжении головного мозга. Визуализация помогает выявить патологические процессы, кисты, опухоли, микроинсульт.
Церебральную МР-ангиографию сосудов назначают при:
Ангиография сердца
Показаниями к процедуре являются:
Ангиография нижних конечностей
Заболевания вен и артерий нижних конечностей широко распространены. МР-ангиография выполняется при наличии или подозрении на следующие заболевания:
Ангиография шеи
Для оценки состояния сосудистой стеки, локализации нарушений и уточнения диагноза назначают ангиографию шеи. Процедура показана при ушибах и повреждениях, головных болях, головокружениях, нарушениях сознания и сна. С ее помощью определяют болезнь Такаясу, стеноз и аномалии развития, сосудистые новообразования, сдавливания сосудов рубцами и опухолью.
Противопоказания для проведения процедуры
МР-артериография – это визуализация артерий, с помощью которой можно выявить закупорки, их место, степень угрозы для здоровья и жизни. Позволяет выявить кровоизлияние, тромбоз, спазмы сосудов и др. Особенно важна эта методика, потому что позволяет контролировать лечение тех пациентов, которые находятся в состоянии очень высокого риска.