Атрофия эпителия гинекология что это
Что такое атрофический кольпит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лантухова Э. С., гинеколога со стажем в 14 лет.
Определение болезни. Причины заболевания
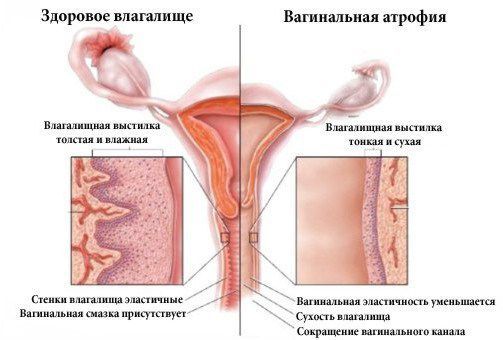
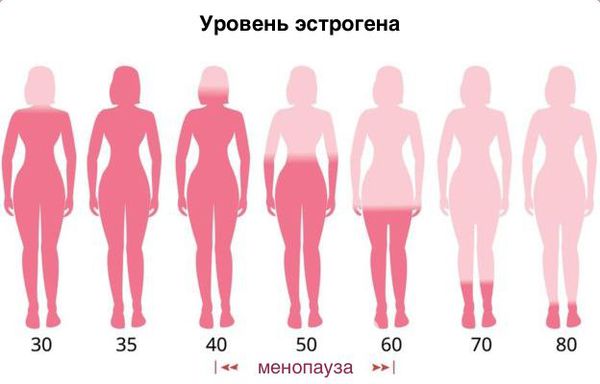
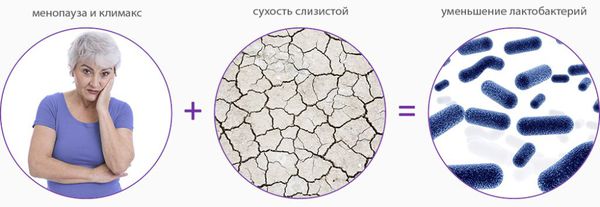
Атрофический кольпит (вагинальная атрофия, генитоуринарный синдром) — это состояние влагалища, которое характеризуется атрофическими изменениями (истончением слизистой, сухостью, нарушением защитных функций тканей), и связано с дефицитом воздействия эстрогенов и других гормонов на слизистые. Чаще всего возникает в менопаузе.
Основная причина развития генитоуринарного синдрома — возрастное снижение эстрогенов в пре- и постменопаузе. Схожие симптомы могут испытывать женщины репродуктивного возраста по следующим причинам:
Симптомы атрофического кольпита
Самый ранний симптом недостаточности эстрогенов — снижение увлажнённости влагалища, замечаемое при половом акте. Другие частые симптомы атрофического кольпита (вагинальной атрофии):
Симптомами атрофического цистоуретрита (эстрогендефицитных атрофических изменений в уретре и мочевом пузыре) являются:
Симптомы атрофического цистоуретрита могут быть изолированными или сочетаться с недержанием мочи при напряжении.
Патогенез атрофического кольпита
В основе развития атрофических изменений при данном заболевании лежит изменение гормонального фона.
Дефицит эстрогенов блокирует деление эпителиальных клеток стенки влагалища, в результате чего угнетается клеточная пролиферация (увеличение числа клеток и рост ткани) и образование гликогена — питательной среды для лактобактерий. Это приводит к почти полному исчезновению этих бактерий и нарушениям влагалищного микробиома, так как именно кисломолочные бактерии поддерживают оптимальный уровень pH и подавляют рост патогенной и условно-патогенной флоры. В дальнейшем изменение баланса микроорганизмов ведёт к развитию воспалительных процессов.
Поскольку рецепторы к эстрогенам содержатся в эндотелии сосудов (сосудистой стенке) и нервных клетках, при заболевании снижается кровообращение, развивается ишемия тканей, появляются симптомы жжения, зуда и боли.
В связи с единым эмбриональным происхождением мочеполовой системы данные изменения затрагивают не только влагалище, но и уретру, мочевой пузырь, мышцы и связки тазового дна.
Классификация и стадии развития атрофического кольпита
Различают три степени тяжести урогенитальных расстройств:
Осложнения атрофического кольпита
При отсутствии лечения генитоуринального синдрома возможно развитие выраженных изменений. К осложнениям заболевания относятся:
Диагностика атрофического кольпита
К объективной диагностике атрофического вагинита относятся:
При урологических симптомах проводят общий анализ мочи, посевы мочи, УЗИ почек и мочевого пузыря, КУДИ (комплексное уродинамическое исследование), консультацию уролога. Для исключения кожных заболеваний при необходимости требуется консультация дерматолога.
Лечение атрофического кольпита
При наличии воспаления на фоне атрофии первым этапом проводится санация (устранение возбудителя инфекции), а затем — мероприятия по восстановлению микрофлоры и слизистой.
Лечение симптомов атрофии должно быть дифференцированным и индивидуальным.
Урогенитальные расстройства являются независимым показанием к назначению гормональной терапии. Лучше всего атрофические изменения нивелируют эстрогены для местного применения (эстриол). Препараты эстриола для местного применения имеют минимальную системную абсорбцию (концентрация в плазме не превышает 20 пг/мл), а положительный эффект наступает быстро — через 2-3 недели. При этом у гормональной терапии не выявлено негативного влияния на эндометрий при длительном наблюдении (от 6 до 24 месяцев).
К новым методам лечения умеренной и тяжёлой диспареунии относится одобренный FDA селективный модулятор эстрогеновых рецепторов — оспемифен для приема внутрь, но он имеет ряд противопоказаний и побочных действий.
С целью лечения недержания мочи могут быть использованы инъекции препаратов на основе гиалуроновой кислоты. Востребована и биоревитализация гиалуроной кислотой, в результате которой происходит увлажнение слизистой оболочки, повышение тонуса мышц, усиление либидо. Данные методики имеют временный эффект, так как с течением времени происходит расщепление гиалуроновой кислоты ферментом нашего организма.
Эффективно применение собственной плазмы крови человека, то есть тромбоцитарной аутологичной плазмы — биологического стимулятора процессов регенерации.
Особой популярностью в настоящее время в профилактике и лечении вагинальной атрофии, недержании мочи и опущения стенок влагалища пользуются лазерные технологии (интимный лазерный фототермолиз).
Методика безопасна, безболезненна, имеет короткий курс реабилитации, проводится амбулаторно. В результате происходит улучшение состояния кожи и тонуса мышц, слизистая оболочка восстанавливает эластичность и натуральную лубрикацию, увеличивается её толщина и мягкость за счёт процессов неоколлагенеза и новой васкуляризации.
Прогноз. Профилактика
При выраженных нарушениях (III-IV степени выпадения половых органов, когда опущение выходит за пределы половой щели, появлении изъязвлений, пролежней, свищей, сращений слизистой, а также при отсутствии желаемого результата от консервативной терапии) проводится хирургическое лечение, однако оно в некоторых случаях может быть не полностью эффективным, иметь рецидивы и осложнения. Для улучшения прогноза на этапах подготовки к оперативным вмешательствам и после операции проводится консервативная гормональная терапия.
Профилактика развития генитоуринарного синдрома основывается на систематических осмотрах и своевременном назначении гормональной заместительной терапии после наступления менопаузы.
Вагинальная атрофия: этиологические аспекты и современные подходы к терапии
Согласно прогнозам, к 2030 г. в мире число женщин в постменопаузе достигнет 1,2 млрд. Эстрогендефицитное состояние в период климактерия у 15–57% женщин приводит к развитию вагинальной атрофии. В обзоре приводятся последние данные, касающиеся вопросов пато
Постменопауза характеризуется эстрогендефицитным состоянием у женщин, обусловленным возрастным снижением, а затем и прекращением функции яичников [1]. Как известно, любые эпителиальные ткани реагируют на изменение окружающей их гормональной среды сходным образом, но ни одна из них не может сравниться с эпителием свода влагалища и шейки матки по скорости и отчетливости реакции на гормоны, в первую очередь на половые стероиды [2]. Таким образом, урогенитальный тракт особенно чувствителен к снижению уровня эстрогенов и около половины всех женщин в постменопаузе испытывают симптомы, связанные с урогенитальной атрофией (УГА), затрагивающие половую функцию и качество жизни [3]. В клинической картине урогенитальных расстройств в климактерическом периоде выделяют симптомы, связанные с атрофией влагалища (вагинальная атрофия (ВА)), и расстройства мочеиспускания (цистоуретральная атрофия). В отличие от вазомоторных симптомов, которые обычно проходят со временем, симптомы вагинальной атрофии, как правило, возникают в пременопаузе и прогрессируют в постменопаузальном периоде, приводя к функциональным и анатомическим изменениям [4]. У 15% женщин в пременопаузе и 40–57% женщин в постменопаузе отмечаются симптомы ВА [5], такие как сухость влагалища 27–55%, жжение и зуд 18%, диспареуния 33–41%, а также повышенная восприимчивость к инфекционным заболеваниям органов малого таза 6–8% [4], что значительно ухудшает состояние здоровья, негативно влияет на общее и сексуальное качество жизни [6]. У 41% женщин в возрасте 50–79 лет есть хотя бы один из симптомов ВА [10].
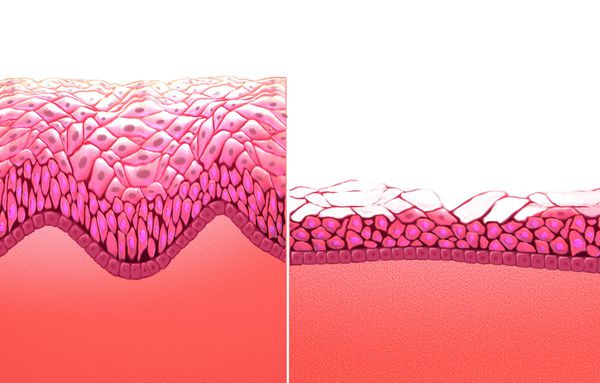
Стенки влагалища состоят из трех слоев: внутреннего слоя, который выстлан многослойным плоским эпителием; среднего мышечного и наружного соединительнотканного слоев (или волокнистого слоя). Атрофические процессы, захватывающие соединительнотканные и мышечные структуры влагалища, а также мышцы тазового дна, уретры, мочевого пузыря, особенно выражены в слизистой влагалища. Известно, что у женщин слизистая оболочка влагалища состоит из четырех основных слоев эпителиальных клеток: базальный слой; парабазальный слой (или митотически-активный); промежуточный гликогенсодержащий слой; поверхностный (слущивающийся) [11]. Эстрогеновые рецепторы располагаются в основном в базальном и парабазальном слоях влагалища и практически отсутствуют в промежуточном и поверхностном [10]. Дефицит эстрогенов блокирует митотическую активность базального и парабазального слоев эпителия влагалищной стенки, а следовательно, и пролиферацию влагалищного эпителия [12]. Следствием прекращения пролиферативных процессов во влагалищном эпителии является исчезновение гликогена — питательной среды для лактобактерий, таким образом из влагалищного биотопа полностью элиминируется его основной компонент — лактобациллы [3, 12].
Известно, что перекись-продуцирующие лактобациллы, преобладающие в микробиоцинозе влагалища у женщин репродуктивного возраста, играют ключевую роль в предотвращении появления заболеваний урогенитального тракта [10, 11]. Вследствие расщепления гликогена, который образуется в эпителии влагалища при условии наличия достаточного количества эстрогенов, образуется молочная кислота, обеспечивающая кислую среду влагалища (в пределах колебаний рН от 3,8 до 4,4). Подобный защитный механизм приводит к подавлению роста патогенных и условно-патогенных бактерий. В период постменопаузы слизистая оболочка влагалища утрачивает эти защитные свойства, истончается, легко травмируется с последующим инфицированием не только патогенными, но и условно-патогенными микроорганизмами.
Эстрогены являются главными регуляторами физиологических процессов во влагалище. Эстрогеновые рецепторы α присутствует во влагалище в пременопаузе и постменопаузе, в то время как эстрогеновые рецепторы β полностью отсутствуют или имеют низкую экспрессию в вагинальной стенке у женщин в постменопаузе. Наиболее высокая плотность эстрогеновых рецепторов наблюдается во влагалище и уменьшается по направлению от внутренних половых органов к коже. Плотность андрогеновых рецепторов, наоборот, низкая во влагалище и более высокая в области наружных половых органов. Рецепторы прогестерона встречаются только во влагалище и эпителии вульвовагинального перехода [10]. Поскольку в клетках стромы влагалища содержатся рецепторы к эстрогенам, то коллаген, входящий в состав соединительной ткани влагалищной стенки, является эстроген-чувствительной структурой, содержание которого уменьшается по мере прогрессирования эстрогенного дефицита. Так как рецепторы к эстрогенам располагаются не только в эпителии и строме влагалищной стенки, но и в эндотелии сосудов, в постменопаузе отмечается снижение кровообращения во влагалище до уровня различной степени ишемии. К тому же эстрогены являются вазоактивными гормонами, которые увеличивают приток крови, стимулируя высвобождение эндотелиальных медиаторов, таких как оксид азота, простагландины и фактор гиперполяризации эндотелия. Подобное прогрессирующее снижение кровотока в слизистой влагалища приводит к гиалинизации коллагеновых и фрагментации эластических волокон, увеличивая количество соединительной ткани [12].
Эстрогеновые рецепторы были также обнаружены на вегетативных и сенсорных нейронах во влагалище и вульве. В исследовании T. L. Griebling, Z. Liao, P. G. Smith было выявлено уменьшение плотности сенсорных ноцицептивных нейронов во влагалище на фоне лечения эстрогенами. Эта особенность может быть полезна в целях устранения дискомфорта, связанного с ВА, а именно в облегчении симптомов, таких как жжение, зуд и диспареуния, с которыми сталкиваются многие женщины в постменопаузе [5, 10].
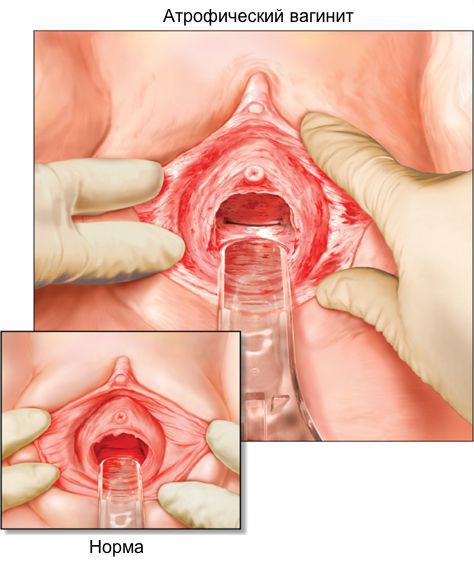
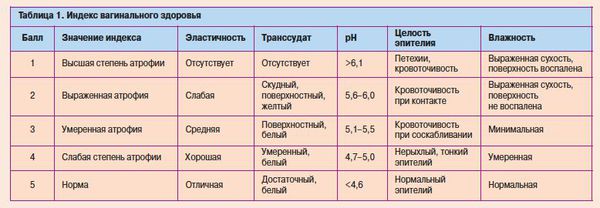
Атрофия слизистой вульвы и влагалища характеризуется истончением эпителия, уменьшением вагинальной складчатости, побледнением, наличием петехиальных кровоизлияний, признаков воспаления. Также вследствие инволютивных изменений происходит потеря упругости тканей, подкожно-жировой клетчатки и выпадение лобковых волос, снижение секреторной активности бартолиниевых желез [3, 13, 14]. Как правило, врачи диагностируют атрофию вульвы и влагалища на основании сочетания клинических симптомов и визуального осмотра. Исследователи все чаще настаивают на более объективных и воспроизводимых способах диагностики, не исключая субъективные жалобы пациента [13]. Исторически сложилось, что для диагностики ВА необходимы два основных объективных способа диагностики и оценки эффективности лечения: рН влагалища, а также подсчет вагинального индекса созревания (ВИС, преобладание клеток базального и парабазального слоев) [12, 13]. Интересно, что степень атрофических изменений, измеряемая индексом созревания, не всегда коррелирует с симптомами [15]. В исследовании, проведенном среди 135 менопаузальных женщин-добровольцев, которые прошли оценку симптомов, а затем рейтинг «вагинального здоровья» (оценка цвета влагалища, выделений, целостности и толщины эпителия, рН) и измерение индекса созревания, исследователи обнаружили слабую корреляцию между физическими проявлениями и индексом созревания.
Гормональные изменения, происходящие в течение жизненного цикла, оказывают влияние на вагинальную флору начиная от момента рождения до периода постменопаузы. Снижение эстрогенов в перименопаузе и постменопаузе приводит к уменьшению количества лактобактерий и изменению флоры в целом. Согласно данным S. L. Hillier, R. J. Lau, при детальном анализе микрофлоры влагалища 73 женщин в постменопаузе, не принимавших гормональную терапию, в 49% случаев не было выявлено лактобацилл. А среди тех, у которых они обнаруживались, концентрация последних была в 10–100 раз меньше, чем у женщин в пременопаузе [15]. В постменопаузе наиболее распространенными микроорганизмами являлись анаэробные грамотрицательные палочки и грамположительные кокки.
Несмотря на вышесказанное, у некоторых женщин симптомы атрофии прогрессируют вскоре после наступления менопаузы, а у других они не возникают даже в более поздние годы. Среди факторов, которые могут увеличить риск развития урогенитальной атрофии, курение является одним из наиболее изученных. Курение оказывает прямое воздействие на плоскоклеточный эпителий влагалища, снижает биодоступность эстрогена и уменьшает перфузию крови. Другими гормональными факторами, которые, как правило, имеют значение, являются уровни различных андрогенов, таких как тестостерон и андростендион. Предполагают, что после менопаузы у женщин с более высоким уровнем андрогенов, которые поддерживают сексуальную активность, отмечено меньше изменений, связанных с атрофией [12]. Кроме того, ВА наблюдается чаще у женщин, которые никогда не рожали через естественные половые пути [16].
Принимая во внимание патогенез заболевания, терапия эстрогенами является золотым стандартом лечения. Все клинические рекомендации по лечению УГА сходятся во мнении, что наиболее распространенным и эффективным методом лечения является системная или локальная гормональная терапия эстрогенами в различных формах, так как она достаточно быстро улучшает индекс созревания и толщину слизистой оболочки влагалища, снижает рН влагалища и устраняет симптомы ВА [3, 11–13]. Для лечения УГА, сочетающейся с симптомами климактерия, используют системную гормональную терапию. В остальных случаях отдают предпочтение местному лечению, которое позволяет избежать большинства системных побочных эффектов [12, 13]. Исследования показали, что системная заместительная гормональная терапия устраняет симптомы ВА в 75% случаев, в то время как локальная терапия — в 80–90%.
Эстрогенсодержащие препараты для локального применения, представленные в форме крема, таблеток, пессариев/суппозиториев, вагинального кольца, могут содержать эстриол, конъюгированные эквинэстрогены, эстрадиол или эстрон. Из трех природных эстрогенов человеческого организма эстриол имеет самый короткий период полувыведения и наименьшую биологическую активность. В России имеется многолетний опыт локального применения эстриолсодержащих препаратов, обладающих выраженным кольпотропным эффектом. Учитывая слабое пролиферативное действие на эндометрий при использовании эстриола, дополнительное введение прогестагена не требуется. Многочисленные исследования показали, что ежедневное применение эстриола в дозе 0,5 мг оказывает заметный пролиферативный эффект на эпителий влагалища. Локальное применение эстриолсодержащих препаратов является безопасным и эффективным подходом к предотвращению и лечению ВА, не имеющим ограничений по возрастному аспекту и длительности лечения. В настоящее время в европейских странах отмечается тенденция к локальному использованию низких доз для эстрогенов эстриола и эстрадиола.
В 2006 г. в Кокрановском систематическом обзоре были проанализированы 19 клинических испытаний, в которых приняли участие 4162 женщины в постменопаузе, распределенные по группам, в зависимости от принимаемого вагинально препарата с эстрогенами, а конечной точкой в исследовании была оценка эффективности, безопасности и приемлемости терапии. Четырнадцать исследований сравнивали безопасность различных препаратов, семь акцентировали внимание на побочных эффектах и четыре на безопасности лечения и воздействии на эндометрий. Семь исследований включали плацебо-группы, и во всех показано улучшение состояния пациентов, принимающих гормональную терапию (табл.).
Результаты анализа показывают, что вагинальные таблетки с эстрадиолом более эффективны по сравнению с вагинальным кольцом и что оба варианта лечения превосходят плацебо в устранении диспареунии, сухости и зуда во влагалище. Вагинальный крем с конъюгированными лошадиными эстрогенами (КЛЭ) превосходит увлажняющие кремы в устранении сухости, повышении эластичности и объема кровотока во влагалище. Однако не было обнаружено никаких различий между тремя проанализированными препаратами терапии (крем с КЛЭ, таблетки с эстрадиолом и эстрадиол-рилизинг-кольцо) по отношению к количеству парабазальных клеток, кариопикнотическому индексу, индексу созревания и вагинальному индексу здоровья. К тому же также сообщаются данные об отсутствии значительных различий в толщине эндометрия, гиперплазии и количестве побочных эффектов между вагинальным кольцом, кремом или таблетками. Тем не менее, незначительный риск вагинальных кровотечений был описан во всех исследованиях, в которых применялись различные методы местной терапии эстрогенами, а также возможное увеличение риска развития кандидоза [16].
В результате метаанализа, проведенного Cardozo и соавт., показано, что вагинальный путь введения эстрогенов является эффективным методом лечения ВА. Комбинация местной и системной терапии позволяет достичь результатов в более сжатые сроки. Кроме того, низкие дозы местных эстрогенов: эстрадиола или эстриола так же эффективны, как и при системном введении. Было показано, что трансдермальный пластырь с ежедневной дозой в 14 мкг эстрадиола обладает аналогичным воздействием на рН влагалища и на индекс созревания, как и вагинальное кольцо с 7,5 мкг эстрадиола [17].
Положительный терапевтический эффект местной гормональной терапии был также отмечен в ситуациях, выходящих за рамки лечения ВА, а именно таких, как снижение риска рецидивирующих инфекций мочевыводящих путей и развития гиперактивного мочевого пузыря. С учетом вышеизложенного, эстрадиол-рилизинг-кольцо было одобрено в качестве лечения дизурии и ургентного недержания мочи. В то время как системная гормональная терапия, наоборот, увеличивает процент возникновения стрессового недержания мочи и почечных камней [10].
Таким образом, местная терапия имеет ряд преимуществ по сравнения с системным введением препаратов. Она позволяет избежать первичный метаболизм в печени, минимально воздействует на эндометрий, имеет низкую гормональную нагрузку, минимальные побочные эффекты, не требует добавления прогестагенов, оказывает в основном локальный эффект.
С практической точки зрения и в связи с аналогичной эффективностью и безопасностью всех местных препаратов с эстрогенами, пациентка должна иметь возможность выбрать препарат, который она считает наиболее подходящим для нее. Она должна быть проинформирована о том, что эффект достигается после одного-трех месяцев лечения. Дополнительное назначение прогестагенов не является обязательным при использовании локальных форм эстрогенов [18]. В обзоре за 2009 г., посвященном местной гормональной терапии, говорится, что ни в одном исследовании не наблюдали пролиферацию эндометрия после 6–24 месяцев использования эстрогенов, так что литература, таким образом, дает уверенность относительно безопасности малых доз вагинальных препаратов с эстрогенами и не поддерживает одновременное применение системных прогестагенов для защиты эндометрия [13].
Помимо перечисленных выше методов лечения ВА на сегодняшний момент существуют такие, как терапия с использованием дегидроэпиандростерона, селективных тканевых эстрогеновых комплексов, селективных модуляторов эстрогеновых рецепторов и негормональные методы лечения, а также комбинированные препараты, содержащие ультранизкодозированный эстриол и лактобактерии.
В работе U. Jaisamrarn и соавт. впервые оценивалась эффективность и переносимость ультранизких доз эстриола (0,03 мг) в сочетании с жизнеспособными Lactobacillus acidophilus в краткосрочной и долгосрочной перспективе лечения симптомов ВА. Было выявлено, что комбинация эстриола и лактобактерий в течение 12 недель была достаточна для достижения статистически и клинически значимых результатов, включающих улучшение объективных параметров (ВИС, рН, доля латобактерий в микрофлоре влагалища), а также качество жизни женщин [19].
Среди селективных модуляторов эстрогеновых рецепторов (SERM) оспемифен является наиболее современным лекарственным средством. В 12-недельном трехфазном рандомизированном исследовании с участием 826 женщин в постменопаузе изучали эффективность данного препарата в дозе 30 мг, 60 мг по сравнению с плацебо. К 4-й и 12-й неделям оспемифен в указанных ранее дозах показал статистически значимое увеличение количества поверхностных клеток, снижение парабазальных клеток и рН во влагалище по сравнению с плацебо. Сухость влагалища значительно снизилась как в группах с 30 мг и 60 мг по сравнению с плацебо к 12-й неделе, в то время как диспареуния уменьшилась только в группе, получавшей препарат в дозе 60 мг. В ходе исследования было выявлено, что побочный эффект препарата, проявляющийся в виде приливов, наблюдался у 9,6%, 8,3% и 3,4% участников в группах, получавших оспемифен в дозе 30 мг, 60 мг и плацебо соответственно. Толщина эндометрия от исходного уровня к 12-й неделе в среднем изменилась на 0,42 мм, 0,72 мм и 0,02 мм у участниц выше представленных групп соответственно [21].
Комбинация конъюгированных эстрогенов и базедоксифена — селективного модулятора эстрогеновых рецепторов, известная как тканевой селективный эстрогенный комплекс (TSEC), изучалась в исследовании 3-й фазы, где 601 женщина была распределена по группам в зависимости от ежедневной получаемой терапии: 20 мг базедоксифена плюс конъюгированные эстрогены 0,45 мг (BZA/CE), или базедоксифен 20 мг плюс 0,625 мг конъюгированные эстрогены, или 20 мг базедоксифена и плацебо. В ходе исследования было выявлено увеличение доли поверхностных клеток и уменьшение доли парабазальных от исходного уровня к 12-й неделе в большей степени в группе BZA/CE по сравнению с плацебо и только BZA. РН влагалища существенно не изменился по сравнению с исходным к окончанию исследования в группе BZA или плацебо, но значительно уменьшились в обеих группах BZA/CE. Тем не менее, снижение рН влагалища было значимо ниже в группе BZA/CE 20 мг/0,625 мг, чем в плацебо-группе. Самые «назойливые» симптомы значительно уменьшились к 12-й неделе по сравнению с плацебо в группе BZA/СЕ 20 мг/0,625 мг, но не в группе BZA/СЕ 20 мг/0,45 мг. Не отмечено каких-либо существенных различий в побочных эффектах или случаях прекращения участия в исследовании между группами. Однако была отмечена более высокая заболеваемость вагинитами в группах лечения (BZA/CE) по сравнению с плацебо [22]. Таким образом TSEC, а именно базедоксифен в сочетании с конъюгированными эстрогенами представляет собой альтернативу терапии прогестинами для защиты эндометрия от стимуляции эстрогенами, при сохранении благоприятного воздействия эстрогенов на симптомы, связанные с менопаузой.
Несмотря на перечисленные методы лечения ВА, не стоит забывать о профилактике заболевания. Сохранение регулярной половой жизни рекомендуется, в общем, всем женщинам и, в частности, женщинам в менопаузе. Это связано с тем, что половой акт улучшает циркуляцию крови во влагалище, и семенная жидкость также содержит половые стероиды, простагландины и незаменимые жирные кислоты, которые способствуют сохранению вагинальной ткани [12].
Хотя официальная распространенность атрофии влагалища меняется в зависимости от численности и индивидуальных особенностей изучаемого населения, все большее число женщин страдают от этого состояния по мере старения населения. Одно из исследований, проведенное зарубежными коллегами, показало, что более 60% женщин испытывают симптомы ВА спустя 4 года после наступления постменопаузы. При этом всего лишь 4% женщин в возрасте 55–65 лет связывают вышеуказанные жалобы с атрофией влагалища, 37% знают, что это симптомы обратимы, и 75% женщин считают, что симптомы ВА негативно влияют на их жизнь. Учитывая деликатный характер этих симптомов, пациентки не решаются обратиться за медицинской помощью и, следовательно, страдают от прогрессирующих симптомов [10, 23]. Лишь 25% женщин с симптомами вагинальной атрофии обращаются за медицинской помощью. ВА является хроническим и прогрессирующим состоянием [10]. Значительное число женщин с симптомами ВА даже не представляют, что существует возможность эффективного лечения. Своевременное информирование пациентов о причинах возникновения вышеуказанных симптомов и возможностях их устранения может позволить в короткие сроки улучшить состояние женщин, возвратить им интерес к жизни и ее качество. Таким образом, проблема сохранения здоровья и профилактики заболеваний, обусловленных старением, приобрела в последние годы особое значение. В связи с ее актуальностью в настоящее время проводится разработка и внедрение новых лекарственных препаратов для лечения ВА, что позволит индивидуализировать подход к лечению пациентов.
Литература
ФГБУ НЦ АГиП им. В. И. Кулакова МЗ РФ, Москва
Abstract. According to forecasts to 2030 there will be 1,2 bln women in postmenopause. The state of oestrogen deficit in climacterical period cause vaginal atrophy with 15–57% of women. The latest data on the problem of pathogenesis, clinical manifestations and therapy of this state are provided in review.

_575.gif)