Аутореинфузия крови что это
Аутореинфузия крови что это
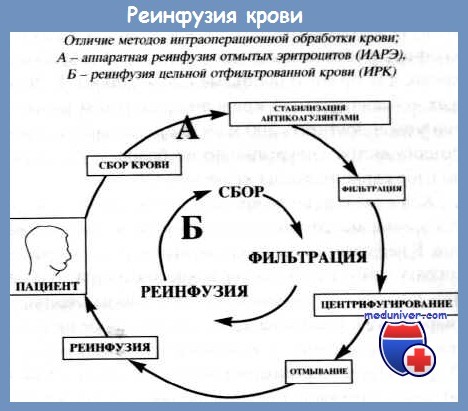
Обратное переливание пострадавшему собственной крови, излившейся в результате ранения сосудов в серозные полости, возвращая собственные клеточные элементы и иммунные тела, является наиболее физиологичным методом восполнения кровопотери.
В то же время для крови, собранной из серозных полостей, характерно полное отсутствие фибриногена на фоне высокой фибринолитической и тромбопластической активности, повышенное содержание свободного гемоглобина и ионов калия, что при реинфузии трех и более литров крови может повлиять на показатели гемостаза циркулирующей крови и на полноценность клубочковой фильтрации, особенно при нестабильной гемодинамике [Абакумов М.М. и др.].
В 1988 г. нашим сотрудником Н. В. Лебедевым была выполнена научная работа, в которой изучено влияние массивной реинфузии на систему гемостаза у пострадавших с травмой груди и живота. Было выяснено, что кровь, излившаяся в серозные полости при травме внутренних органов и находящаяся там в течение различного времени, претерпевает некоторые изменения. Исследованы образцы крови у 82 пострадавших с травмой груди и живота.
В этой крови было снижено количество эритроцитов до 3,9+0,77 х 10 12 /л, тромбоцитов до 181+42,4х10 9 /л, увеличено содержание свободного гемоглобина (1,7±0,5 г/л) за счет частичного разрушения форменных элементов. Обращало на себя внимание полное отсутствие фибриногена в излившейся в полость крови, а также повышение ее фибринолитической активности до 27,2±4,7 мин при травме груди и 54+10 мин при травме живота. Уровень плазминогена составлял 1,9±0,1 КЕ/мл, а содержание плазмина — 0,31±0,13 КЕ/мл.
Содержание ингибиторов протеолиза было несколько снижено и в среднем составляло 53,8+1,6 КЕ/мл.
Таким образом, кровь из брюшной полости не отличается от крови из грудной полости, за исключением величины фибринолитической активности плазмы.
Влияние массивной (более 1 л) реинфузии крови на состояние системы гемостаза циркулирующей крови изучено у 44 пострадавших с травмой груди и живота. Анализ системы гемостаза циркулирующей крови у пострадавших с внутриполостным кровотечением (до реинфузии) выявил выраженные гипокоагуляционные изменения. При этом временные показатели тромбоэластограммы (Р и К) были удлинены соответственно на 25% и в 1,5 раза, а максимальная амплитуда (МА) снижена на 20-25%. Содержание фибриногена находилось на уровне нижней границы нормы, а время рекальцификации плазмы было удлинено на 30-35% (составляя в среднем 175+21,5 с при травме живота и 210+21,0 с при травме груди).
Фибринолитическая активность крови была повышена на 11-22% по сравнению со средним уровнем, но не выходила за пределы физиологической нормы. При этом более выраженная активация фибринолиза отмечена в группе больных с ранениями груди, а гипокоагуляционные изменения в большей степени выражены у пострадавших с ранениями живота.
Переливание пострадавшим 1 л и более крови, изъятой из грудной или брюшной полостей, приводило к кратковременному усугублению гипокоагуляционных изменений. В первые часы после массивной реинфузии показатели R и К тромбоэластограммы удлинялись в 1,5-2 раза, амплитуда МА снижалась на 5-10% по сравнению с исходным уровнем, а величина фибриногена достигала 1,6-1,8 г/л. Время рекальцификации удлинялось до 196+20,9 с после реинфузии крови из брюшной полости и до 231+21,4 с при травме груди. Фибринолитическая активность изменялась незначительно и была в пределах нормы.
Содержание плазмина после реинфузии снижалось до 2,4 КЕ/мл (при норме 3,8-4,2 КЕ/мл,). В этот период наблюдалась тенденция к нормализации протеолитической активности и ингибиторов протеолиза.
Реинфузия оказывала влияние и на тромбоцитарное звено гемостаза: количество тромбоцитов в венозной крови снижалось до (140-180)х10 9 /л, а их агрегационная способность уменьшалась в 1,5 раза по сравнению с нормой.
Состояние выраженной гипокоагуляции сохранялось после реинфузии в течение суток. Однако уже начиная со вторых суток наблюдалась тенденция к нормализации показателей плазменного звена системы гемостаза циркулирующей крови. Так, к концу первых суток после операции и реинфузии уровень фибриногена достигал своих физиологических параметров, время рекальцификации плазмы снижалось до 218+24 с, сокращались временные показатели R и К тромбоэластограммы, максимальная амплитуда удлинялась до 21±2,9 мм при ранениях живота и до 35,9+2,0 мм при ранениях груди. Содержание плазминогена оставалось к концу суток сниженным до 2,55+0,24 КЕ/мл при ранениях живота и 2,97+0,34 КЕ/мл при ранениях груди.
В дальнейшем отмечалась постепенная нормализация показателей тромбоэластограммы, времени рекальцификации плазмы. В течение 6-11 сут после реинфузии в состоянии гемостаза у больных отмечались изменения, характерные для воспалительных и репаративных процессов, сопровождающих посттравматический и послеоперационный периоды: резко увеличивалось содержание фибриногена (до 5-7 г/л), возрастали протеолитическая и антипротеиназная активности крови. Содержание плазминогена к 7-8-м суткам после реинфузии приближалось к физиологическому уровню, достигая 3,4-3,5 КЕ/мл.
Данные тромбоэластограммы свидетельствовали о нормализации коагуляционных свойств крови. Количество и агрегационная способность тромбоцитов к концу наблюдений были в пределах нормы. У обследованных пострадавших не было отмечено клинического проявления ДВС-синдрома в виде различного вида геморрагии или тромботических осложнений.
Таким образом, данные, полученные при исследовании системы гемостаза у пострадавших с ранениями органов грудной и брюшной полостей, позволяют утверждать, что непосредственное влияние реинфузии на состояние гемостаза сказывается только в первые сутки. В последующем развиваются такие изменения в системе гемостаза, которые в целом характерны для патологических состояний, протекающих с воспалительными реакциями. Реинфузия крови на фоне гипокоагуляции не приводит к устойчивым патологическим сдвигам в системе гемостаза, которые требовали бы специфической коррекции.
В настоящее время во всех странах признана высокая эффективность такого метода восполнения кровопотери. Наибольшее распространение получила реинфузия аппаратом Cell Saver. Следует заметить, что еще в 1986 г. Н. В. Лебедевым совместно с инженером Всесоюзного Научно-исследовательского института медицинского приборостроения И. Н. Швырковым был создан и применен в клинической практике у 42 пострадавших с ранениями груди первый в СССР аппарат для реинфузии крови АРПК-1. Однако в силу исторических событий немедицинского характера этот аппарат после демонстрации на ВДНХ был благополучно забыт. (Стоимость аппарата Cell Saver в ценах 2010 г. колеблется от 30 до 50 тыс. евро.)
При использовании аппарата Cell Saver кровь, удаленная из серозной полости, попадает в систему центрифуг, позволяющую отделять эритроциты от плазмы и их промывать. Кровь пропускается сначала через макрофильтр с величиной пор 180-200 мкм, а затем через микрофильтр с величиной пор 20-40 мкм. Отмытые эритроциты, взвешенные в изотоническом растворе хлорида натрия, насосом перекачиваются в емкость для реинфузии. Использование аппаратов Cell Saver позволяет быстро осуществить забор крови из серозных полостей, в течение 5-10 мин ее обработать и начать реинфузию клеточного компонента.
Технология этого процесса сводится к сбору крови в стерильную емкость через фильтры, ее стабилизации, аппаратной фрагментации на компоненты (плазму и клетки), отмыванию клеток, повторную фрагментацию и концентрацию клеточного компонента.
Сбор крови осуществляет хирург с помощью двухпросветной трубки, на наконечник которой по микроканалу со скоростью 40-60 капель в минуту подается раствор антикоагулянта и по основному каналу с разрежением 100-150 мм рт. ст. кровь поступает в стерильный резервуар. В качестве стабилизатора обычно используют стандартный раствор цитрата натрия (АСД) в соотношении 15 мл цитрата на 100 мл крови.
Собранная кровь поступает в сепаратор, где центрифужным методом отделяется основная часть плазменной фракции, а оставшаяся клеточная часть крови разбавляется изотоническим раствором хлорида натрия, что обеспечивает более полное отмывание неизмененных клеток от их фрагментов и оставшейся части плазмы. Оставшийся клеточный компонент представляет собой концентрат клеток в изотоническом растворе, в котором практически нет плазмы (с концентрацией общего белка не более 1,7 г/л). Уровень гематокрита в этом клеточном концентрате составляет около 70 %, уровень гемоглобина — около 200 г/л.
Удаляя 97-98 % белков плазмы, методика Cell Saver обеспечивает освобождение клеточного компонента крови от активаторов плазминогена, плазмина, продуктов распада фибрина и других биологически активных веществ, влияющих на систему гемостаза. Отсутствие фибринолитической активности в компонентах крови, возвращаемых пациенту, позволяет избежать таких нежелательных последствий, как развитие ДВС-синдрома в случаях реинфузии объемов крови, превышающих ОЦК.
В то же время применение аппаратной реинфузии крови сопряжено с рядом трудностей. Во-первых, метод требует полноценного замещения плазменных компонентов путем инфузии не только и не сколько кристаллоидных и коллоидных растворов, сколько больших объемов свежезамороженной плазмы.
Во-вторых, при наличии в серозных полостях большого количества сгустков крови объем забора жидкой крови резко уменьшается, и в таких случаях глобулярный объем приходится восполнять переливанием донорской крови.
При продолжающемся массивном кровотечении может наступить тромбирование всех стерильных магистралей аппарата Cell Saver, что требует их срочной замены.
Резкое уменьшение объема возвращаемого клеточного компонента (по сравнению с объемом забранной крови) наблюдается при попытке подвергнуть реинфузии гемолизированную «старую» кровь. В таких случаях в процессе сепарации удаляются все неполноценные и фрагментированные эритроциты и возвращается не более 20-25 % клеточного компонента.
Наконец, и при аппаратной реинфузии существует проблема микробной контаминации. При ранениях полых органов брюшной полости (в меньшей степени — бронхов) и при массивной кровопотере (более 3,5 л) появляются жизненные показания для реинфузии, например, у пострадавших с редкой группой крови или при отсутствии донорской крови (эритромассы). Как показал опыт НИИ СП им. И. В. Склифосовского, в таких случаях многократное отмывание контаминированной крови позволяет в 10-12 раз снизить уровень контаминации микроорганизмов в клеточном компоненте, реинфузия которого не приводит к бактериемии [Кобзева Е. Н.]. С целью профилактики гнойно-септических осложнений этим пациентам проводится антибактериальная и иммунная терапия.
Таким образом, эффективность аппаратной реинфузии крови при ранениях шеи, груди, живота, и тем более при сочетанных ранениях,— несомненна. Но этот метод достаточно дорог. Кроме того, его широкое применение требует создания специальной трасфузиологической службы, введение в состав дежурной бригады специалиста — трансфузиолога. Поэтому во многих стационарах страны реинфузия осуществляется без аппаратов.
Обычно кровь собирают из полостей специальным черпаком в стерильный сосуд емкостью 1000 мл, содержащий 150 мл 4% раствора натрия цитрата (из расчета 15 мл стабилизирующего раствора на 100 мл крови). После стабилизации кровь переливается во флакон для внутривенной инфузии через самодельный фильтр (8 слоев марли). Однако такая методика несовершенна: эвакуация крови происходит слишком медленно, что затрудняет поиск источника кровотечения, открытое переливание из черпака во флакон и из флакона с консервантом в резервуар для реинфузии увеличивает опасность загрязнения крови.
Поэтому большинство хирургов используют закрытые аспирационные системы. Самая простая система состоит в следующем. Пробку стерильного флакона емкостью 500 мл, содержащего 75 мл 4 % раствора цитрата натрия, обрабатывают антисептическим раствором и прокалывают двумя иглами для гемотрансфузии: к длинной игле, конец которой опускают до дна флакона, присоединяют трубку с наконечником, обернутым в несколько слоев марли и забирающим кровь из серозной полости, а к короткой игле — шланг от электроотсоса. После наполнения флакона его переворачивают пробкой вниз и устанавливают в штатив для переливания крови.
Для предотвращения разрушения эритроцитов величина разрежения не должна превышать 100-140 мл рт. ст. Трубка, соединяющая наконечник отсоса с флаконом, должна быть из силиконизированной резины и должна быть цельной, без отдельных отрезков с переходниками, что увеличивает турбулентность крови и ее повреждение в ходе аспирации.
При массивной реинфузии (более 1,5-2 л) для нейтрализации гипокоагуляционного эффекта рекомендуется одновременно вводить фибриноген, раствор аминокапроновой кислоты. Для предупреждения нежелательного побочного действия больших доз цитрата натрия при реинфузии каждых 500 мл аутокрови внутривенно следует вводить 10% раствор хлорида или глюконата кальция.
Показанием к реинфузии является наличие 500 мл и более жидкой крови в плевральных или брюшной полостях. Постоянная готовность дежурных бригад к проведению реинфузии позволяет использовать ее у каждого пострадавшего с кровотечением.
Абсолютных противопоказаний для реинфузии крови в неотложной хирургии практически нет. Считается, что реинфузия противопоказана при повреждении полых органов брюшной полости или крупных бронхов, при длительном (свыше суток) нахождении крови в серозной полости и при выраженном гемолизе.
1. Ранения полых органов. Ясно, что при умеренной кровопотере и стабильном состоянии пострадавшего реинфузия контаминированной крови абсолютно противопоказана. Она противопоказана и при массивной кровопотере, если в наличии имеется достаточное количество компонентов донорской крови. Но как поступить при кровопотере 3-4 л и недостатке донорской крови или отсутствии крови подходящей группы?
К настоящему времени в литературе опубликованы около 400 наблюдений реинфузии контаминированной крови. Все эти наблюдения можно разделить на непреднамеренные и преднамеренные.
Реинфузия контаминированной крови является непреднамеренной, когда хирург собрал большое количество крови и принял решение о начале реинфузии еще до завершения тщательной ревизии органов. Как правило, это происходит в условиях дефицита донорской крови и критическом состоянии пострадавшего. К моменту, когда обнаруживается повреждение полого органа брюшной полости, реинфузии может подвергнуться 1000 мл крови.
На преднамеренную реинфузию хирурги шли в безвыходной ситуации, когда пациент практически погибал, а донорской крови не было в достаточном количестве (или не было вообще).
По данным отечественных и зарубежных авторов — Е. А. Вагнера и соавт.; С.Д.Попова и соавт.; И.И.Дерябина и соавт.; R.N. Smith и соавт.; J.W. Hauer и соавт., во всех этих наблюдениях имелась быстро проходящая бактериемия, которая исчезала под влиянием антибактериальной терапии в течение 3-5 дней. Ни в одном наблюдении у выживших пациентов не развился сепсис. Но при этом многие авторы предостерегают об опасности развития смертельного эндотоксического шока в случае добавления антибиотиков непосредственно в емкость с контаминированной кровью.
В НИИ СП им. Н. В. Склифосовского реинфузия крови при повреждении органов желудочно-кишечного тракта произведена 22 пострадавшим. У пяти пострадавших реинфузия производилась до ревизии органов брюшной полости и выявления повреждения кишечника, у 17 — в связи с тяжелым или терминальным состоянием пострадавшего, вызванным шоком и крово-потерей и недостаточным количеством донорской крови.
Общий объем перелитой аутокрови при ранении органов желудочно-кишечного тракта составил 21 050 мл (в среднем 1 л крови на пострадавшего). Ни в одном случае летальные исходы и осложнения не были связаны с проведением реинфузии крови.
Проведенный клинический анализ позволил нам сделать вывод, что при большой кровопотере, угрожающей летальным исходом, и при отсутствии достаточного количества донорской крови можно пренебречь наличием повреждения полых органов и произвести реинфузию. В подобных случаях обратное переливание излившейся в полости крови может сыграть решающую роль в спасении жизни пострадавшего.
2. Длительная экспозиция крови в серозных полостях. В настоящее время нет оснований полагать, что кровь, находившаяся в плевральной или брюшной полости без повреждения полых органов в течение 24 ч, непригодна для реинфузии. Кровь остается стерильной в течение 2-3 сут, а уровень свободного гемоглобина не превышает 500 мг% (310 мкмоль/л). По жизненным показаниям реинфузию следует применять и через 48 ч: наш опыт показал, что такая кровь остается стерильной, а концентрация свободного гемоглобина не достигает 200 мг% (124 мкмоль/л). Разумеется, чем дольше кровь находится вне сосудистого русла, тем меньше ее биологическая ценность; в ней уменьшается количество эритроцитов и тромбоцитов и увеличивается степень гемолиза.
3. Гемолиз. Патологическое действие гемолиза зависит от степени его выраженности во всем объеме циркулирующей крови, т.е. от концентрации свободного гемоглобина в реинфузируемой крови и от объема реинфузии.
Например, при реинфузии 2 л крови с содержанием свободного гемоглобина 800 мг% (596 мкмоль/л) его концентрация в циркулирующей крови пациента в первые часы достигнет уровня всего 30-40 мг% (18,6-24,8 мкмоль/л). Через сутки концентрация свободного гемоглобина в циркулирующей крови, независимо от степени его повышения сразу после реинфузии, не отличается от физиологической нормы.
Появление интенсивного розового окрашивания плазмы после центрифузирования крови означает, что уровень свободного гемоглобина более 800 мг%, что служит относительным противопоказанием для реинфузии более 2 л такой крови.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Реинфузия крови в хирургии. Современное состояние проблемы
А.Ю. Лубнин, В.В. Громова
ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко» Минздрава Российской Федерации, Москва, Россия
Для корреспонденции: Лубнин Андрей Юрьевич — д-р мед. наук, профессор, руководитель отдела анестезиологии, реанимации и интенсивной терапии ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» МЗ РФ, Москва; е-mail: lubnin@nsi.ru
Для цитирования: Лубнин А.Ю., Громова В.В. Реинфузия крови в хирургии. Современное состояние проблемы. Вестник интенсивной терапии имени А.И. Салтанова. 2019;4:58–67. DOI: 10.21320/1818-474X-2019-4-58-67
В работе на основании данных литературы и собственного опыта анализируется современное состояние проблемы реинфузии крови в хирургии. Рассмотрены технические решения, методические подходы, аппаратура для проведения реинфузии крови у хирургических больных. Также рассмотрены такие аспекты проблемы, как показания, противопоказания и особенности применения методики в различных областях хирургии.
Ключевые слова: реинфузия крови в хирургии, технические решения, показания и противопоказания, возможные осложнения
Поступила: 06.03.2019
Принята к печати: 05.11.2019
Введение
С момента возникновения хирургии как медицинской дисциплины и до наших дней операционная кровопотеря, в особенности массивная и стремительная, остается одним из наиболее грозных осложнений периоперационного периода, ответственных за недостаточную радикальность, инвалидизацию и даже летальные исходы. За долгие годы человечество все же научилось определенным образом бороться с проблемой операционной кровопотери с помощью трех основных подходов: 1) применение инфузионных растворов; 2) трансфузии заготовленных заранее донорских компонентов крови; 3) возврат больному его собственной крови, излившейся в ходе операции. Все три подхода имеют длинную и достаточно интересную историю, останавливаться на которой в рамках данной небольшой работы нет возможности, но есть интересные публикации на эту тему, и заинтересованный читатель может с ними ознакомиться [1–4]. Отметим лишь, что все эти три подхода в настоящее время продолжают развиваться и с успехом используются клинически. Инфузионные растворы, особенно коллоидные, позволяют быстро и эффективно ликвидировать дефицит ОЦК, вызванный операционной кровопотерей, правда, не замещая кислородтранспортной функции потерянных эритроцитов, однако при объеме до 30 или 50 % ОЦК это позволяет решить проблему хотя бы на некоторое время. Заготовка и хранение донорских компонентов крови все более совершенствуются, но главная проблема этого подхода, связанная с возможным инфицированием пациента, остается пока практически нерешенной. Более того, год от года количество потенциальных инфектагентов, передаваемых трансфузионно, расширяется (вирусы, бактерии, простейшие, прионы и т. д. Список очевидно не закончен). Возможно, поэтому третий подход в виде реинфузии собственной крови больного, потерянной в ходе операции, а иногда и в ближайшем послеоперационном периоде, представляется все более интересным и перспективным.
Так получилось, что шесть лет назад нам удалось собрать замечательный авторский коллектив — группу авторов из разных клиник — и выпустить книгу по дан- ной теме [5]. Насколько я знаю, ни я сам, ни другие авторы этой книги не прилагали каких-либо героических усилий по ее распространению. Тем не менее она довольно быстро разошлась по стране и получила даже определенные положительные оценки. Спасибо. Одна- ко с 2013 года прошло шесть лет — срок не большой, но и не малый, и, отчасти по определенным внешним мотивам, отчасти из внутренних побуждений, нам захотелось посмотреть, что же изменилось за это время в клинической «реинфузиологии». Обратившись к поисковой системе PubMed по теме «blood reinfusion», мы обнаружили более 2000 публикаций, что совсем не мало. Кроме того, весной 2018 года мне [А.Л.] удалось поучаствовать в очередной сессии NATA, на которой проблема реинфузии крови также была в центре внимания. Попробуем взглянуть на все это внимательно.
Терминология
На наш взгляд, важно с самого начала договориться об использовании адекватной терминологии. Дело в том, что в настоящее время существует целый ряд различных кровесберегающих технологий, в ходе реализации которых собственная кровь пациента эксфузируется из его организма с последующим возвратом. Это прежде всего предоперационное аутодонорство (ПАД) и острая изоволемическая гемодилюция (ИВГД). Нам представляется, что это достаточно эффективные самостоятельные методики, но причислять их к реинфузии крови (РК) неправильно. Здесь и далее в изложении мы понимаем под РК только возврат оперируемому пациенту компонентов крови, полученных из его собственной, потерянной в ходе хирургического вмешательства.
Простая и аппаратная реинфузия крови
Этот, казалось бы, вполне очевидный момент читатель должен уяснить себе сразу, хотя информация по этой теме за последние годы существенных изменений не претерпела. Следует сразу отметить, что так называемые простые (не аппаратные) методы РК в настоящее время имеют больше историческое значение и могут быть использованы клинически только в экстренных ситуациях и только для спасения жизни больного (ситуации массивного внутреннего кровотечения, как при нарушенной внематочной беременности; при отсутствии доступного ресурса донорской крови). Это строгое ограничение обусловлено высоким риском вторичных осложнений такой РК, вплоть до возможности летального исхода. Поэтому в настоящее время использование простых методов РК при плановых хирургических вмешательствах признается недопустимым [6]. Тем удивительнее выглядит упорство некоторых производителей, которые до сих пор продолжают производить и торговать простыми устройствами для РК (системы типа Solcotrans Auto, Bellovac ABT Sangvia и подобные им), не предусматривающими какой-либо обработки излившейся или дренажной крови, кроме простой фильтрации.
Излившаяся раневая кровь может несколько отличаться по своему составу в различных областях хирургии (например, примесь жировых глобул в травматологии и ортопедии, амниотической жидкости в акушерстве), но в целом она характеризуется высоким содержанием таких крайне нежелательных компонентов, как разрушенные эритроциты и свободный гемоглобин, активированные лейкоциты и тромбоциты и, конечно, большое количество различных биологически активных веществ. Один из ведущих специалистов в мире по РК в хирургии, профессор Э. Ханзен вообще называл такую среду «супом». Не удивительно, что внутривенное введение такой трансфузионной среды часто вызывает тяжелые последствия [6]. Обработка раневой крови на селл-сейвере путем многократного отмывания стерильными кристаллоидными растворами и последующей сепарации в камере центрифуги позволяет, с одной стороны, удалить все нежелательные примеси, указанные выше, с другой — получить наиболее безопасный компонент (отмытые аутоэритроциты) [7]. Цена этой безопасности — безвозвратная потеря с промывной жидкостью тромбоцитов и плазменных факторов гемостаза. Но, как показывает клиническая практика, вопрос целенаправленной компенсации таких потерь становится актуальным только при массивной и сверхмассивной кровопотере.
Современные селл-сейверы
За прошедшие с выхода нашей книги шесть лет ситуация с коммерчески доступными селл-сейверами не сильно изменилась [8–10]. Те же производители и почти те же машины с почти теми же самыми техническими характеристиками. Единственное отличие, что мне удалось заметить на выставке при последней сессии NATA в Лиссабоне весной 2018 года, — уменьшение количества рабочих режимов в CATSmart до 3 с 11 в CATS прежних моделей. Очевидно, что производитель решил упростить машину. Оправданно это или нет, будущее покажет. Во всяком случае, качество реинфузата существенно не ухудшилось [11, 12].
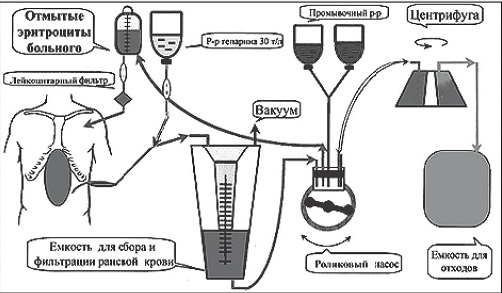
Принципиальное устройство большинства современных селл-сейверов схематично представлено на рис. 1 и мало чем отличается у различных производителей.
Рис. 1. Принципиальная схема устройства селл-сейвера [14]
Основными компонентами любого селл-сейвера являются: 1) отсосная двухпросветная линия и кардиотомный резервуар; 2) центрифуга с магистралями; 3) роликовый насос (насосы), обеспечивающий движение всех жидкостей в контуре селл-сейвера; 4) емкость для сбора отмытых эритроцитов.
Отсосная линия селл-сейвера отличается от таковой обычного хирургического отсоса наличием специального второго канала, через который на кончик отсоса подается стерильный раствор антикоагулянта (гепарин или цитрат).
Это важно для предотвращения образования тромбов и сгустков в собираемой раневой крови. Величина разряжения в отсосной системе может иметь значение. Слишком большие значения вакуума (более 100 см Н2О) могут привести к увеличению количества разрушенных эритроцитов [8]. Кардиотомный резервуар в большинстве коммерчески доступных моделей селл-сейвера рассчитан на объем 2–3 литра, а встроенные в него крупнодисперсные фильтры позволяют удалять крупные частицы.
Центрифуга с магистралями являются «сердцем» любого селл-сейвера. Обычная центрифуга типа Latham имеет характерный вид колокола. Такая модель с не- большими модификациями использована в большинстве селл-сейверов, выпускаемых различными фирмами. Незначительно отличается от нее центрифуга типа Baylor. И только в аппарате САTS, разработанном фирмой «Фрезениус», центрифуга устроена принципиально иначе, что и позволяет, в отличие от всех остальных устройств, проводить непрерывную обработку раневой крови [8, 13].
Роликовые насосы продвигают стабилизированную раневую кровь, промывную жидкость и готовый реинфузат по магистралям. Качество обработки реинфузата (содержание Hb) и попадание воздушных эмболов в магистрали контролируют специальные сенсоры прибора. Емкость для сбора отмытых эритроцитов — это последний обязательный компонент селл-сейвера перед возвратом реинфузата пациенту.
Режимы обработки
Режимы обработки могут быть различными, и с этой позиции все имеющиеся в настоящее время селл-сейверы могут быть разделены следующим образом:
Наличие достаточного количества селл-сейверов с различными техническими характеристиками является, на наш взгляд, позитивным моментом, так как позволяет пользователю выбрать машину под свои конкретные потребности.
Показания и противопоказания для проведения реинфузии крови в хирургии
По этому разделу ожидаемо принципиальных изменений за прошедшие шесть лет не произошло. Прежние, выстраданные практикой, положения остаются актуальными. Показания для использования РК в хирургии достаточно просты и вполне очевидны: все оперативные вмешательства, проведение которых сопряжено с риском развития массивной операционной кровопотери. Предполагаемый объем операционной кровопотери – это, бесспорно, важный практический фактор, так как, с одной стороны, РК — это относительно недешевая процедура, а с другой — при массивной и сверхмассивной операционной кровопотере РК может сильно изменить структуру ИТТ в сторону аутокрови [15]. В настоящее время в нашей клинике (Центр нейрохирургии им. Н.Н. Бурденко), если по каким-либо техническим причинам мы не можем обеспечить проведение РК пациенту с прогнозируемой массивной кровопотерей (1 должный ОЦК и более), мы откладываем проведение планового нейрохирургического вмешательства [16].
Однако здесь возникает вопрос прогнозирования объема предстоящей операционной кровопотери. Для пациентов с нейрохирургической патологией, с которыми мы и имеем дело в нашей клинике, нам удалось за годы работы выработать перечень таких прогностических признаков (табл. 1). Очевидно, что для любой из областей хирургии, где планируется применение РК, необходимо сформулировать свой аналогичный перечень прогностических критериев.
Таблица 1. Прогностические критерии массивной операционной кровопотери в нейрохирургии (цит. по [17])
Критерий
Большой объем опухоли и его непосредственная близость к крупным артериальным и венозным коллекторам
Выраженное накопление контрастного вещества тканью опухоли при КТ и МРТ
Выраженная собственная сосудистая сеть опухоли, контрастируемая при церебральной ангиографии
Анамнез предыдущих хирургических вмешательств, свидетельствующий о массивной операционной кровопотере
Врожденные или приобретенные нарушения гемостаза в виде гипокоагуляции
Конечно, как и любое прогнозирование, перечень из табл. 1 может давать ошибку. Но в этом случае мы рискуем лишь затратами на инсталлированный, но не использованный по назначению стартовый набор «расходки» (отсос и кардиотомный резервуар), стоимость которых невелика. Существенно же более дорогую центрифугу и магистрали следует инсталлировать уже только по факту состоявшейся массивной кровопотери [8].
По сравнению с простыми и понятными показаниями для РК в хирургии противопоказания для ее применения существенно более многочисленны и сложны. Согласно консенсусу экспертов американской ассоциации банков крови (ААВВ), противопоказания для применения РК в хирургии могут быть абсолютными и относительными [18] (табл. 2).
Таблица 2. Противопоказания для применения методики РК в хирургии
I. Абсолютные противопоказания
1. Наличие в раневой крови гноя
2. Наличие в раневой крови примеси содержимого толстого кишечника
3. Наличие в раневой крови примесей веществ, запрещенных к в/в введению. (некоторые антибиотики, бетадин, перекись водорода, дистиллированная вода, спирт, авитен и другие местные гемостатические препараты, созданные на основе коллагена)
II. Относительные противопоказания
1. Примесь в раневой крови амниотической жидкости
2. Примесь в раневой крови содержимого тонкого кишечника
3. Применение АР при онкохирургических вмешательствах
Некоторые из положений, приведенных в табл. 2, представляются нам далеко не бесспорными. Например, примесь перекиси водорода или дистиллированной воды. Понятно, что попадание этих химических соединений в кровь может спровоцировать гемолиз. Но этот процесс развивается в ране и в кардиотомном резервуаре; в дальнейшем и гемолизированные эритроциты, и свободный гемоглобин будут удалены в процессе обработки раневой крови на селл-сейвере. А наличие спирта в крови вообще не всегда омрачает жизнь! Относительные же противопоказания, как нам представляется, в настоящее время вообще перестали быть противопоказаниями.
Примесь амниотической жидкости в реинфузате. Амниотическая жидкость содержит колоссальное количество самых различных биологически высоко активных веществ, и чем обычно заканчивается ее попадание в системный кровоток матери, хорошо известно. Это тяжелейшая катастрофа с высокой летальностью. Однако есть отдельные исследования, правда только с одной из машин (CATS), в которых было убедительно показано, что при использовании режима высококачественной обработки (High Quality Wash) достижимо полное устранение амниотической жидкости из реинфузата [19, 20]. Это означает, что при использовании машин высокого класса и в режимах усиленного отмывания мы не подвергаем наших пациентов никакому дополнительному риску. Ситуация с примесью в реинфузате содержимого тонкого кишечника примерно такая же, как и в случае с амниотической жидкостью. Качественная обработка на хорошем приборе позволяет решить и эту проблему — получить качественно отмытые аутоэритроциты [8].
Онкология
Это одна из наиболее сложных и до сих пор обсуждаемых тем касательно РК. Рассмотрим ее подробнее. С одной стороны, онкохирургия является одной из наиболее «кровавых». Кровопотери при онкохирургических вмешательствах зачастую могут достигать по объему 2–3 должных ОЦК, особенно при мультиорганных поражениях или когда в онкологический процесс вовлечены магистральные сосуды [21, 22]. С другой стороны, риск попадания жизнеспособных опухолевых клеток в реинфузат и, как следствие, в системный кровоток пациента является абсолютно реальным, а экспериментальные исследования на лабораторных животных подтвердили способность этих опухолевых клеток вызывать рост вторичных метастатических узлов опухоли [22–25]. Конечно, справедливости ради следует признать, что наличие опухолевых клеток в крови пациента не является феноменом, идентичным метастазированию. Так, феномен наличия опухолевых клеток в крови описан у 70 % больных раком желудка и 50 % пациенток с раком молочной железы [22], но при этом статистика отдаленного метастазирования у этих пациентов существенно ниже. Понятно, что метастазирование — это сложный многокомпонентный биологический процесс, но наличие опухолевых клеток в крови, возможно, является его основополагающим фактором [26, 27].
Интересна предыстория внедрения реинфузии крови в онкохирургию. В 80–90-х годах прошлого столетия, когда РК крови только начала активно внедряться в хирургическую практику, в США была проведена серия исследований по применению РК с помощью селл-сейверов именно в онкохирургии (удаление рака простаты, матки и др.) [28–31]. Особенностью этих исследований было то, что в них авторы вовсе не использовали никаких мер против контаминации реинфузата опухолевыми клетками! Как это получилось возможным при наличии строгого контроля со стороны FDA и других аналогичных структур в продвинутых в медицинском отношении странах — не вполне понятно, но для нас интересно другое: авторы проследили катамнез больных в группах ауто- и донорской крови, и выяснилось, что в группах пациентов с реинфузией аутокрови, даже без использования каких-либо мер по очистке реинфузата от примеси опухолевых клеток, выживаемость была в 2–3 раза выше, чем в группах больных, у которых была использована донорская кровь! Авторы объяснили это выраженным иммуносупрессивным эффектом донорских компонентов крови.
Тем не менее сейчас все не так уж безнадежно, и человечество выработало несколько решений для этой непростой проблемы. Вот они.
Наличие даже не одного, а двух надежных способов решения проблемы контаминации реинфузата опухолевыми клетками позволяет в целом рассматривать возможность эффективного использования аппаратной реинфузии крови в онкохирургии как решенную проблему. Тем более шокирующим для меня [А.Л.] прозвучало выступление доктора P. Meybohm (Германия) на спонсорском сателлитном симпозиуме в Лиссабоне. Докладчик, не сильно задумываясь, перечислил онкологию в числе противопоказаний к реинфузии крови (?!). Правда, как сообщил потом докладчик, его опыт занятия клинической «реинфузиологией» насчитывает всего-то пять лет. Ну а с многочисленными публикациями своего соотечественника профессора Эрнила Ханзена, он, по-видимому, просто не знаком. Онкология в настоящее время противопоказанием для аппаратной реинфузии крови не является. Надо просто использовать известные методы деконтаминации реинфузата, эффективность которых убедительно доказана.
Осложнения методики реинфузии крови
Как и любой методике, РК присущи определенные осложнения, хотя в огромном исследовании, приводимом DeAndrade et al. (более 43 000 пациентов), общая частота осложнений аппаратной РК оказалась экстремально низкой — от 0 до 0,0006 % [37]. К ним следует отнести системные нарушения гемостаза, гемолиз, воздушную эмболию и бактериальную контаминацию реинфузата.
Развитие системных нарушений гемостаза в ситуации массивной операционной кровопотери является вполне закономерным явлением из-за простой потери тромбоцитов и плазменных факторов гемостаза. Если учесть тот факт, что селл-сейвер позволяет вернуть больному только отмытые эритроциты, причина развивающейся гипокоагуляции становится вполне понятной. Вряд ли обоснованно считать эту ситуацию осложнением именно РК. Коррекция нарушений гемостаза с помощью донорских тромбоцитов и СЗП (донорской или ауто) представляется эффективным решением этой проблемы [8, 15].
Ранее в литературе обсуждался вопрос о возможном развитии системной гипокоагуляции из-за попадания антикоагулянта (гепарин, цитрат), используемого для стабилизации излившейся крови, в кровь оперируемого больного в результате реинфузии [8]. Однако последующие исследования убедительно показали, что в процессе обработки раневой крови на селл-сейвере происходит полное отмывание антикоагулянта, а сам реинфузат не вызывает серьезных нарушений в системе гемостаза у пациента [38–40].
Относительно редко, но в результате РК возможно развитие гемолиза в реинфузате с последующей гематурией и даже острым почечным повреждением [41–43]. Его развитию могут способствовать вполне очевидные факторы, такие как механическое повреждение эритроцитов роликовыми насосами, контакт крови с магистралями контура селл-сейвера, высокие цифры разряжения в отсосе, разрушающий эффект УЗИ-аспираторов. Независимым предрасполагающим фактором является возможная патология мембран эритроцитов. Важно помнить о реальной возможности развития этого осложнения, риск которого особенно возрастает при сверхмассивных кровопотерях (2–3 должных ОЦК), когда эритроциты проходят через контур селл-сейвера 2–3 раза, и быть готовым к его лечению. Ключевым моментом в лечении этого осложнения и профилактике его наиболее тяжелого вторичного осложнения — развития ОПН — являются ранняя ощелачивающая терапия и форсированный диурез.
Воздушная эмболия, даже с летальным исходом, как осложнение РК, хотя и было описано в литературе [44], но имеет скорее историческое значение, так как относится к тем далеким временам, когда селл-сейверы имели совсем примитивную конструкцию. Все современные машины для РК оснащены датчиками детекции воздушных эмболов, которые вызывают немедленную остановку процесса при попадании даже небольшого количества воздуха в магистрали [14].
Проблема бактериальной контаминации реинфузата до сих пор остается недооцененной. К сожалению, это справедливо и для нашей книги, где данная проблема даже не рассматривается. Извините. Ряд специальных бактериологических исследований выявил достаточно настораживающую ситуацию: даже в таких относительно «чистых» областях хирургии, как нейро- и кардиохирургия, а также трансплантология, частота бактериальной контаминации реинфузата на основании результатов его бактериологических посевов может достигать 70–80 % [45–47]. Основными бактериями, высеваемыми из реинфузата в этих ситуациях, являются микроорганизмы, содержащиеся в воздухе операционной и на коже пациента. Клинически важным, однако, остается тот факт, что АР при такой частоте бактериальной контаминации исключительно редко сопровождается признаками сепсиса или генерализованной инфекции. В рамках рассматриваемой проблемы определенный интерес представляет результат метаанализа по частоте инфекционных осложнений среди больных, получавших для компенсации операционной кровопотери реинфузат либо донорские эритроциты [48]. Частота послеоперационных инфекционных осложнений оказалась достоверно выше в группе больных, получивших донорские эритроциты, что авторы склонны объяснять их выраженным иммуносупрессивным эффектом. Аналогичные результаты были получены недавно на большом массиве ортопедотравматологических больных [49]. Другой, вполне логичный подход в решении этой проблемы предложили Perez-Ferrer et al. [50]. Они добавили в иригационный раствор ванкомицин в концентрации 10 мкг/мл. Последующие посевы реинфузата в исследуемой группе остались стерильными, тогда как в контрольной группе (без ванкомицина) рост был отмечен в 50 % наблюдений. Снижению бактериальной контаминации реинфузата способствует также применение лейкоцитарных фильтров [51].
Другие осложнения реинфузии крови
Попадание частиц кобальта и хрома в реинфузат описано при установке металлических имплантов в единичном наблюдении [52]. Kim и et al. описали формирование фибриновых сгустков и эритроцитарных агрегатов в реинфузате в двух клинических наблюдениях [53], однако эта информация вряд ли имеет серьезное практическое значение, в том случае если при трансфузии эритроконцентрата используются лейкоцитарные фильтры. Следует ли считать иммунологические модуляции, вызываемые процедурой РК, осложнением методики — большой вопрос [54].
Особенности применения РК в различных областях хирургии
Более подробно эта информация приведена в нашей книге. Здесь же мы кратко остановимся только на от- дельных ключевых вопросах.
Сердечно-сосудистая хирургия является, по-видимому, основным полем для использования методики РК. Величина операционной кровопотери часто является достаточно большой; аппаратной обработке может быть подвергнута не только раневая, но и дренажная кровь в послеоперационном периоде и содержимое контура аппарата искусственного кровообращения; кровь пациента часто уже содержит антикоагулянты, что препятствует развитию тромботических осложнений; грудная полость, полости сердца и сосудов относительно стерильны. Поэтому публикаций по применению РК в кардиохирургии много. Резюме их однозначно свидетельствует об эффективности такого подхода [55–57]. И это касается не только больших кардиохирургических операций, но и малоинвазивных, и их осложнений [58, 59].
В травматологии и ортопедии кровопотери так- же могут быть значительными по объему, но главной проблемой, специфической для этих больных, является риск попадания жировых глобул из костного мозга в реинфузат и далее в системный кровоток пациента с развитием синдрома жировой эмболии. Решение этой проблемы связано с применением фильтров, причем интересно, что специальные жировые фильтры по своему «делипидизирующему» эффекту оказались менее эффективными, чем простые лейкоцитарные [60].
Массивная кровопотеря в акушерстве до сих пор остается одной из ведущих причин материнской летальности. Учитывая тот факт, что РК — это единственный метод кровесбережения, эффективность которого возрастает с увеличением объема операционной кровопотери, его применение в акушерстве абсолютно показано [61]. Опасность представляет возможность попадания в реинфузат околоплодных вод с последующим развитием синдрома эмболии околоплодными водами. Однако, как уже упоминалось выше, современные селл-сейверы позволяют эффективно отмывать эритроциты и в этой клинической ситуации, а экономическая эффективность РК в акушерстве считается в настоящее время доказанной при значительной по объему кровопотере [62–65].
Применение РК в онкохирургии связано с риском контаминации реинфузата опухолевыми клетками, с последующим возможным развитием отдаленного метастазирования. Использование лейкоцитарных фильтров, особенно облучение реинфузата, позволяет решить и эту проблему [17].
В нейрохирургии реализация РК может быть затруднена из-за проблемы эффективного сбора раневой крови. Применение ультразвуковых аспираторов может существенно снизить эффективность РК из-за повышенного разрушения клеток крови [16]. В случае же нейроонкологии проблема возможной контаминации реинфузата опухолевыми клетками также представляется актуальной (возможные ее решения рассмотрены выше).
Большое количество публикаций за последние пять- семь лет посвящено применению аппаратной РК в спинальной нейрохирургии и при коррекции сколиоза [66– 71]. Все авторы отмечают клиническую эффективность аппаратной РК при этих вмешательствах, с некоторыми расхождениями в оценке экономической эффективности методики. Причем метастатические поражения при этом исключением не являются [72, 73].
В детской хирургии, особенно у детей младшего возраста, серьезной проблемой является небольшой объем реинфузата. В этой клинической ситуации обойтись без донорских компонентов крови крайне сложно, но РК при этом может уменьшить вынужденную трансфузионную нагрузку на организм оперируемого ребенка [74, 75].
При трансплантации печени, частота которой сей- час в мире достигает 25 000 в год, аппаратная РК рассматривается как рутинная процедура [76].
Заключение
Идея компенсации операционной кровопотери при хирургических вмешательствах с помощью возврата излившейся раневой крови оперируемому больному, возникшая много десятилетий назад, прошла сложный путь и в настоящее время реализована в эффективную медицинскую технологию. Реинфузия крови позволяет существенно снизить трансфузионную нагрузку на больного донорскими компонентами крови, а в ряде случаев, при успешном сочетании с другими кровесберегающими методиками, полностью отказаться от применения донорских компонентов. Методика РК не только развивается технически, но и получает все большее клиническое распространение. Мы искренне надеемся, что кратко приведенная здесь информация по методике РК будет способствовать повышению интереса к ней и еще более широкому ее клиническому распространению.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Лубнин А.Ю., Громова В.В. — анализ информации, написание и редактирование текста статьи.