Бактериальная этиология что это такое
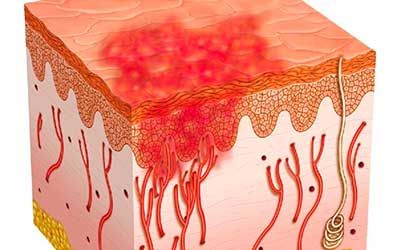
Бактериальные инфекции кожи
Бактериальные инфекции кожи — это обширная группа заболеваний, инициированных патогенными бактериями и характеризующихся поражением кожи и мягких тканей. Они считаются одними из наиболее распространённых в дерматологии и способны локализоваться либо на небольшом, либо на большом участке кожи (в течение нескольких часов). По своей тяжести такие инфекции очень разнообразны и варьируют в диапазоне от небольших узелков до состояний, несущих в себе угрозу для жизни пациента.
Пройти диагностику и курс лечения бактериальных инфекций кожи в Москве предлагает отделение дерматовенерологии ЦЭЛТ. Мы ведём профессиональную деятельность на столичном рынке платных медицинских услуг уже почти три десятилетия и пользуемся хорошей репутацией. Диагностика проводится на современном оборудовании, позволяющем выявлять заболевания даже на начальных стадиях развития, а их лечение осуществляется в соответствии с международными стандартами.
Этиология бактериальных кожных инфекций
Самыми распространёнными возбудителями кожных инфекций являются стафилококки и стрептококки:
Наши врачи
Виды бактериальных инфекций кожи
| Вид | Инфекция кожи и её особенности |
|---|---|
| Стафилококковые инфекции | Поверхностный фолликулит — характеризуется воспалительными процессами на кожи с белой гнойной серединой. Чаще всего инфекция поражает области волосяных покровов на руках, голенях и бёдрах, как правило, после эпиляции, проведённой без соблюдения гигиенических норм. Может перейти в хроническую форму. |
| Фурункулы — разновидность глубокого фолликулита, характеризуемая острым гнойно-некротическим воспалительными процессом фолликулов, сальных желёз, соединительной ткани вокруг них. Чаще всего инфекция обнаруживается в шейной, затылочной, бедренной области, на спине и даже на лице. В последнем случае может стать причиной серьёзных осложнений и виде сепсиса или менингита. | |
| Сибирская язва — ещё одна разновидность глубокого фолликулита. Является особо опасной инфекцией, характеризующейся очень быстрым развитием и острым течением. Она проявляется интоксикацией, воспалительными процессами кожи и лимфоузлов, внутренних органов. | |
| Панариций — инфекция, характеризующаяся острым гнойным процессом, поражающим пальцы верхних, реже — нижних конечностей. Проявляется болевой симптоматикой, отёками, покраснением, повышением температуры. На поздних стадиях развития требует хирургического вмешательства. | |
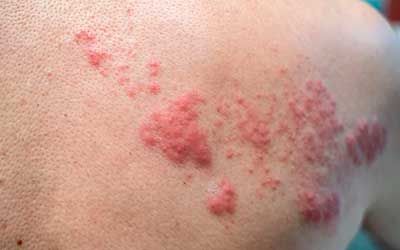
| Стрептококковые инфекции | Рожистое воспаление — инфекция, провоцируемая стрептококком группы «A». Она характеризуется развитием воспалительных процессов серозного или серозно-геморрагического характера, проявляющих себя очаговым поражением кожи ярко-красного цвета с отёком, общей интоксикацией организма и повышением температуры. Является одной из самых распространённых бактериальных инфекций. |
| Стрептодермия — инфекция, характеризующаяся развитием серозных воспалительных процессов без нагноений, резким отёком поражённого участка, быстрым формированием пузырьков или пятен, склонных к шелушению. | |
| Абсцесс — характеризуется формированием полости в подкожной жировой клетчатке или мышцах, заполненных гноем. Инфекция проявляет себя отёком, гиперемией, болевой симптоматикой. |
Диагностика и лечение бактериальных инфекций в ЦЭЛТ
Перед тем, как приступить к лечению, наши специалисты проводят диагностические исследования инфекции, позволяющие установить её вид, точную локализацию гнойника (если он имеется) и причины, вызвавшие появление проблемы. В зависимости от ситуации проводится объективный осмотр и дополнительные исследования в виде ультразвукового сканирования мягких тканей, пункции, лабораторных анализов.
Тактика лечения зависит от результатов исследований и индивидуальных показаний пациента. Как правило, она заключается в антибиотикотерапии, которую подбирают исходя из того, каким возбудителем была вызвана инфекция. Так, заболевания кожи, вызванные стафилококком, хорошо поддаются лечению макролидами. Они считаются наименее токсичными антибиотиками и сравнительно легко переносятся человеческим организмом. Что касается стрептококковых инфекций, то против них возможно использование пенициллина. Курс лечения им предусматривает инъекции в течение восьми дней, после чего пациенту назначают его пероральным приём. Важный момент — проверка индивидуальной переносимости препарата.
Наилучших результатов позволяет добиться комплексное лечение бактериальных инфекций. Помимо приёма антибиотиков оно должно предусматривать:
В ЦЭЛТ ведут приём врачи высшей категории и кандидаты наук с опытом практической работы не менее двадцати лет. Вы можете записаться к ним на приём онлайн через наш сайт или связавшись с нашими операторами: +7 (495) 788 33 88.
Данная страница не существует!
Услуги инфекционной клиники
Диагностика, профилактика и лечение
Фиброэластометрия и УЗ-диагностика молочных желез, щитовидной железы, мошонки, брюшной полости
Биохимия. Анализ крови: общий, клинический. Анализы на витамины, микроэлементы и электролиты. Анализ на ВИЧ-инфекцию, вирусные гепатиты, бактерии, грибки и паразиты
Максимально точное определение выраженности фиброза печени неинвазивным методом при помощи аппарата FibroScan 502 TOUCH
Гинеколог в H-Сlinic решает широчайший спектр задач в области женского здоровья. Это специалист, которому вы можете полностью доверять
Дерматовенерология в H-Сlinic — это самые современные и эффективные алгоритмы диагностики и лечения заболеваний, передающихся половым путем, грибковых и вирусных поражений, а также удаление доброкачественных невусов, бородавок, кондилом и папиллом
Возможности вакцинопрофилактики гораздо шире Национального календаря прививок. H-Clinic предлагает разработку плана вакцинации и современные высококачественные вакцины в наличии
Терапевт в H-Сlinic эффективно решает задачи по лечению заболеваний, которые зачастую могут становиться большой проблемой при наличии хронического инфекционного заболевания
Врач-кардиолог H-Сlinic проведет комплексную диагностику сердечно-сосудистой системы и при необходимости назначит эффективное терапию. Сердечно-сосудистые проблемы при инфекционных заболеваниях, требуют специфичных подходов, которые мы в состоянии обеспечить
Наша цель — новое качество вашей жизни. Мы используем современные диагностические алгоритмы и строго следуем наиболее эффективным протоколам лечения.
Общая терапия, Инфекционные заболевания, Гастроэнтерология, Дерматовенерология, Гинекология, Вакцинация, УЗИ и фиброэластометрия, Кардиология, Неврология
Биохимия, Общий/клинический анализ крови, Витамины и микроэлементы/электролиты крови, ВИЧ-инфекция, Вирусные гепатиты, Другие инфекции, бактерии, грибки и паразиты, Комплексы и пакеты анализов со скидкой
В наличии и под заказ качественные бюджетные решения и препараты лидеров рынка лечения инфекционных болезней. Аптека H-Clinic готова гибко реагировать на запросы наших клиентов. Мы поможем с оперативным поиском препаратов, которые обычно отсутствуют в сетях.
Пульмонолог «СМ-Клиника» рассказала о бактериальной пневмонии у взрослых
По данным статистики бактериальными пневмониями в среднем около 1000 пациентов на 100 тысяч населения. Особенно часто эта форма болезни бывает у пожилых людей, старше 75 лет или тех, кто страдает хроническими патологиями
АЛЕНА ПАРЕЦКАЯ
Врач-патофизиолог,
иммунолог, эксперт ВОЗ
ЕЛЕНА ЗАРЯНОВА
К.м.н., врач-пульмонолог высшей категории,
сомнолог «СМ-Клиника»
Бактериальная пневмония – частое осложнение у пациентов, которые лечатся в стационаре и поликлинике. В последние годы отмечен рост тяжелых форм, которые приводят к летальному исходу.
Что нужно знать о бактериальной пневмонии
Что такое бактериальная пневмония
Бактериальная пневмония – это воспаление легких, которое провоцируют патогенные бактерии, проникающие в дыхательную систему.
Такое воспаление формируется при двух условиях: или сам организм ослаблен, когда иммунная система не может эффективно бороться с бактериями, или это очень агрессивные бактерии, которые преодолевают сопротивляемость организма. Обычно в той или иной мере присутствуют оба варианта.
Причины бактериальной пневмонии у взрослых
Бактериальная пневмония чаще всего вызвана бактериями, которые считаются частью микрофлоры дыхательных путей. Эти микроорганизмы относятся к категории условно-патогенных. Если организм здоров, не ослаблен, иммунная система работает исправно, бактерии никак не вредят. Но при стрессе, операциях, обострении хронических болезней, тяжелых ОРВИ бактерии могут стать опасны.
Есть два варианта бактериальных пневмоний – внебольничная и внутрибольничная. Они сильно различаются по виду бактерий, которые вызывают воспаление.
При внебольничной пневмонии воспалительный процесс обычно провоцирует пневмококк, гемофильная палочка или стрептококк.
Внутрибольничную пневмонию вызывают особо агрессивные бактерии, устойчивые ко многим антибиотикам. Эти возбудители обычно живут в клиниках – золотистые стафилококки, синегнойная палочка, энтеробактерии и некоторые другие. Нередко такая пневмония возникает у людей, которым проводят ИВЛ.
Если пациенты страдают иммунодефицитом, у них пневмонию может вызывать легионелла, микоплазма, пневмококк, гемофильная палочка и пневмоцисты.
Бактерии проникают в легкие из воздуха, с током крови из воспалительных очагов в теле или с током лимфы, напрямую, при ранениях груди. Факторы риска, повышающие вероятность пневмонии, это:
Симптомы бактериальной пневмонии у взрослых
Во многом симптомы воспаления легких зависят от того, какая бактерия их вызывает. Чем агрессивнее микроб, тем тяжелее проявления. Самые типичные проявления бактериальной пневмонии:
Лечение бактериальной пневмонии у взрослых
Диагностика
Врач ориентируется на жалобы пациента и данные, которые он видит и слышит. Если доктор прослушает грудную клетку фонендоскопом, он услышит типичные хрипы, изменения дыхания и так называемую крепитацию (шум пораженного воспалением легкого). Подтвердить бактериальную пневмонию могут:
Современные методы лечения
Лечить бактериальную пневмонию в легких и среднетяжелых случаях можно дома, под контролем врача. При тяжелых формах – в клинике, палате интенсивной терапии и реанимации. Показаны постельный режим, легкое диетическое питание и обильный прием жидкости (или введение ее внутривенно).
Основное лечение – антибиотики: врач подбирает их, основываясь на данных анализов. Чаще всего используют пенициллины, цефалоспориновую группу или макролиды. Если это отдельные формы пневмонии – подбирают более узконаправленные препараты. Лекарства принимают перорально внутрь или в инъекциях внутримышечно до 14 дней, при тяжелом течении их вводят внутривенно.
Профилактика бактериальной пневмонии у взрослых в домашних условиях
Меры профилактики достаточно простые:
Популярные вопросы и ответы
Хотя бактериальная инфекция лечится антибиотиками, это не такое простое заболевание, как может показаться на первый взгляд. Воспаление легких может в короткие сроки привести к серьезным осложнениям, о которых нам рассказала врач-пульмонолог Елена Зарянова.
Чем отличается бактериальная пневмония от вирусной?
При бактериальной пневмонии первично поражаются альвеолы – они воспаляются и отекают, в них скапливается жидкость (экссудат), который пропитывает легочную ткань и приводит к ее уплотнению (инфильтрации и консолидации), уменьшению воздушности и нарушению газообмена в легких. Эти изменения приводят к падению уровня кислорода в крови, кислородному голоданию всего организма, развитию дыхательной недостаточности. Очаговые поражения в легких можно заподозрить при общем осмотре пациента и подтвердить при рентгенологическом исследовании легких.
Вирусная пневмония в отличие от бактериальной развивается в несколько этапов. Респираторные вирусы в первую очередь поражают эпителий верхних дыхательных путей, а затем спускаются в нижние дыхательные пути и поражают клетки альвеол (альвеоциты). Патогенное воздействия вирусов проявляется в ухудшении работы мукоцилиарного клиренса (аппарата нижних дыхательных путей, который обеспечивает защиту и очищение легких от воспалительных агентов). При этом облегчается проникновение бактерий в нижние отделы дыхательных путей, подавляется защитная, в том, числе антибактериальная функция клеток иммунитета, в результате чего создаются условия для формирования вирусно-бактериальных ассоциаций.
Микст-инфекция приводит к более тяжелому течению и изменению клинической картины заболевания, нарушению дренажной функции легких, к затяжному разрешению воспаления.
Какие могут быть осложнения при бактериальной пневмонии?
К наиболее частым осложнениям внебольничной пневмонии можно отнести развитие бронхо-обструктивного синдрома, который проявляется сужением дыхательных путей и характеризуется:
Еще одним серьезным осложнением, требующим госпитализации пациента, является разрушение ткани в результате легочного воспаления с формированием в легких полостей, заполненных гнойным содержимым (абсцессов) и развитием системного септического воспаления, которое может привести к поражению различных органов и систем, развитию острой и тяжелой дыхательной, сердечной, почечной и печеночной недостаточности.
У пациентов пожилого возраста, лиц с иммунодефицитными состояниями, имеющими хронические заболевания, риск осложнений от пневмонии очень высок, в связи с чем таких пациентов целесообразно сразу госпитализировать в стационар.
Когда вызывать врача на дом при бактериальной пневмонии?
Только врач может определить дальнейшую тактику ведения и лечения пациента. Не каждая пневмония требует госпитализации в стационар. Легкие и неосложненные формы пневмонии могут лечиться не дому. Но, если врачом принято решение о домашнем лечении, то больной должен находиться под пристальным наблюдением медицинских работников поликлиники или службы медицинской помощи на дому. В первые 6 часов после установления диагноза больному необходимо получить первую дозу антибиотика, рекомендованного врачом.
Если у больного к 3-му дню заболевания нет улучшения состоянии от назначенной антибактериальной терапии или отмечает постепенное нарастание дыхательных симптомов, повышение температуры тела и симптомов общей интоксикации к 7-му дню заболевания, то необходимо вызвать на дом врача или бригаду скорой помощи для решения вопроса о замене антибактериального препарата и возможной госпитализации с целью дальнейшего подбора лечения и дообследования в условиях стационара.
Бактериальная пневмония развивается быстро, начинается остро и проявляется следующими симптомами:
Можно лечить бактериальную пневмонию народными средствами?
Антибиотики являются основными и эффективными препаратами для лечения бактериальных пневмоний. Никакой речи о народных средствах в качестве первой линии лечения при пневмонии идти не может. Народные средства могут быть использованы только в качестве дополнительных средств для облегчения некоторых симптомов заболевания.
Острые кишечные инфекции вирусной и бактериальной этиологии у детей: современные возможности диагностики и терапии, роль метабиотиков
В статье представлены современные данные об этиологии острых кишечных инфекций, клинических проявлениях, современных методах диагностики и лечения. Обсуждаются вопросы пробиотической и метабиотической терапии при острых кишечных инфекциях. Обосновывается
The article presents modern data on etiology of acute intestinal infections, their clinical manifestations, modern approaches to diagnosis and treatment. The questions of probiotic and metabolic therapy in acute intestinal infections are discussed. The antimicrobial, antitoxic, enzymatic action of a preparation based on the concentrate of metabolic products of saccharolytic (L. acidophilus, L. helveticus and E. faecalis) and proteolytic (E. coli) microflora, is explained. Evidence of its effectiveness in the treatment of infectious diarrhea of different etiologies in children is presented.
Острые кишечные инфекции (ОКИ) остаются значимой проблемой здравоохранения во всех странах мира и принадлежат к числу ведущих причин заболеваемости, госпитализации и летальности, особенно в детском возрасте [1]. По данным ВОЗ, у детей ежегодно в мире регистрируется около 1,7 миллиарда случаев острой диареи, и от нее умирает 525 тысяч детей в возрасте до пяти лет [2]. В России в структуре инфекционной заболеваемости ОКИ по-прежнему занимают существенное место, второе после острых респираторных вирусных инфекций, и в 2016 г. по сравнению с 2015 г. отмечен рост заболеваемости ОКИ неуточненной этиологии на 5% (364,88 случаев на 100 тыс. населения), норовирусной инфекцией на 38% (15,51), сохранялся высокий уровень заболеваемости ротавирусной инфекцией (83,26) и сальмонеллезом (26,03) [3].
Этиология острых кишечных инфекций у детей
Острые кишечные инфекции является полиэтиологичной группой заболеваний (бактериальной, вирусной или протозойной), которые объединяет развитие симптомокомплекса острой диареи [4]. В разных странах этиологическая структура ОКИ может существенно отличаться [5].
Основными возбудителями ОКИ бактериальной природы являются микроорганизмы семейства Enterobacteriaceae. Известна роль около 50 сероваров рода Salmonella в развитии патологии у людей, преимущественно сальмонелл группы В. Наибольшее распространение в последние годы получила S. enteritidis. Шигеллезы, или дизентерию, вызывают бактерии рода Shigella, включающего более 40 серологических вариантов с наибольшим распространением шигелл Флекснера и Зонне. В последние годы отмечается рост удельного веса дизентерии, вызванной Shigella flexner 2a, для которой характерен выраженный деструктивный компонент при воспалении толстой кишки. Характерным свойством шигелл стала высокая полирезистентность к основным, наиболее употребляемым антибактериальным средствам.
Из других бактериальных агентов существенное значение у детей в качестве этиологических агентов ОКИ имеют патогенные эшерихии. Известны пять групп патогенных бактерий рода Escherichia, возбудителей эшерихиозов:
Из числа патогенных бактерий возбудителями ОКИ также являются иерсинии (Yersenia enterocolitica, из известных 30 сероваров которой в патологии человека основное значение имеют О3, О4, О5, О8), вибрионы холеры и НАГ-вибрионы.
Важную роль в развитии ОКИ у детей играет условно-патогенная микрофлора. Обусловленные ею заболевания чаще являются результатом активации собственной эндогенной флоры в результате несостоятельности системы защиты организма, что объясняет связанное с этим развитие тяжелой формы болезни и сложности в лечении. В числе наиболее актуальных условно-патогенных возбудителей — бактерии рода Citrobacter, Staphylococcus aureus, Klebsiella, Hafnia, Serratia, Proteus, Morganella, Providencia, Bacillus cereus, Clostridium perfringens и др. Бактерии Clostridium difficile обусловливают поражения толстой кишки в виде псевдомембранозного колита у пациентов, получавших интенсивную антибактериальную терапию [4].
Этиологические агенты бактериальных ОКИ у детей зависят от географического региона. В развивающихся странах холерный вибрион еще вызывает эпидемии, но самым частым бактериальным возбудителем ОКИ является Shigella, в частности в Африке и Южной Азии. В Европе наиболее распространенными бактериальными патогенами являются Campylobacter, Salmonella spp., энтеропатогенные и энтероагрегативные E. coli. В недавнем исследовании, проведенном в центральном Китае, наиболее часто выявляемыми кишечными патогенами оказались Salmonella spp. (8%), патогенные E. coli (5%), Campylobacter jejuni (3%) и Aeromonas spp. (2%) [5].
Вирусы являются преобладающими этиологическими факторами ОКИ у детей, прежде всего раннего возраста, и особенно у детей первого года жизни. Так, у детей до 80–90% случаев острой диареи являются вирус-ассоциированными [6, 7]. По данным систематических обзоров, в настоящее время ведущей причиной спорадических случаев и вспышек острого гастроэнтерита (ОГЭ) во всех возрастных группах является норовирусная инфекция, на долю которой приходится почти пятая часть ОГЭ. С норовирусами связывают развитие тяжелого ОГЭ у детей [8]. Несмотря на внедрение вакцинации против ротавирусной инфекции во многих странах, ротавирусы остаются актуальной причиной ОГЭ, особенно у детей младшего возраста, обусловливая более 200 тысяч летальных исходов, преимущественно в малоразвитых странах [9, 10]. Этиологическими агентами вирусных ОКИ являются также аденовирусы сероваров 40 и 41, энтеровирусы серовара 73, коронавирусы, калицивирусы и астровирусы. Изучается причинная роль в развитии острой диареи торовирусов, пикорнавирусов, бокавирусов [6].
Диагностика острых кишечных инфекций
На раннем этапе диагностики ОКИ с учетом обстоятельств заражения и характера и динамики клинических симптомов болезни решаются следующие задачи:
Эти данные служат основой клинического диагноза и важны для назначения адекватной патогенетической терапии еще до верификации этиологии заболевания.
Наиболее частым в клинике ОКИ вариантом поражения желудочно-кишечного тракта является синдром гастроэнтерита, обусловленный у детей преимущественно вирусными возбудителями и реже бактериальными. Признаки гастрита, как правило, чуть опережают проявления со стороны кишечника. Проявления гастрита при ОКИ характеризуются тошнотой, рвотой, давящими болями в области эпигастрия, болезненностью при пальпации желудка. Об энтерите свидетельствуют боль в животе, которая чаще локализуется в околопупочной области, реже бывает диффузная, диарея водянистого характера, которая по мере учащения стула существенно увеличивается в объеме. Объяснением этого служит секреторный или гиперосмолярный механизм диареи, который определяет развитие в короткий срок обезвоживания организма. В пользу синдрома энтерита свидетельствуют и такие признаки, как пенистый характер испражнений, раздражающих кожу, их кислый или зловонный запах. Цвет стула при энтерите может быть различным, в частности, при сальмонеллезе цвета «болотной тины», при ОКИ, вызванной энтеропатогенными вариантами эшерихий, — оранжевой окраски, для ротавирусной инфекции свойственна белесоватая окраска стула. Частым симптомом является метеоризм.
Синдром острого колита, свойственный ряду бактериальных и паразитарных ОКИ, сочетает в себе своеобразные проявления как болевого синдрома, так и особенности диарейного синдрома. Синдром колита наблюдается при энтероинвазивных вариантах эшерихиозов, шигеллезах, может развиваться при сальмонеллезе, кампилобактериозе, протеозе, стафилококковой инфекции, т. е. в тех случаях, когда возбудителям присущи выраженные инвазивные и цитотоксические свойства.
В дифференцировке синдромов энтерита и колита дополнительное значение имеют данные копрологического исследования. Основные дифференциальные критерии синдромов энтерита и колита при ОКИ представлены в таблице.
Сходство симптомов ОКИ в большинстве случаев не позволяет по клиническим признакам определить этиологию заболевания.
Ввиду большей доступности бактериологических исследований в рутинной клинической практике, уточнение этиологии ОКИ осуществляется чаще всего в отношении бактериальных инфекций. Решение проблемы диагностики вирусных ОКИ в последние годы связывают с внедрением в клиническую практику иммуноферментного анализа (ИФА) для выявления антигенов возбудителей (ротавирусов, норовирусов, астровирусов и др.) в различных субстратах (фекалиях, рвотных массах, промывных водах желудка). Чувствительность тест-систем ИФА для диагностики вирусных ОКИ оценивается как 60–90% при специфичности, близкой к 100%, но на практике чувствительность метода не превышает 70% [11]. Также разработана экспресс-диагностика норовирусной инфекции с использованием иммунохимических тестов, выявляющих антигены норовируса, — специфичность их близка к 100% [12].
В последнее десятилетие для верификации возбудителей ОКИ во многих странах мира все большее распространение получает метод полимеразной цепной реакции (ПЦР), в том числе ПЦР с детекцией в режиме реального времени (ПЦР-РВ). Метод используется как для диагностики у пациентов, так и для обнаружения энтеропатогенов в пищевых продуктах и объектах окружающей среды. Достоинствами метода ПЦР-РВ являются высокая специфичность, чувствительность, простота и удобство проведения анализа, возможность исследования различных биологических материалов, возможность выявления сразу нескольких патогенов в одной пробирке (мультиплексная ПЦР-РВ), быстрота получения результата, что позволяет отнести ПЦР к методам ранней этиологической диагностики [13, 14].
Установленный диагноз ОКИ должен содержать указание нозологической формы, если это возможно. В противном случае применяются в обозначении болезни обобщенные термины, такие как «острая кишечная инфекция», «пищевая токсикоинфекция». При формулировании клинического диагноза, наряду с названием болезни и возбудителя (в случае его выявления), указывается также клиническая форма болезни, ведущий синдром, степень тяжести, характер течения и осложнения. В случаях гастроэнтерита в диагнозе также необходимо указание степени эксикоза.
В общепринятых классификациях ОКИ выделяют:
1. По распространенности:
2. По ведущему клиническому синдрому:
Современные возможности лечения ОКИ
При установлении диагноза ОКИ проводится комплексная терапия, чаще всего в амбулаторных условиях. Согласно санитарным правилам (СП 3.1.1.3108-13 «Профилактика острых кишечных инфекций»), госпитализации подлежат: больные с тяжелой формой ОКИ, больные со среднетяжелой формой, дети в возрасте до двух лет и дети с отягощенным преморбидным фоном, больные ОКИ при невозможности соблюдения противоэпидемического режима по месту жительства и больные, находящиеся в учреждениях закрытого типа.
Учитывая преобладание вирусной этиологии ОКИ в детском возрасте, рутинное назначение антимикробных средств при диарее у детей не рекомендуется ВОЗ [2]. Показаниями к антибактериальной терапии являются: холера, инвазивная диарея (сопровождающаяся лихорадкой и/или примесями крови в стуле), диарея у иммуноскомпроментированных больных. Антимикробная терапия также рекомендуется при среднетяжелой и тяжелой формах диареи путешественников [5].
В остальных случаях достаточно проведения патогенетической терапии. Согласно основанным на доказательной медицине рекомендациям ВОЗ, а также европейским и отечественным рекомендациям по ведению детей с ОГЭ [2, 15–17], оральная регидратация гипоосмолярными растворами является ключевой в лечении и должна начинаться как можно раньше. Оральная регидратация считается более предпочтительной, чем парентеральная. Наряду с оральной регидратацией и диетотерапией, терапия при ОГЭ у детей может включать назначение специфических пробиотиков, таких как Lactobacillus GG или Saccharomyces boulardii, диосмектита или рацекадотрила. Показано, что активная терапия уменьшает выраженность и продолжительность диареи независимо от этиологии заболевания [15].
Все большее число научных данных подтверждает исключительно важную роль нормальной микрофлоры кишечника в поддержании здоровья человека, в том числе в защите организма от патогенов [18]. Индигенная микрофлора (бифидо- и лактобактерии, кишечная палочка, бактероиды, энтерококки и др.) обеспечивает ингибирующее действие на патогенные и условно-патогенные микроорганизмы посредством конкуренции с ними за рецепторы адгезии и питательные вещества, продукции бактериоцинов (активных метаболитов, обладающих антибиотикоподобным действием), органических кислот, снижающих рН толстой кишки. Защитная роль нормальной микрофлоры определяется и ее иммуномодулирующим действием за счет стимуляции лимфоидного аппарата кишечника, коррекции синтеза иммуноглобулинов, уровней пропердина, комплемента и лизоцима, снижением проницаемости сосудистых тканевых барьеров для токсических продуктов микроорганизмов. Нормальная микробиота участвует в процессах переваривания пищи, синтезе витаминов, незаменимых аминокислот, метаболизме желчных кислот, холестерина, в обезвреживании эндо- и экзотоксинов бактерий [19].
Известно, что при ОКИ практически у всех больных отмечается дисбаланс биоценоза желудочно-кишечного тракта разной степени выраженности. Это ставит вопрос о целесообразности применения препаратов, называемых пробиотиками, в лечении больных с ОКИ как способа коррекции системы защиты организма, поддержания кишечного микробиоценоза, непосредственного и опосредованного действия на возбудителя заболевания [20]. Пробиотики определяются как средства, содержащие живые микроорганизмы, вызывающие благоприятные клинические эффекты при назначении в адекватных количествах [21].
Однако эффективность пробиотиков зависит от специфического вида и определенной дозы пробиотического микроорганизма, что не может быть экстраполировано на другие, даже родственные виды микроорганизмов [20].
Традиционно пробиотики на основе живых микроорганизмов считались полезными и безопасными, но до настоящего времени мало известно о молекулярных механизмах пробиотических эффектов, нет единого механизма действия для всех пробиотиков, невозможно определить оптимальное количество бактерий, необходимое для пробиотических эффектов. Более того, полезные эффекты пробиотиков могут быть кратковременными, отсутствовать или быть неопределенными. Последнее может быть объяснено низкой концентрацией пробиотических биологически активных веществ, достигаемой в целевых местах во время традиционного применения пробиотиков [22]. Кроме того, продуцируемые живыми пробиотическими микроорганизмами молекулы в организме хозяина могут взаимодействовать с различными рецепторами индигенной микрофлоры и клеток макроорганизма и одновременно вызывать как позитивные, так и негативные эффекты. В действительности, некоторые данные сейчас демонстрируют, что не все пробиотические бактерии безопасны, даже если они относятся к лактобактериям или бифидобактериям, не имеющим традиционных генов патогенности. Так, некоторые симбиотические (пробиотические) микроорганизмы с известными положительными эффектами для здоровья, включая молочнокислые бактерии и даже бифидобактерии, могут вызывать оппортунистические инфекции, увеличивать частоту аллергической сенсибилизации и аутоиммунных нарушений, вызывать микроэкологический дисбаланс, модифицировать экспрессию генов, переносить гены антибиотикорезистентности и вирулентности, нарушать целостность эпигенома и генома, индуцировать повреждение хромосомной ДНК, активировать сигнальные пути, связанные с раком и другими хроническими заболеваниями [23]. Оказалось, что многие пробиотики, отобранные на основе их антагонистического действия по отношению к патогенным микроорганизмам, могут также подавлять рост и развитие микрофлоры кишечника человека, вагинальные лактобациллы и другую индигенную микрофлору [24]. Они могут также повреждать кишечный метаболизм вследствие их микробной энзимной активности [25]. К сожалению, мало известно о взаимодействиях живых пробиотических микроорганизмов с лекарствами in vitro и in vivo.
Хотя длительная история применения живых пробиотиков не дает оснований для серьезных опасений, недавние научные данные о неблагоприятных эффектах живых пробиотиков требуют новых альтернативных подходов к профилактике и лечению патологических состояний, связанных с дисбалансом человеческой микробиоты. Результатом естественной эволюции концепции пробиотиков являются метабиотики, которые приходят на смену пробиотикам. Термин «метабиотики» («метаболические пробиотики») означает малые молекулы, которые являются структурными компонентами пробиотических (симбиотических) микроорганизмов и/или их метаболитами и/или сигнальными молекулами с определенной (известной) химической структурой. Они могут влиять на микробиоту и/или метаболические и сигнальные пути макроорганизма, оптимизируя состав и функции индигенной микрофлоры и физиологические процессы организма хозяина: иммунитет, нейрогуморальную регуляцию, метаболические и поведенческие реакции, связанные с активностью микробиоты человека [23]. Различные пробиотические штаммы могут быть источником сотен (тысяч) биоактивных веществ низкой молекулярной массы (бактериоцины и другие антимикробные молекулы, короткоцепочечные жирные кислоты, другие жирные и органические кислоты, биосурфактанты, полисахариды, пептидогликаны, тейхоевые кислоты, липо- и гликопротеины, витамины, антиоксиданты, нуклеиновые кислоты, различные белки, включая ферменты и лектины, пептиды с различными действиями, аминокислоты, факторы роста и коагуляции, дефензин-подобные молекулы или их индукторы в клетках человека, сигнальные молекулы, плазмогены, различные кофакторы и т. п.) [22, 26]. Внедрение концепции «метабиотик» в практику позволяет использовать в биотехнологии не только бифидобактерии, лактобациллы, эшерихии, энтерококки, но также десятки других штаммов, принадлежащих к человеческой доминантной кишечной микрофлоре (Bacteroides, Firmicutes, Proteobacteria, Actinobacteria и Archaea) для медицинских целей.
Метабиотики как модификаторы физиологических функций имеют определенные преимущества. Они имеют точную химическую структуру, хорошо дозируются, имеют хороший профиль безопасности, долговечны и, кроме того, обладают лучшими возможностями абсорбции, метаболизма, распределения и экскреции по сравнению с классическими живыми пробиотиками [23]. Метабиотики, будучи компонентами пробиотических микроорганизмов (метаболиты, сигнальные молекулы известной структуры и т. д.), при их использовании представляют собой заместительную терапию и могут положительно влиять на физиологические функции организма и активность кишечной микробиоты. Лечение метабиотиками является физиологичным, так как способно оптимизировать экологические условия кишечника для развития собственной микрофлоры [23, 24, 27].
Одним из первых метаболитных препаратов-пробиотиков, влияющих на обмен веществ через воздействие на колонизационную резистентность желудочно-кишечного тракта (ЖКТ), является Хилак форте. Препарат представляет собой водный субстрат продуктов обмена сахаролитических (L. acidophilus, L. helveticus и E. faecalis) и протеолитических (E. coli) представителей индигенной микрофлоры, содержащей короткоцепочечные жирные кислоты. Дополнительно в состав препарата входят биосинтетическая молочная, фосфорная и лимонная кислоты, сорбит калия, сбалансированный комплекс буферных солей (фосфорнокислый натрий и калий), лактоза и ряд аминокислот. Позитивное действие Хилак форте определяется комплексом входящих в его состав бактерийных метаболитов, характеризующихся рядом индивидуальных регуляторных эффектов, что позволяет использовать его как профилактическое и терапевтическое средство при заболеваниях кишечника [27, 28].
Благодаря содержанию в составе препарата продуктов метаболизма бактерий, Хилак форте способствует восстановлению нормальной микробиоты кишечника биологическим путем и позволяет сохранить физиологические и биохимические функции слизистой оболочки кишечника. Входящая в состав препарата биосинтетическая молочная кислота и ее буферные соли предназначены для нормализации значения кислотности в ЖКТ, что препятствует размножению различных патогенных и условно-патогенных микроорганизмов. Короткоцепочечные жирные кислоты в составе препарата способствуют восстановлению баланса кишечной микробиоты при инфекционных заболеваниях кишечника, стимулируют регенерацию эпителиальных клеток кишечной стенки. На фоне ускорения развития нормальных симбионтов кишечника под воздействием препарата улучшаются естественный синтез витаминов группы В и К, всасывание минералов, пищеварительная, обезвреживающая, синтетическая функции микрофлоры, снижается образование аммиака и других токсических продуктов протеолитической флорой и ускоряется выведение их из организма, достигается поддержка водного и ионного гомеостаза [29]. Хилак форте также реализует свое положительное влияние на физиологические функции макроорганизма в результате модуляции иммунных реакций, изменения функций макрофагов, продукции цитокинов, активации иммунной системы, связанной со слизистыми оболочками [28].
В России Хилак форте зарегистрирован в качестве лекарственного средства. Препарат имеет доказанную терапевтическую эффективность [30–36]. Оценка последней в нескольких исследованиях у взрослых и детей с ОКИ неустановленной этиологии, а также дизентерией, сальмонеллезом, криптоспоридиозом, ротавирусной инфекцией показала, что препарат оказывал более выраженное, чем базисные средства, положительное влияние на сроки купирования интоксикации и диспепсии. Установлено, чтоХилак форте способствовал восстановлению микробиоценоза толстой кишки, что подтверждалось сменой характера микрофлоры с достоверным уменьшением количества условно-патогенных микроорганизмов. Параллельно отмечалось нормализующее действие препарата Хилак форте на летучие жирные кислоты, их изоформы, а также рН фекалий. Препарат способствовал уменьшению выраженности воспаления в слизистой оболочке толстой кишки и атрофических процессов в ней [30–32]. Доказана эффективность Хилак форте в терапии энтерита сальмонеллезной этиологии у детей, в частности, показано достоверное сокращение периода выделения сальмонелл, по сравнению с контрольной группой при применении препарата [33].
В исследовании по сравнительной оценке эффективности Хилак форте и Бифидумбактерина у детей, больных ОКИ вирусной этиологии с осмотическим механизмом диареи, отмечено преимущество включения в комплекс средств терапии Хилак форте. Оно заключалось в достоверном сокращении продолжительности интоксикации, диарейного синдрома, рвоты, в отличие от группы сравнения, получавшей Бифидумбактерин [34]. С использованием метода газожидкостной хроматографии установлено, что 7-дневный курс терапии Хилак форте способствовал улучшению метаболической активности индигенной флоры с тенденцией к нормализации уровня летучих жирных кислот и их соотношений без существенных изменений в структуре нормальной микрофлоры. Авторы указывают, что терапия ОКИ пробиотиком метаболитного типа физиологична, поскольку регулирует симбионтные отношения хозяина и его микрофлоры и имеет минимум побочных эффектов, что важно в педиатрии [35, 36].
Поскольку Хилак форте действует лишь в просвете кишечника, не всасывается и не метаболизируется в организме, он подходит для приема даже новорожденными и прекрасно переносится. Хилак форте принимают внутрь до или во время приема пищи, разбавляя небольшим количеством жидкости (исключая молоко).
Препарат назначают 3 раза в сутки:
После улучшения состояния суточная доза может быть уменьшена наполовину.
Выводы
Литература
ФГБОУ ВО НГМУ МЗ РФ, Новосибирск
Статья подготовлена при поддержке ООО «Тева».
115054, Россия, Москва, ул. Валовая 35,
Тел. +74956442234, факс +74956442235, www.teva.ru
Острые кишечные инфекции вирусной и бактериальной этиологии у детей: современные возможности диагностики и терапии, роль метабиотиков Н. И. Хохлова, Е. И. Краснова, В. В. Проворова, А. В. Васюнин, Н. Г. Патурина
Для цитирования: Лечащий врач № 6/2018; Номера страниц в выпуске: 33-39
Теги: педиатрия, желудочно-кишечный тракт, индигенная микрофлора


_575.gif)