к чему чувствителен стрептококк вириданс
Зеленящие стрептококки
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику. Под наименованием «Зеленящие стрептококки или S.viridans» прячется целая группа микроорганизмов, относящихся к альфа-зеленящим стрептококкам семейства Streptococcaceae.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику, как и обзывательство антибактериальной терапии – антибиотикотерапией, а кто мы такие, чтобы отменять традиции.
Под наименованием «Зеленящие стрептококки или S.viridans» прячется целая группа микроорганизмов, относящихся к альфа-зеленящим стрептококкам семейства Streptococcaceae. Эта группа является очень важным компонентом в составе нормально микрофлоры полости рта, слизистых оболочек дыхательных путей, пищеварительного тракта и половых органов. Поэтому обнаружив следующих ее представителей (S.gordonii, S.oralis, S. mutants, S.sanguis и S.salivarius) в посеве из полости рта, не надо немедленно начинать это лечить – этим вы только навредите организму, выбив из его состава важный компонент его нормальной микрофлоры.
Рассмотрим основных представителей семейства, на которых больше всего шансов наткнуться в антибиотикограммах.
Диагностические аспекты
Освоив вышеприведенный материал, мы видим, что только обнаружение данных микроорганизмов в стерильных средах может указывать на них как на потенциальных возбудителей. Почему все-таки потенциальных? Да потому, что в 80% случаев это может оказаться банальной контаминацией в связи с несоблюдением техники забора материала (все мы дышим, и если материал забирается с нарушением правил асептики и антисептики и без использования закрытых систем, то налететь в пробирку может много чего и не только из наших рта и носов). Таким образом, посевы нужно повторять.
Обнаружение этого же зоопарка в местах естественного его обитания не говорит нам практически ничего, если только пациент совсем не следит за полостью рта, и тогда ему можно настоятельно рекомендовать посещение стоматолога.
Аспекты антибактериальной терапии
Группа зеленящих стрептококков природно резистентна к тетрациклинам, макролидам и клиндомицину (до 50% штаммов), к биссептолу резистентно более 75%. Таким образом об этих группах мы даже не вспоминаем.
Само лечение должно быть комплексным и часто в сочетании с хирургическим. Выбор конкретных препаратов будет зависеть от локализации процесса, тяжести состояния пациента и выделенного возбудителя
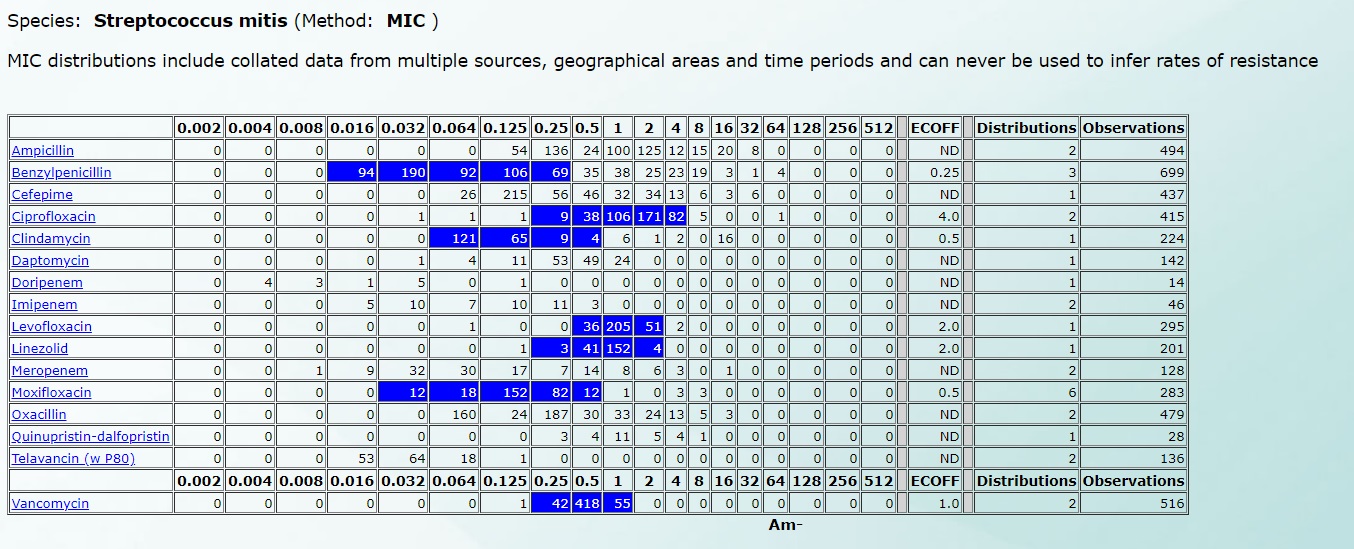
Например, чувствительность Streptococcus mitis будет выглядеть так (нажмите на картинку для увеличения):
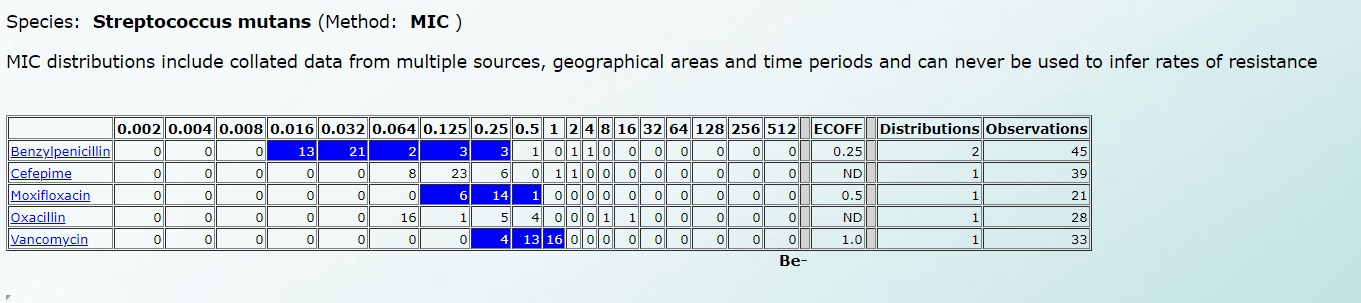
А чувствительность к Streptococcus mutans – вот так (нажмите на картинку для увеличения):
Подробнее все рассмотреть можно по этой ссылке, ведь именно на этой базе данных работают автоматические и полуавтоматические анализаторы в микробиологических лабораториях.
Препаратами выбора будут являться:
Как и в случае с любым стрептококком, крайне важно соблюдать длительность лечения, и она должна быть не менее 10-14 дней. Исключение составляет бактериальный эндокардит, там сроки лечения как минимум удваиваются.
В заключение хотелось бы сказать, что как ни прискорбно это сознавать, но недоступность, в первую очередь финансовая, адекватной стоматологической помощи вновь привела к всплеску заболеваний связанных с неблагополучием в полости рта, таким образом, мы вновь вынуждены вспоминать, что инфекционный эндокардит – это не только болезнь наркоманов и лиц со сниженным иммунным статусом, но и тех, у кого недостаточно средств на хорошего стоматолога, а потому и нам не лишне иногда осматривать полость рта у пациентов с инфекциями кровотока или абсцессами в головном мозге или печени.
Чувствительность Streptococcus группы viridans к антибактериальным препаратам у ВИЧ-инфицированных пациентов с заболеваниями органов дыхания
Полный текст:
Аннотация
Группа стрептококка включает в себя многочисленные виды шаровидных грамположительных факультативно-анаэробных бактерий, в основе классификации которых лежит их способность к гемолизу эритроцитов. Стрептококки группы viridans являются естественными представителями нормальной микрофлоры полости рта. Однако на фоне иммунодефицита, онкологической патологии, нейтропении этот возбудитель может стать причиной таких состояний, как бактериемия, сепсис, эндокардит, а в некоторых случаях и пневмония. Заболевания органов дыхания являются частой причиной обращения за медицинской помощью у ВИЧ-инфицированного контингента. Роль комменсала S. viridans в развитии бактериальных заболеваний у ВИЧ-инфицированных пациентов остается до конца не изученной. Непонятна связь S. viridans с другими бактериальными сообществами, включая патогенные микроорганизмы. Также представляет интерес оценка чувствительности S. viridans к антибактериальным препаратам в регионе с высокой заболеваемостью ВИЧ-инфекцией. Целью исследования было определение чувствительности к антибактериальным препаратам стрептококков группы viridans в мокроте у ВИЧ-инфицированных пациентов с клинической картиной пневмонии. Материалы и методы. В период с 01.01.2012 по 01.01.2019 на базе Инфекционной клинической больницы № 1 им. Далматова Д.М. были проанализированы результаты микробиологического исследования мокроты ВИЧ-инфицированных пациентов с подозрением на пневмонию (n = 684), у 193 из которых выявлялся S. viridans (28,2%). Бактериологическое исследование материала проводилось для выделения чистой культуры возбудителей классическими методами. Далее проводилась оценка чувствительности S. viridans к антибактериальным средствам (n = 78) согласно клиническим рекомендациям 2018 г. Первоначально резистентность к антибиотикам определялась диско-диффузным методом, который, хотя и является рутинным, наиболее распространен в клинических лабораториях. Затем проводилась оценка минимальной подавляющей концентрации с помощью прибора Microscan AutoScan 4 (Beckman Coulter, США) для идентификации и определения антибактериальной чувствительности. Результаты. При исследовании диско-диффузным методом было установлено наличие резистентности к пенициллину у 28,2% изучаемых образцов, к ампициллину — у 42,3% и еще больше к цефазолину — у 43,6%. При оценке минимальной подавляющей концентрации антибактериального средства были получены аналогичные данные. Хорошая чувствительность выявлена к цефотаксиму, цефтриаксону, цефепиму, фторхинолонам и ванкомицину.
Ключевые слова
Об авторах
644010, Омск, ул. Ленина, 12.
Доктор медицинских наук, профессор, зав. кафедрой фтизиатрии, фтизиохирургии и инфекционных болезней.
Кандидат медицинских наук, зав. клинико-лабораторным отделением.
Врач-бактериолог клинико-лабораторного отделения.
Врач-бактериолог клинико-лабораторного отделения.
Список литературы
1. Донецкая Э.Г.-А. Клиническая микробиология: Руководство для специалистов клинической лабораторной диагностики. М.: ГЭОТАР-Медиа, 2011. 480 с.
2. Зимина В.Н., Астафьев А.В. Внебольничные пневмонии у взрослых больных ВИЧ-инфекцией: особенности течения и лечения, профилактика // Пульмонология. 2016. Т. 4, № 26. С. 488—497. doi: 10.18093/0869-0189-2016-26-4-488-497
3. Определение чувствительности микроорганизмов к антимикробным препаратам. Клинические рекомендации. М., 2018. 206 с. URL: http://www.antibiotic.ru/minzdrav/files/docs/clrec-dsma2018.pdf (10.06.2019)
4. Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические рекомендации. МУК 4.2. 1890-04. URL: http://docs.cntd.ru/document/1200038583 (10. 06.2019)
5. Disks for antibiotic susceptibility testing 50 disks cartridge. study of susceptibility to antimicrobial agents. URL: http://www.bio-rad.com/webroot/web/pdf/inserts/CDG/en/Literature/inserts/66098_01_2011_GB.pdf (10. 06.2019)
6. Dulanto Chiang A., Sinaii N., Palmore T.N. Risk factors for viridans group streptococcal bacteremia in neutropenic and non-neutropenic patients: a single center case-case-control study. Open Forum Infect. Dis., 2017, vol. 5, no. 1: 260. doi: 10.1093/ofid/ofx260
7. Feikin D.R., Feldman C., Schuchat A., Janoff E.N. Global strategies to prevent bacterial pneumonia in adults with HIV disease. Lancet Infect. Dis., 2004, vol. 4, pp. 445-455.
8. Huson M.A., Kalkman R., Stolp S.M., Janssen S., Alabi A.S., Beyeme J.O., van der Poll T., Grobusch M.P. The impact of HIV on presentation and outcome of bacterial sepsis and other causes of acute febrile illness in Gabon. Infection, 2015, vol. 43, no. 4, pp. 443-451. doi: 10.1007/s15010-015-0753
9. Limia A., Jimenez M.L., Alarcon T., Lopez-Brea M. Five-year analysis of antimicrobial susceptibility of the Streptococcus milleri group. Eur. J. Clin. Microbiol. Infect. Dis., 1999, vol. 18, рр. 440-444.
10. Marron A., Carratala J., Gonzalez-Barca E., Fernandez-Sevilla A., Alcaide F., Gudiol F. Serious complications of bacteremia caused by Viridans streptococci in neutropenic patients with cancer. Clin. Infect. Dis., 2000, vol. 31, pp. 1126—1130.
11. Pfaller M.A., Jones R.A., Marshall S.A., Edmond M.B., Wenzel R.P. Nosocomial streptococcal blood stream infections in the SCOPE Program: species occurrence and antimicrobial resistance. The Scope Hospital Study Group. Diagn. Microbiol. Infect. Dis, 1997, vol. 4, рр. 259-263.
12. Powell M.K., Benkova K., Selinger P., Dogosi M., Kinkorova Lunackova I., Koutnikova H., Lastikova J., Roubickova A., Spurkova Z., Laclova L., Eis V., Sach J., Heneberg P. Opportunistic infections in HIV-infected patients differ strongly in frequencies and spectra between patients with low CD4+ cell counts examined postmortem and compensated patients examined antemortem irrespective of the HAART era. PLoS One, 2016, vol. 11, no. 9: e0162704. doi: 10.1371/journal.pone.0162704
13. Schleifer K.H., Kilpper-Balz R. Transfer of Streptococcus faecalis and Streptococcus faecium to the genus Enterococcus nom. rev as Enterococcus faecalis comb. nov. and Enterococcus faecium comb. nov. Int. J. Syst. Bacteriol., 1984, vol. 34, pp. 31-34.
14. Song J.Y., Eun B.W., Nahm M.H. Diagnosis of pneumococcal pneumonia: current pitfalls and the way forward. Infect. Chemother., 2013, vol. 45, no. 4, pp. 351-366. doi: 10.3947/ic.2013.45.4.351
15. Tunkel A.R., Sepkowitz K.A. Infections caused by Viridans streptococci in patients with neutropenia. Clin. Infect. Dis., 2002, vol. 34, pp. 1524-1529.
16. Upchurch C.P., Grijalva C.G., Wunderink R.G., Williams D.J., Waterer G.W., Anderson E.J., Zhu Y., Hart E.M., Carroll F., Bramley A.M., Jain S., Edwards K.M., Self W.H. Community-acquired pneumonia visualized on ct scans but not chest radiographs: pathogens, severity, and clinical outcomes. Chest, 2018, vol. 153, no. 3, pp. 601-610. doi: 10.1016/j.chest.2017.07.035
17. Venditti M., Baiocchi P., Santini C., Brandimarte C., Serra P., Gentile G., Girmenia C., Martino P. Antimicrobial susceptibilities of Streptococcus species that cause septicemia in neutropenic patients. Antimicrob. Agents Chemother., 1989, vol. 33, pp. 580-582.
18. Wisplinghoff H., Reinert R.R., Cornely O., Seifert H. Molecular relationships and antimicrobial susceptibilities of viridans group streptococci isolated from blood of neutropenic cancer patients. J. Clin. Microbiol., 1999, vol. 37, no. 6, pp. 1876-1880.
Дополнительные файлы
Для цитирования:
Пузырёва Л.В., Мордык А.В., Родькина Л.А., Житина И.В., Тимофеева А.В. Чувствительность Streptococcus группы viridans к антибактериальным препаратам у ВИЧ-инфицированных пациентов с заболеваниями органов дыхания. Инфекция и иммунитет. 2021;11(2):371-376. https://doi.org/10.15789/2220-7619-SOS-1241
For citation:
Puzyreva L.V., Mordyk A.V., Rodkina L.A., Zhitina I.V., Timofeeva A.V. Sensitivity of Streptococcus viridans to antibacterial agents in HIV-positive patients coupled to respiratory diseases. Russian Journal of Infection and Immunity. 2021;11(2):371-376. (In Russ.) https://doi.org/10.15789/2220-7619-SOS-1241
Чувствительность Streptococcus группы viridans к антибактериальным препаратам у ВИЧ-инфицированных пациентов с заболеваниями органов дыхания
Полный текст:
Аннотация
Группа стрептококка включает в себя многочисленные виды шаровидных грамположительных факультативно-анаэробных бактерий, в основе классификации которых лежит их способность к гемолизу эритроцитов. Стрептококки группы viridans являются естественными представителями нормальной микрофлоры полости рта. Однако на фоне иммунодефицита, онкологической патологии, нейтропении этот возбудитель может стать причиной таких состояний, как бактериемия, сепсис, эндокардит, а в некоторых случаях и пневмония. Заболевания органов дыхания являются частой причиной обращения за медицинской помощью у ВИЧ-инфицированного контингента. Роль комменсала S. viridans в развитии бактериальных заболеваний у ВИЧ-инфицированных пациентов остается до конца не изученной. Непонятна связь S. viridans с другими бактериальными сообществами, включая патогенные микроорганизмы. Также представляет интерес оценка чувствительности S. viridans к антибактериальным препаратам в регионе с высокой заболеваемостью ВИЧ-инфекцией. Целью исследования было определение чувствительности к антибактериальным препаратам стрептококков группы viridans в мокроте у ВИЧ-инфицированных пациентов с клинической картиной пневмонии. Материалы и методы. В период с 01.01.2012 по 01.01.2019 на базе Инфекционной клинической больницы № 1 им. Далматова Д.М. были проанализированы результаты микробиологического исследования мокроты ВИЧ-инфицированных пациентов с подозрением на пневмонию (n = 684), у 193 из которых выявлялся S. viridans (28,2%). Бактериологическое исследование материала проводилось для выделения чистой культуры возбудителей классическими методами. Далее проводилась оценка чувствительности S. viridans к антибактериальным средствам (n = 78) согласно клиническим рекомендациям 2018 г. Первоначально резистентность к антибиотикам определялась диско-диффузным методом, который, хотя и является рутинным, наиболее распространен в клинических лабораториях. Затем проводилась оценка минимальной подавляющей концентрации с помощью прибора Microscan AutoScan 4 (Beckman Coulter, США) для идентификации и определения антибактериальной чувствительности. Результаты. При исследовании диско-диффузным методом было установлено наличие резистентности к пенициллину у 28,2% изучаемых образцов, к ампициллину — у 42,3% и еще больше к цефазолину — у 43,6%. При оценке минимальной подавляющей концентрации антибактериального средства были получены аналогичные данные. Хорошая чувствительность выявлена к цефотаксиму, цефтриаксону, цефепиму, фторхинолонам и ванкомицину.
Ключевые слова
Об авторах
644010, Омск, ул. Ленина, 12.
Доктор медицинских наук, профессор, зав. кафедрой фтизиатрии, фтизиохирургии и инфекционных болезней.
Кандидат медицинских наук, зав. клинико-лабораторным отделением.
Врач-бактериолог клинико-лабораторного отделения.
Врач-бактериолог клинико-лабораторного отделения.
Список литературы
1. Донецкая Э.Г.-А. Клиническая микробиология: Руководство для специалистов клинической лабораторной диагностики. М.: ГЭОТАР-Медиа, 2011. 480 с.
2. Зимина В.Н., Астафьев А.В. Внебольничные пневмонии у взрослых больных ВИЧ-инфекцией: особенности течения и лечения, профилактика // Пульмонология. 2016. Т. 4, № 26. С. 488—497. doi: 10.18093/0869-0189-2016-26-4-488-497
3. Определение чувствительности микроорганизмов к антимикробным препаратам. Клинические рекомендации. М., 2018. 206 с. URL: http://www.antibiotic.ru/minzdrav/files/docs/clrec-dsma2018.pdf (10.06.2019)
4. Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические рекомендации. МУК 4.2. 1890-04. URL: http://docs.cntd.ru/document/1200038583 (10. 06.2019)
5. Disks for antibiotic susceptibility testing 50 disks cartridge. study of susceptibility to antimicrobial agents. URL: http://www.bio-rad.com/webroot/web/pdf/inserts/CDG/en/Literature/inserts/66098_01_2011_GB.pdf (10. 06.2019)
6. Dulanto Chiang A., Sinaii N., Palmore T.N. Risk factors for viridans group streptococcal bacteremia in neutropenic and non-neutropenic patients: a single center case-case-control study. Open Forum Infect. Dis., 2017, vol. 5, no. 1: 260. doi: 10.1093/ofid/ofx260
7. Feikin D.R., Feldman C., Schuchat A., Janoff E.N. Global strategies to prevent bacterial pneumonia in adults with HIV disease. Lancet Infect. Dis., 2004, vol. 4, pp. 445-455.
8. Huson M.A., Kalkman R., Stolp S.M., Janssen S., Alabi A.S., Beyeme J.O., van der Poll T., Grobusch M.P. The impact of HIV on presentation and outcome of bacterial sepsis and other causes of acute febrile illness in Gabon. Infection, 2015, vol. 43, no. 4, pp. 443-451. doi: 10.1007/s15010-015-0753
9. Limia A., Jimenez M.L., Alarcon T., Lopez-Brea M. Five-year analysis of antimicrobial susceptibility of the Streptococcus milleri group. Eur. J. Clin. Microbiol. Infect. Dis., 1999, vol. 18, рр. 440-444.
10. Marron A., Carratala J., Gonzalez-Barca E., Fernandez-Sevilla A., Alcaide F., Gudiol F. Serious complications of bacteremia caused by Viridans streptococci in neutropenic patients with cancer. Clin. Infect. Dis., 2000, vol. 31, pp. 1126—1130.
11. Pfaller M.A., Jones R.A., Marshall S.A., Edmond M.B., Wenzel R.P. Nosocomial streptococcal blood stream infections in the SCOPE Program: species occurrence and antimicrobial resistance. The Scope Hospital Study Group. Diagn. Microbiol. Infect. Dis, 1997, vol. 4, рр. 259-263.
12. Powell M.K., Benkova K., Selinger P., Dogosi M., Kinkorova Lunackova I., Koutnikova H., Lastikova J., Roubickova A., Spurkova Z., Laclova L., Eis V., Sach J., Heneberg P. Opportunistic infections in HIV-infected patients differ strongly in frequencies and spectra between patients with low CD4+ cell counts examined postmortem and compensated patients examined antemortem irrespective of the HAART era. PLoS One, 2016, vol. 11, no. 9: e0162704. doi: 10.1371/journal.pone.0162704
13. Schleifer K.H., Kilpper-Balz R. Transfer of Streptococcus faecalis and Streptococcus faecium to the genus Enterococcus nom. rev as Enterococcus faecalis comb. nov. and Enterococcus faecium comb. nov. Int. J. Syst. Bacteriol., 1984, vol. 34, pp. 31-34.
14. Song J.Y., Eun B.W., Nahm M.H. Diagnosis of pneumococcal pneumonia: current pitfalls and the way forward. Infect. Chemother., 2013, vol. 45, no. 4, pp. 351-366. doi: 10.3947/ic.2013.45.4.351
15. Tunkel A.R., Sepkowitz K.A. Infections caused by Viridans streptococci in patients with neutropenia. Clin. Infect. Dis., 2002, vol. 34, pp. 1524-1529.
16. Upchurch C.P., Grijalva C.G., Wunderink R.G., Williams D.J., Waterer G.W., Anderson E.J., Zhu Y., Hart E.M., Carroll F., Bramley A.M., Jain S., Edwards K.M., Self W.H. Community-acquired pneumonia visualized on ct scans but not chest radiographs: pathogens, severity, and clinical outcomes. Chest, 2018, vol. 153, no. 3, pp. 601-610. doi: 10.1016/j.chest.2017.07.035
17. Venditti M., Baiocchi P., Santini C., Brandimarte C., Serra P., Gentile G., Girmenia C., Martino P. Antimicrobial susceptibilities of Streptococcus species that cause septicemia in neutropenic patients. Antimicrob. Agents Chemother., 1989, vol. 33, pp. 580-582.
18. Wisplinghoff H., Reinert R.R., Cornely O., Seifert H. Molecular relationships and antimicrobial susceptibilities of viridans group streptococci isolated from blood of neutropenic cancer patients. J. Clin. Microbiol., 1999, vol. 37, no. 6, pp. 1876-1880.
Дополнительные файлы
Для цитирования:
Пузырёва Л.В., Мордык А.В., Родькина Л.А., Житина И.В., Тимофеева А.В. Чувствительность Streptococcus группы viridans к антибактериальным препаратам у ВИЧ-инфицированных пациентов с заболеваниями органов дыхания. Инфекция и иммунитет. 2021;11(2):371-376. https://doi.org/10.15789/2220-7619-SOS-1241
For citation:
Puzyreva L.V., Mordyk A.V., Rodkina L.A., Zhitina I.V., Timofeeva A.V. Sensitivity of Streptococcus viridans to antibacterial agents in HIV-positive patients coupled to respiratory diseases. Russian Journal of Infection and Immunity. 2021;11(2):371-376. (In Russ.) https://doi.org/10.15789/2220-7619-SOS-1241
Острая стрептококковая инфекция ротоглотки в педиатрической практике – проблема и пути решения
Чрезвычайная распространенность стрептококка группы А (СГА) как респираторного патогена, множество его серотипов, строго типоспецифическое формирование постинфекционного иммунитета и легкость передачи предопределяют тотальную распространенность стрептококковых инфекций у детей, особенно в организованных коллективах [1]. Существуют стандарты лечения скарлатины, а также ангины (последняя имеет стрептококковую природу в 70% случаев по данным инфекционного стационара Новосибирска) на основе использования этиотропных, патогенетических и симптоматических средств. Многочисленными исследованиями показано, что СГА уже более 50 лет остается чувствительным к препаратам пенициллинового ряда вследствие того, что не выделяет пенициллиназу, как другие возбудители. Вместе с тем в случаях микст-инфицирования пенициллины малоэффективны; при нерациональной терапии либо в случаях частого реинфицирования новыми серотипами СГА при генотипически обусловленных особенностях реактивности детского организма (сенсибилизации с развитием иммунопатологических реакций) возможно развитие осложнений в виде ревматизма, гломерулонефрита и других иммуновоспалительных процессов.
Инфекционные и иммуноопосредованные болезни, связанные со стрептококком:
По характеру гемолиза в кровяном агаре стрептококки классифицируют на альфа, бета и гамма. Альфа- (зеленящие) и гамма-стрептококки не лизируют эритроциты и называются негемолитическими, т. о. они непатогенны для человека. Они широко представлены в нормальной микрофлоре ротовой полости (оральные) и толстом кишечнике (энтерококки). Бета-гемолитические стрептококки относят к пиогенным, т. е. являются болезнетворными. Редко выделяются от здоровых и являются потенциальной угрозой для хозяина.
Иммунитет человека к стрептококковым инфекциям обусловлен антителами к М-антигену. Выделяют более 80 серотипов СГА по М-протеину, при этом антибактериальный иммунитет носит узкий типоспецифический характер. На каждый М-серотип вырабатываются свои агглютинины, преципитины, комплементсвязывающие антитела, почему возможны реинфекции, т. е. повторные заболевания в результате заражения новыми серотипами.
Количество госпитализированных детей с ангиной по данным детской городской клинической больницы № 3 Новосибирска в 2008 г. составило 740, в 2009 г. — 1190, в 2010 г. — 1438 человек, т. е. 11% от всех нозологических форм. В равной мере болеют как мальчики, так и девочки. Интересным оказалось распределение больных по возрасту: меньше поступало детей в возрасте 7–10 лет и старше (возможно, они лечились на участке). Интересно увеличение доли детей первых трех лет жизни за последние три года (учитывая несовершенство лимфоидно-глоточного кольца данной возрастной категории). До настоящего времени ангина у них была нехарактерным, почти казуистическим явлением, особенно у детей первого года жизни. В 2010 г. больные до трех лет составили 45% госпитализированных, включая 9% детей до года.
Традиционно бактериологическая диагностика Streptococcus pyogenes (рутинный метод) включает:
В 2009 г. мы провели ретроспективный анализ 300 историй болезней детей с диагнозом «лакунарная ангина». Уровень высева S. pyogenes составил около 20%, другая часть бета-гемолитических стрептококков с использованием рутинных методик не могла быть идентифицирована до вида, и их диагностическая значимость обычно остается неясной. Американской академией педиатрии для выявления S. pyogenes у детей с острым тонзиллофаригитом ввиду недостаточной информативности рутинного метода бактериологической диагностики рекомендован метод экспресс-диагностики с дублирующим микробиологическим исследованием материала с помощью теста OSOM Ultra Strep A Test либо метод двух последовательных экспресс-тестов [2].
В России экспресс-методы доступны не каждой лаборатории, поэтому для улучшения диагностики S. pyogenes и других бета-гемолитических стрептококков в стационаре мы проводим двойное последовательное микробиологическое исследование. В качестве системы обогащения используем Brain Heart infusion Broth HiMedia (сердечно-мозговой бульон), с помощью которого обычно культивируют «привередливые» микроорганизмы. Для идентификации большинства стрептококков до вида предназначены микротест-системы СТРЕПТОтест 16 Pliva-Lachema, компьютерная программа ВАСТ v 3,5.
Первичный высев S. pyogenes составил 60 из 254–20,4%. При пересеве через среду обогащения дополнительно получено еще 36 штаммов, что составило еще 14,2%. Таким образом, всего получено 96 штаммов S. pyogenes и общий уровень высеваемости — 37,4% (табл. 1).
Благодаря тест-системам СТРЕПТОтест 16 удалось идентифицировать дополнительных представителей бета-гемолизирующих стрептококков, а с помощью дополнительного пересева и использования программы BACT получить также представителей родов Moraxella spp., Haemophilus spp., S. pneumoniae [3]. Возможности повышения эффективности микробиологической диагностики стрептококковой инфекции ротоглотки у детей заключаются в использовании метода повторного высева на среды обогащения. Таким образом, гемолитический стрептококк гораздо чаще является этиологическим агентом ангины у детей, чем это подтверждается рутинным бактериологическим методом (у каждого третьего госпитализированного больного).
На следующем этапе исследования из 254 детей мы отобрали 96 с высевом S. pyogenes (табл. 2). У 75% детей со стрептококковой ангиной пиогенный стрептококк сочетался с возбудителями, выделяющими бета-лактамазы (золотистый стафилококк, пневмококк, гемофил, моракселла, синегнойная палочка, условно-патогенные энтеробактерии, коагулазонегативный стафилококк, кандиды), что может способствовать неудачам пенициллинотерапии.
Антибактериальная терапия
Целью антибактериальной терапии острого стрептококкового тонзиллита является эрадикация возбудителя, что ведет не только к ликвидации симптомов инфекции, но и к предотвращению ее распространения, предупреждает ранние и поздние осложнения. Паратонзиллярный абсцесс и гнойный шейный лимфаденит в допенициллиновую эру развивались у 13% госпитализированных больных, в настоящее время встречаются редко. Вероятность развития ревматизма составляла в 40-х годах 2,1%, а с появлением антибактериального лечения — 0,3% [1]. Назначение антибиотиков предотвращает распространение стрептококковой инфекции, снижается число носителей возбудителя.
Показаны пенициллины, аминопенициллины, цефалоспорины. У пациентов с доказанной аллергией на бета-лактамы сдедует применять макролиды, а при непереносимости последних — линкосамиды. СГА отличаются высокой чувствительностью к пенициллинам и цефалоспоринам.
Путь введения при системной антибиотикотерапии должен обеспечить необходимую концентрацию препарата в очаге инфекции, быть простым и не тягостным для ребенка. Амбулаторным больным антибиотики обычно назначают внутрь, за исключением тех случаев, когда достаточно бывает одной внутримышечной инъекции. В стационаре антибиотик часто вводится внутримышечно (в отсутствие нарушений свертывания крови), а при тяжелых формах и возможности венозной катетеризации — внутривенно. К парентеральному введению антибиотиков необходимо прибегать в начале лечения, а как только состояние больного улучшится, перейти на прием препарата внутрь. В педиатрии это положение особенно важно для сокращения негативных реакций со стороны ребенка.
Препаратами первого ряда в лечении инфекционных процессов, вызванных пиогенным стрептококком, как в России, так и за рубежом являются пенициллины. В связи с тем, что СГА наиболее вероятен для ангины как этиологический ее агент, с одного из данных препаратов необходимо начинать терапию (эмпирически), а с получением результатов бакпосевов из зева проводить дальнейшую ее корректировку. Пенициллины используются в дозе 100–150 тыс ед/кг/сут. Не получено данных о резистентности СГА к пенициллинам. Основа действия пенициллинов и бета-лактамов — ингибирование синтеза клеточной стенки и бактерицидный эффект. Бензилпенициллин используется парентерально 6 раз в сутки, что невозможно обеспечить в амбулаторных условиях. Феноксиметилпенициллин (пенициллин V) назначается энтерально за час до еды либо через 2 ч после еды (при взаимодействии с пищей наблюдается снижение бактерицидной концентрации в плазме) по 0,375 г в 2 приема ( 25 кг).
Уровень амоксициллина в миндалинах в 3 раза выше, чем уровень равных доз феноксиметилпенициллина и ампициллина. Имеет больший период полувыведения, поэтому назначается 2–3 раза в сутки. Пища не влияет на биодоступность препарата. Лекарственная форма амоксициллина Флемоксин Солютаб хорошо проникает в ткань миндалин, назначается по 0,375 г в 2 приема ( 25 кг).
Амоксициллин-клавунат — наличие ингибитора бета-лактамаз клавулановой кислоты препятствует ферментативной деградации амоксициллина, повышает активность препарата в отношении грамположительных и грамотрицательных аэробных и анаэробных микроорганизмов, продуцирующих эти ферменты. Амоксиклав (Lek, Словения), Аугментин (SmithKline Beecham, Великобритания).
Используя в лечении аминопенициллины, необходимо помнить, что в детской практике существует противопоказание к назначению — инфекционный мононуклеоз. Имеется высокий риск появления сыпи (90–100%) иммунокомплексного генеза вследствие образования иммунных комплексов из аминогруппы антибиотика (гаптен), IgM к вирусу Эпштейна–Барр и иммунных комплексов. Ангина является одним из первых симптомов инфекционного мононуклеоза, поэтому нередко является первоначальным диагнозом. При терапии аминопенициллином не сразу, а спустя несколько дней (когда начнут появляться антитела к вирусу) возникает генерализованная пятнисто-папулезная сыпь, ухудшается состояние больного. Поэтому важна ранняя дифференциальная диагностика ангины и инфекционного мононуклеоза для рационального выбора лекарственного препарата.
Цефалоспорины 1-го и 2-го поколения — антибиотики, имеющие в своем составе лактамное кольцо. Тормозят синтез пептидогликанов клеточной стенки. Спектр действия — большинство грамположительных бактерий, в том числе не только стрептококки, но и стафилококки. С каждым следующим поколением в отношении грамотрицательных бактерий их активность возрастает, а в отношении кокков убывает (исключение — цефтриаксон, высокоактивный в отношении кокков). Препараты 1-го поколения действуют только на кокковую флору. В настоящее время используются редко. Препараты 2-го поколения имеют более широкий спектр: помимо кокков они подавляют рост некоторых штаммов, устойчивых к ампициллину возбудителей (M. catarrhalis, H. influenzae, S. pneumoniae). Цефуроксим-аксетин (2-е поколение) назначается 30 мг/кг/сут в/м, в/в или внутрь 2 раза в день. В таблетках выпускается по 125, 250 и 500 мг.
Обычно больным стрептококковой ангиной нет необходимости назначать цефалоспорины 3-го поколения, однако ежегодно наблюдаются 2–3 случая тяжелого поражения зева с обширными гнойными наложениями и некрозами. При этом отмечается низкая эффективность использования пенициллинов и цефалоспоринов 1-го и 2-го поколения — сохранение лихорадки, гнойно-воспалительного процесса в воротах инфекции. Посевы из зева дают мало информации: выделяется пиогенный стрептококк, чувствительный к традиционным препаратам, однако эффекта в терапии не наблюдается. Причиной тому, по нашим данным, является ассоциированная со стрептококковой другая бактериальная инфекция с бета-лактамазной активностью (пневмококки, кандиды, моракселлы, гемофил и др.) либо анаэробная (бактериоды, в том числе пептококки, пептострептококки, фузобактерии и др.) и снижение «мукозального» иммунитета.
Препараты 3-го поколения — цефотаксим, цефтазидим и цефтриаксон — обладают выраженной активностью в отношении M. catarrhalis, H. influenzae, в том числе штаммов со сниженной чувствительностью вне зависимости от типа лактамазы.
Цефтазидим (Фортум), чаще в комбинации с аминогликозидами, является препаратом первого выбора при инфекциях, вызванных синегнойной палочкой. Назначается в/в, в/м 100–150 мг/кг/сут однократно. 19% детей с синдромом ангины помимо гемолитического стрептококка выделяли из зева Pseudomonas aeruginosa (табл. 2). Большой интерес представляет тот факт, что эти дети госпитализировались не из других стационаров, где обычно распространяется синегнойная инфекция, а с места жительства, где у них был контакт с длительно болеющими родственниками (бабушками, дедушками, получавшими курсы лечения антибиотиками), также выделяющими из зева данный возбудитель.
Цефтриаксон имеет период полувыведения 7 ч и может вводиться 1 раз в сутки в/в, в/м 20–80 мг/кг/сут.
Цефотаксим — в/в, в/м 50–100 мг/кг/сут при инфекциях, вызванных любым типом лактамаз, а также больным, получавшим ранее антибиотики.
Цефиксим (Cупракс) — препарат для перорального применения в виде капсул либо суспензии, удобен для применения в детской практике, в том числе и при ангине в случаях наличия нескольких инфекционных агентов в ротоглотке. Детям в возрасте до 12 лет препарат назначают в суспензии в дозе 8 мг/кг 1 раз в сутки или 4 мг/кг каждые 12 часов. Детям от 6 мес до года суточная доза составляет 2,5–4 мл; от 2–4 лет — 5 мл; с 6–11 лет — 6–10 мл суспензии. Для взрослых и детей старше 12 лет с массой тела более 50 кг суточная доза составляет 400 мг 1 раз в сутки, или по 200 мг/2 раза в сутки. Продолжительность курса лечения 7–10 дней.
Макролиды активны в отношении кокковой флоры, возбудителей дифтерии, анаэробов (кроме B. fragilis), однако все они, кроме азитромицина, неактивны в отношении гемофильной палочки. Хорошо накапливаются в клетках, где их концентрация превышает таковую в сыворотке крови.
Азитромицин (Cумамед) — разновидность азалидов, устойчив к кислой среде желудка, создает высокие концентрации в миндалинах. Особенность фармакокинетики — длительный период полувыведения из тканей (ингибирование цитохрома Р450 в печени). Бактерицидные концентрации в миндалинах сохраняются еще 7 дней после отмены препарата. Назначается 1 раз в сутки в дозе 10 мг/кг, со 2-го дня 5 мг/кг в течение 5 дней. Пища замедляет всасывание (рекомендуется принимать за час до еды или через 2 ч после).
Джозамицин, мидекамицин (Макропен) — 40–50 мг/кг/сут.
Кларитромицин, рокситромицин — 6–8 мг/кг/сут внутрь.
Спирамицин (Ровамицин) — 100 ЕД/кг 2 раза в сутки внутрь.
Эритромицин — в/в 20–50 мг/кг/сут, внутрь 50 мг/кг/сут, максимум 1–2 г/сут.
Курс антибактериальной терапии при синдроме ангины с выделением бета-гемолитического стрептококка — не менее 10 дней. Менее продолжительные курсы нередко приводят к рецидивам острого тонзиллита и повторной госпитализации больных.
Местные антибактериальные средства
В связи с тем, что невозможно дать детальный обзор препаратов местного действия, мы остановимся на тех средствах, эффективность которых подтверждена собственным опытом.
Препараты местного действия при ангине обязательно должны быть дополнением к системе антимикробной терапии, т. е. их роль второстепенна.
Фузафунгин (Биопарокс) — местный ингаляционный антимикробный препарат может назначаться с первого дня заболевания до получения результатов микробиологического исследования. Обладает широким спектром антимикробного действия, собственными противовоспалительными свойствами, отсутствием абсорбции со слизистой оболочки, низкой аллергенностью, т. е. отвечает всем требованиям к местным антибактериальным средствам. Самым оптимальным является использование препарата от 1 до 4 доз в зависимости от возраста каждые 4 часа в течение 10 дней.
Тонзилгон Н — является комбинированным препаратом растительного происхождения. Компоненты ромашки, алтея и хвоща, входящие в его состав, стимулируют защитные силы организма за счет повышения фагоцитарной активности макрофагов и гранулоцитов. Препарат обладает противовоспалительным, иммуностимулирующим, противоотечным и противовирусным действием, ускоряет процесс выздоровления, в дальнейшем может использоваться для профилактики рецидивов ангины. Побочных эффектов при использовании препарата не отмечено. Тонзилгон Н выпускается в двух формах: капель для приема внутрь и драже. Взрослым препарат назначают по 25 капель или 2 драже 5–6 раз в день, детям до 5 лет по 5–10 капель, от 6–10 лет 15 капель, 11–16 лет — 20 капель 5–6 раз в день. После исчезновения острых проявлений заболевания кратность приема Тонзилгона Н сокращается до 3 раз в день. Длительность базисной терапии у ЧБД при рецидивах ангины и хроническом тонзиллите может продолжаться 4–6 недель.
Гексетидин (Гексорал) выпускается как в виде раствора для полоскания, так и аэрозоля. В отличие от хлоргексидина, препарат малотоксичен. Активен в отношении большинства бактерий — возбудителей тонзиллофарингита, а также грибков. Помимо антимикробного, обладает кровоостанавливающим, анальгезирующим и дезодорирующим действием.
Октенисепт — антисептик для слизистых оболочек с наиболее широким спектром антимикробного действия, охватывающим грамположительные и грамотрицательные бактерии, хламидии, микоплазмы, грибки, простейшие и даже вирусы семейства герпеса. Действие препарата начинается уже через минуту и длится в течение часа. Он нетоксичен и не всасывается через неповрежденную слизистую оболочку. Препарат можно распылять на слизистые оболочки с помощью инсуфлятора (для полосканий или распылений растворять 1:10).
Аква Марис — спрей для горла и носа для очищения, снятия раздражения и защиты слизистой оболочки носоглотки. Состав: флакон содержит 30 мл стерильного гипертонического раствора воды Адриатического моря.
Способ назначения: взрослым и детям 4–6 раз в сутки по 3–4 впрыскивания, направляя распылитель на заднюю стенку глотки.
Стрепсилс — таблетки для рассасывания, содержит амилметакрезол и дихлорбензиловый спирт, обладающие антисептическим, противовоспалительным и обезболивающим свойствами, а также ментол и эвкалипт, масло аниса, мед, лимон, витамин С. Активен в отношении грамположительной и грамотрицательной микрофлоры. Способ применения:
Безусловно, самые эффективные местные препараты не заменят полностью потребности в системном введении антибиотиков при ангине. Вместе с тем при нежелательных эффектах общей антибиотикотерапии местное назначение препаратов с широким спектром антимикробной активности является методом выбора.
Противовоспалительные и жаропонижающие средства
Лихорадка и болевой синдром, связанные с развитием воспалительных проявлений в зеве, являются основными клиническими признаками ангины. Лихорадка с температурой менее 39 °C у здоровых детей в основном не требует лечения. Однако при стрептококковой ангине лихорадка часто манифестирует и сочетается с проявлениями интоксикации, что заметно ухудшает самочувствие больных.
Жаропонижающая терапия показана:
Назначение с этой целью ацетилсалициловой кислоты (Аспирина) детям и подросткам запрещено в США с 70-х годов, а в России — с конца 90-х, ввиду доказанной связи их применения с развитием синдрома Рея, летальность при котором высокая (приказ Фармкомитета от 25.03.1999); Аспирин остается в практике как препарат, эффективный при ревматологических нарушениях.
В качестве безрецептурного жаропонижающего не используется Анальгин, что связано с опасностью развития агранулоцитоза и коллапса с гипотермией; этот препарат назначается только как обезболивающее или для быстрого снижения температуры по особым показаниям в составе литической смеси: в/м Анальгин 50% р-р 0,1–0,2 мл/10 кг + папаверин 0,1–0,2 мл 2% р-ра.
Парацетамол — часто применяемый антипиретик и легкий анальгетик у детей, производное фенацетина, но значительно менее токсичен, чем последний. Основной механизм жаропонижающего эффекта — угнетение синтеза простагландинов за счет снижения активности циклоксигеназы в гипоталамусе. В большей степени парацетамол угнетает «церебральный» синтез простагландинов, чем «периферический», не обладает антитромбоцитарным эффектом, не вызывает кровоточивость, как Аспирин.
Парацетамол метаболизируется в печени, малотоксичен в рекомендуемых дозировках. Ежедневная суммарная доза парацетамола при пероральном или ректальном применении не должна превышать 100 мг/кг в день у детей старше года, 75 мг/кг — у грудных детей. Не рекомендуется в комбинации с препаратами, которые, как и сам парацетамол, под влиянием цитохрома Р 450 способны превращаться в печени и почках в «реактивные метаболиты» и повреждать последние (рифампицин, фенобарбитал, противоэпилептические средства). Противопоказан при заболеваниях печени. Превышение рекомендуемых доз может приводить к печеночной недостаточности и печеночной энцефалопатии за счет образования избытка «реактивного метаболита». Возможна также острая почечная недостаточность (острый канальцевый некроз почек). Педиатров может поразить, насколько часто безрецептурные антипиретики используются в практике. По данным проведенного анкетирования матерей в США в 1994–2000 гг., более половины матерей давали безрецептурные антипиретики и анальгетики детям раннего возраста в течение последних 30 дней до анкетирования, при этом 2/3 детей получали Ацетаминофен (парацетамол). Установлено, что родители не способны измерять точные дозы жидких препаратов, которые в лечении маленьких детей используются наиболее часто. Они считали, что антипиретики, предназначенные для детей первых трех лет жизни, менее концентрированы (т. е. содержат меньше активного вещества в растворе), чем те, которые используются у детей старших возрастных групп. На самом деле они были более концентрированы, чтобы облегчить измерение малых доз, необходимых для детей раннего возраста доз. Описанная «путаница» привела к передозировкам и даже к смерти детей [4]. В России данная проблема не менее актуальна, потому что при упорной лихорадке и коротком периоде апирексии родители завышают дозы парацетамола детям в 40% случаев, желая получить более быстрый и продолжительный обезболивающий результат [5]. Безопасность парацетамола для детей может быть обеспечена только строгим соблюдением инструкции по его применению.
Ибупрофен (Нурофен для детей, Нурофен) — производное пропионовой кислоты — обладает жаропонижающими, болеутоляющими и противовоспалительными свойствами. В настоящее время применяется более чем в 30 странах. Нурофен для детей (ибупрофен) является нестероидным противовоспалительным лекарственным средством (НПВС) и показан для снижения высокой температуры, а также для снятия слабой или умеренной боли, например, боли в горле при ангине, головной боли как симптоме ангины. Фебрильная лихорадка является одним из ведущих проявлений болезни при острой СГА-инфекции (ангине, скарлатине), поэтому часто возникает необходимость получения жаропонижающего эффекта. Но, кроме того, имеются выраженные воспалительные проявления в зеве: 1) яркая гиперемия миндалин, дужек, язычка, задней стенки глотки; 2) гипертрофия миндалин, связанная преимущественно с их инфильтрацией полинуклеарами и в меньшей степени с отеком; 3) налеты на миндалинах в качестве экссудативного компонента местной воспалительной реакции; 4) болевой синдром из-за воспалительных проявлений в зеве. В случаях выраженного воспаления в ротоглотке и региональных лимфатических узлах, а также при рецидивировании острого тонзиллита, вызванного бета-гемолитическим стрептококком, патогенетически оправдано включение в комплекс средств терапии противовоспалительных средств. С этой целью в настоящее время в клинической практике широко применяются нестероидные противовоспалительные препараты. Они обладают уникальным сочетанием противовоспалительного, обезболивающего и жаропонижающего механизмов действия. В основе терапевтического действия нестероидных противовоспалительных препаратов лежат механизмы угнетения синтеза простагландинов за счет снижения активности циклоксигеназы (ЦОГ) — фермента, регулирующего превращение арахидоновой кислоты в простагландины.
Нурофен выпускается в виде: 1) суспензии (во флаконе 100 мл и мерный шприц) с приятным апельсиновым или клубничным вкусом, в которой содержится 100 мг/5 мл ибупрофена (отсутствуют сахар, алкоголь и искусственные красители); 2) таблетки, покрытые оболочкой (200 мг ибупрофена в 1 таблетке); 3) суппозитории ректальные (60 мг ибупрофена в 1 супп.).
При развитии острой стрептококковой инфекции 7–10-дневный курс антибактериальной терапии обеспечивает санацию организма от возбудителя, но провоспалительная активность эндогенной усилительной системы организма (цитокиновый «каскад», синтез простагландинов, лейкотриенов, активных форм кислорода и т. д.) может способствовать значительному повреждению тканей в очаге воспаления и последующему длительному сохранению воспалительного процесса. Изучение противовоспалительного эффекта нестероидных противовоспалительных препаратов в комплексе средств терапии острой стрептококковой инфекции у детей представляет несомненный интерес. В 2010 г. нами проведено исследование по изучению противовоспалительного действия ибупрофена у детей, больных острой стрептококковой инфекцией ротоглотки, в зависимости от разных схем терапии: 10-дневной антибактериальной с включением курса Нурофена для детей в первые 5 дней терапии (исследуемая группа из 30 человек в возрасте от 3 до 12 лет) либо без него (контрольная группа из 26 человек того же возраста) [6].
Безопасность Нурофена для детей обусловлена:
Помимо антибактериальных препаратов, Нурофен для детей применяли пациентам опытной группы 3–4 раза в сутки в течение первых 5 дней терапии в стандартной разовой дозе 5–10 мг/кг, что чаще составляло от 2,5 до 5 мл суспензии на прием. Оценивались жаропонижающий и противовоспалительный эффекты Нурофена, а также его безопасность. Дети контрольной группы при появлении лихорадки выше 38,5 °С получали парацетамол в разовой дозе 10–15 мг/кг, т. е. в виде симптоматической терапии по мере необходимости. Как известно, парацетамол не является нестероидным противовоспалительным препаратом, а относится к группе «простых анальгетиков», поскольку обладает жаропонижающим и обезболивающим действием, а противовоспалительная активность его незначительна. У детей, получавших Нурофен, стабильная нормализация температуры, очищение небных миндалин от налетов, уменьшение степени гипертрофии миндалин, регресс регионарного лимфаденита происходили в более быстрые сроки, чем в группе сравнения. Осложнения в виде паратонзиллярного абсцесса у одного ребенка 8 лет со стрептококковой ангиной и острого гайморита у одного ребенка 6 лет с микст-инфекцией отмечены во второй группе, в то время как в первой осложнений не наблюдалось. Нежелательные явления (аллергическая сыпь) были отмечены у одного больного первой группы и одного больного — второй. Таким образом, Нурофен представляется высокоэффективным жаропонижающим и противовоспалительным средством, используемым при ангине у детей.
Нурофен для детей в форме суспензии дают детям 3–12 мес по 2,5 мл не более 3–4 раз в сутки (не более 200 мг/сут); 1–3 лет — 5 мл 3 раза в сутки (не более 300 мг/сут); 4–6 лет — 7,5 мл 3 раза в сутки (не более 450 мг/сут); 7–9 лет — 10 мл 3 раза в сутки (не более 600 мг/сут); 10–12 лет — 15 мл 3 раза в сутки (не более 900 мг/сут). Таблетированная форма Нурофена применяется у детей старше 6 лет с массой тела более 20 кг в тех же дозах, что и сироп, но не более 4 таблеток/800 мг ибупрофена в сутки. Максимальная суточная доза не должна превышать 30 мг/кг массы тела ребенка.
При наличии аллергических заболеваний в анамнезе и сопутствующей патологии органов пищеварения рационально использование парацетамола или Нурофена в свечах в связи с отсутствием в ректальной форме вкусовых добавок и прямого воздействия на слизистую оболочку желудка.
Нурофен для детей выпускается в суппозиториях по 60 мг/1 супп. Предназначены к употреблению у детей от 3 месяцев, разовая доза составляет 5–10 мг/кг. Если лихорадка не является кратковременным эпизодом и сохраняется в течение суток и более, Нурофен детям от 3 до 9 месяцев жизни назначают по 1 свече 3 раза в сутки (не более 180 мг в сутки), от 9 месяцев до 2 лет — по 1 свече 4 раза в сутки (не более 240 мг/сутки).
У детей с синдромом срыгиваний и рвоты применение ибупрофена желательно именно в ректальной форме, что исключает прямое воздействие на слизистую оболочку желудка и возможность передозировки препарата. Отсутствие вкусовых добавок в свечах предупреждает развитие аллергических реакций у детей с неблагоприятным аллергоанамнезом.
Профилактика рецидивов стрептококковой инфекции
В 50-е годы 20-го века в связи с преобладающей циркуляцией ревматогенных штаммов СГА МЗ РФ был издан приказ об обязательной однократной бициллинопрофилактике всех детей, перенесших стрептококковую ангину либо скарлатину после проведения 10-дневного курса лечения антибиотиками. Данный приказ не отменен до настоящего времени, несмотря на то, что случаи ревматизма в последние годы регистрируются редко, отечественные бициллины-3 и 5 являются многокомпонентными и требуют усовершенствования (их введение приводит к образованию пиковых концентраций в крови в первые дни с быстрой утратой бактерицидного эффекта в динамике). В справочнике по лекарственной терапии В. К. Таточенко «Педиатру на каждый день» (стр. 125) появилось Решение антибиотической комиссии МЗ РФ и РАМН «Антибактериальная терапия стрептококкового тонзиллита (острого) и фарингита». Методические рекомендации. М., 1999: «Бициллины назначают при невозможности провести 10-дневный курс лечения, при ревматическом анамнезе, а также при вспышках инфекции, вызванной бета-гемолитическими стрептококками группы А, в коллективах. При остром А-стрептококковом тонзиллите у больных, имеющих факторы риска развития острой ревматической лихорадки (отягощенная наследственность, неблагоприятные социально-бытовые условия и др.), целесообразно применение бензилпенициллина 10 дней с последующей однократной инъекцией бензатилбензилпенициллина. В остальных случаях необходимо проводить только 10-дневный курс антибиотиков». Однако в регионы не поступало регламентирующих указаний об отмене старого приказа, в связи с чем во многих поликлиниках и стационарах продолжают его выполнять. Использование иммуномодуляторов, в том числе бактериальных лизатов, а также средств, нормализующих биоценоз полости рта, является важнейшим способом профилактики рецидивов стрептококковой инфекции ротоглотки.
Литература
Е. И. Краснова, доктор медицинских наук, профессор
С. О. Кретьен
А. В. Васюнин, доктор медицинских наук, профессор
НГМУ, Новосибирск
.gif)