кадмиевое стекло что это
Урановое стекло: реальная опасность или ценный антиквариат?

Первое урановое стекло
Случаи подкрашивания стекла соединениями урана известны с древних времен. Хорошо сохранившаяся древняя плитка со вставками из желтой стеклянной смальты была найдена в 1922 году при археологических исследованиях римской виллы Посиллипо (Италия). Как показал изотопный анализ, стекло было изготовлено в 79 году до нашей эры и содержало около 1% диоксида урана. Находка вызвала множество споров, поскольку масштабное производство уранового стекла началось в середине 19 века. Получается, что древняя технология была утрачена на восемнадцать столетий.
Что такое урановое стекло?
Цветное урановое стекло получается при добавлении к силикатному стеклу солей и окислов урана. Стекловары использовали урановые соединения для варки прозрачного стекла желто-зеленого, изумрудного и коричневого цветов. Однако, технология изготовления не была широко известна в связи с тем, что рецепты хранились в строгом секрете и передавались из поколения в поколение.
желтого диураната натрия Na2U2O7*Н20;
оранжевого трехокиси урана UO3;
коричневого закиси урана UO2;
темно-зеленого смешанного оксида U3O8 (урановой смолки).
За счет варьирования температуры, достигается различная степень прозрачности стекла. Интенсивно желтые и оранжевые оттенки получали добавлением к красителям сернистого кадмия.
 Цветное стекло Риделей
Цветное стекло Риделей
Начиная с 1830-х годов, династия Риделей из города Унтер-Полау в Богемии (Чехия) начала активное производство цветных стекло на основе солей урана. Йозефу Риделю удалось получить красивое зеленое и желто-зеленое стекло, способное загадочно светиться в темноте, которое назвал в честь своей жены «аннагрюн» и «аннагельб» соответственно. Он первый наладил промышленное производство стеклянных украшений: бус, браслетов, сережек, а также стаканов, бокалов и ваз. Фабрика Риделя находилась в Долни Полубны и производила эти виды уранового стекла почти 20 лет – с 1830 по 1848 г. С этого времени начинается бум на изделия, сделанные из уранового стекла, который продлиться до 1940 года
«Канареечное» стекло
Так называлось урановое стекло красивого золотисто-желтого цвета, которые варили английские и французские мастера. Оно действительно по оттенку напоминало окрас канареек, за что и получило такое необычное название. С 1830 канареечное стекло варили и в России на Императорском стеклянном заводе в Санкт-Петербурге. Спустя десять лет предприятие стало выпускать изделия из зеленого стекла, которые гранились или пестро расписывались эмалями и золотом. Их конкуренты – купцы Мальцевы достаточно быстро нашли выход и заменили дорогостоящие урановые красители дешевым медным купоросом, которые также окрашивал стекло в зеленый цвет.
Вазелиновое стекло (vaselineglass)
Так называли урановое стекло желтоватого цвета, напоминающее вазелин, которое появилось в конце 19 века в США. Его получали путем добавления в шихту 2% уранового красителя и добавок, чувствительных к температуре. После двойного нагрева изделия оно становилось молочно-белым по краям с плавным переходом к лимонно-желтому оттенку.
Вазелиновое стекло легло в основу линии посуды Perline: кубки, тарелки, салатницы насыщенного желтого, зеленого и коричневого цветов, выпускаемой компанией Davidson’sglass в Англии. Ввиду того, что во время холодной войны уран дефицитным и дорогим, производство посуды было свернуто. Последние модели посуды под маркой «Перлин» зарегистрированы в 1903 году. Сегодня изделия из вазелинового стекла не выпускаются и стали предметом коллекционирования.
Вазелиновое стекло из обедненного урана применялось для изготовления бижутерии в 50-х годах 20 века после того, как были сняты ограничения на использование урановых красителей. Но широко распространения производство не получило ввиду высокой стоимости оксидов урана и из-за введенных нормативов, касающихся защитной одежды для работников, защиты складских помещений и постоянного мониторинг уровня радиационного фона на предприятии.
Сегодня лишь две компании: Boyd Glass и, Fenton Art Glass занимаются выпуском ограниченных партий изделий из уранового стекла в США, в большей степени, имеющие коллекционное значение. Компании используют одну из разновидностей матового уранового стекла, получившего название – бирманское стекло или «бурмиз». Для него характерен матовый оттенок, плавно переходящий в желтый или розовый цвет.
Расцвет стекла, подкрашенного ураном
Максимальное количество изделия из уранового стекла пришлось на период с 1920 по 1940 год, когда в искусстве царило направление арт-деко. За это время было выпущено свыше 260 тонн урановых красителей, половина из которых пошло на производство различных изделий: украшений, посуды, отделочной плитки, пуговиц, предметов быта и декора.

По окончании военных действий производство возобновилось, но было переведено на обедненный уран, содержащий меньше урана-235 и в 2-3 менее активный, чем соединения природного урана. В настоящее время опаловое стекло не выпускается, являясь коллекционной и антикварной ценностью.
Как отличить урановое стекло?
Урановое стекло можно отличить от обычного стекла по двум признакам:
Красивая желто-зеленая флуоресценция под действием ультрафиолета.
За счет высокого коэффициента преломления урановое стекло под действием ультрафиолет начинает светиться ярким желто-зеленым цветом. Но не все урансодержащие стекла обладают таким свойством. Составы с содержанием урана свыше 20% теряют способность к люминесценции и их можно определить лишь по испускаемой ими радиации.
Урановое стекло испускает ионизирующее излучение, которое можно зафиксировать обычным бытовым дозиметром. Его величина зависит от того, какой уран добавляли при изготовлении стекла – природный или обеденный, и в каком процентном соотношении. Последний содержит в два раза меньше радионуклидов урана, чем в природных соединениях, и может являться слабым источником альфа-частиц. При массовой доле урана до 6% изделия дают гамма-излучение, чуть выше естественного фона, и бета-излучение, превышающее норму в десятки раз.
Урановое стекло: опасно или нет?
Опасность стекла напрямую зависит от происхождения, состава и возраста изделия. Подробный анализ радиационного облучения урановой посуды провела Комиссия по ядерному регулированию. Существуют три пути воздействия радиации, связанной с вазелиновым стеклом:
воздействие гамма-лучей на тело, испускаемых радионуклидами урана;
воздействие бета-частиц на кожу рук;
поглощение урана, выщелоченного пищей, контактирующей со стеклом.
Несмотря на то, что посуда из уранового стекла испускает ионизирующее излечение, сравнимое с показаниями естественного радиационного фона, специалисты не рекомендуют хранить изделия из уранового стекла вместе или размещать его за стеклянными створками шкафов, которые задерживают бета-излучение.
И конечно, не использовать такую посуду в пищевых целях, так как уран способен выщелачиваться из стекла и вместе с пищей попадать в организм. Исследования, проведенные в течение суток, показали, что выщелачивание водой урана минимально, а уксусной кислотой – 30 мкг/л. Учитывая, что он токсичен и связывается белками, нарушая их функцию, и подавляет активность ферментов, в первую очередь поражаются почки.
Содержащийся в стекле, в этом отношении, уран никакой опасности не представляет, так же как и не представляет опасности свинец, содержащийся в большом количестве (десятки процентов) во всех хрустальных изделиях. А ведь хрустальную посуду используют повсеместно и гораздо более часто, чем изделия из уранового стекла.
Первой находкой уранового стекла является стеклянная смальта в мозаичных украшениях римской виллы недалеко от Неаполя, содержащая 1% урана.
Массовое производство изделий из уранового стекла началось уже в Позднем Средневековье, после обнаружения в серебряных рудниках Габсбургов в Иоахимстале (Богемия) ураносодержащих соединений.
Первооткрыватель урана (1789г)- немецкий химик Мартин Клапрот (01.12.1743-01.01.1817) проводил удачные эксперименты по окрашиванию стекла урановыми соединениями.
Первое же промышленное производство уранового стекла началось в 1830-х годах на мануфактуре И. Риделя в Унтер-Полау, Богемия.
На мануфактуре Риделя из уранового стекла изготавливались традиционные для того времени дутые вазы, бокалы и стаканы, украшенные гравировкой.
В 40-х годах девятнадцатого века производство уранового стекла началось повсеместно, в том числе и в России. Каждый производитель вносил свои изменения в рецептуру стекла. Цвет и оттенки уранового стекла варьировались от горчичного до белого, бирюзового и голубого. Экспериментировали также с прозрачностью стекла. Полупрозрачное стекло называлось вазелиновым, непрозрачное зеленое – хризопразовым или нефритовым.
Но во все времена основная опасность уранового стекла заключалась именно в его производстве. Контакт с окислами урана наносил огромный вред здоровью стеклодувов и в эпоху кустарного производства, и позднее, когда ведущие мануфактуры перешли на производство уранового стекла в промышленных масштабах методом прессовки. Но все это уже в прошлом. В период второй Мировой войны производство уранового стекла было прекращено навсегда.
И пускай вы не всегда будете любоваться своим урановым стеклом в темноте при специальном освещении,- это не помешает вам ощущать себя обладателем уникального и редкого предмета минувшей эпохи.
Почему перестали выпускать урановое стекло
Вокруг уранового стекла всегда много домыслов – раз его перестали производить, ведь это же неспроста.
Многие слышали, что большую коллекцию посуды из уранового стекла собрала Людмила Гурченко, но связь красивой антикварной посуды с какими-то проблемами актрисы, конечно, байки.
Урановое стекло – это обычное боросиликатное стекло, в которое добавлены окислы урана. Эти добавки придают стеклу красивый цвет, разный, в зависимости от того, какое именно соединение ввели в стеклянную массу.
Цвет уранового стекла обычно варьируется от канареечно-желтого до почти изумрудного, иногда делали коричневое или оранжевое стекло. Это стекло имеет особые преломляющие свойства и поэтому очень красиво блестит, подобно хрусталю – именно поэтому оно было таким популярным в 19-м и первой половине 20-го века, когда его производили много.
Уже после окончания производства этого стекла выяснилось, что оно еще и флюоресцирует в ультрафиолете – поэтому коллекционеры хранят его в особенных витринах со специальной подсветкой.
Посуда из уранового стекла в обычном свете и в ультрафиолете
Вообще урановое стекло известно с античных времен, в средние века его изготовляли, добавляя в стекольную массу настуран, минерал урана, добываемый в Богемии. Это был распространенный краситель, в 19-м веке, когда «канареечное» стекло было в моде, его выпускали тысячами тонн.
Даже знаменитые витражи на станции метро Новослободская по самому первому проекту собирались сделать из уранового стекла – по замыслу проектировщиков оно создавало бы совершенно особенное освещение станции и интересные световые эффекты. Но государство урановое стекло запретило, и пришлось сделать витражи из обычного (это было в начале 1950-х годов).
Коллекция посуды из уранового стекла, собранная Людмилой Гурченко и хранящаяся в ее доме-музее
Так вот, когда рассуждают о том, почему перестали выпускать такое красивое стекло, выдвигают три основные версии:
— это вредно для потребителей;
— это вредно для изготовителей;
— перестали выпускать, потому что слово «урановый» приобрело негативный оттенок, и никто не хотел покупать.
Все три версии верны лишь частично. Вред от уранового стекла для потребителей совершенно незначителен. Хотя в составе стекла содержится солидный процент окислов урана, и стекло имеет радиоактивное излучение, это совершенно безвредно в бытовом плане.
Сила флюоресценции стекла зависит от процентного содержания окислов урана, максимальное свечение достигается при 6%-содержании, а дальше уменьшается.
Уровень излучения невелик (оно растет со временем, но по настоящему интенсивным должно стать через несколько тысяч лет после изготовления стекла), и это излучение не уходит дальше 15 см от поверхности урановой посуды. Так что стоящая в серванте ваза из такого стекла никогда не нанесет ущерба здоровью своего владельца.
Теоретически, радиоактивный уран может выщелачиваться из посуды и так способен попасть в организм человека. Но реально выщелачивание наступает, если в посуду наливать кислоту, причем в такой концентрации, употребление которой делает вред от урана смешным.
Урановое стекло, произведенное в Чехии в 19-м веке (музейная витрина)
Для стеклодувов, изготовлявших урановое стекло вред действительно был огромный – средний срок жизни стеклодува в 19-м веке редко превышал 35-38 лет. Но это никого тогда не волновало, профсоюзы были не в чести. В викторианское время большинство технологий были очень вредными, я писала, как шляпники сходили с ума от паров ртути а трубочисты умирали от сажи.
А в 20-м веке посуду из уранового стекла начали делать промышленным способом, и она стала очень дешевой. Ее даже прозвали «депрессивной посудой», потому что во времена Великой депрессии в Америке правительство поддерживало производителей стекла, скупая их изделия и буквально раздавая бесплатно населению.
Но это продолжалось ровно до 40-х годов.
Настоящая причина, почему урановое стекло перестали производить – это то, что урану нашли новое применение в середине 20-го века, военное и мирное. Уран вдруг стал поистине драгоценным и стратегическим сырьем, теперь о растрате его на изготовление посуды не могло идти и речи.
Потому советское правительство и не разрешило урановые витражи в метро, архитекторам пообещали любое сырье, но уран – ни за что, стратегический ценнейший минерал.
Колье из уранового стекла, 1930-е годы
К тому же, такая посуда теперь стала бы очень дорогой в производстве, ведь рыночная цена урановых соединений скакнула в космос.
Да и маркетинг такой посуды находился бы в зоне риска – ведь про радиоактивность урана известно всем.
Но при этом антикварное урановое стекло можно купить довольно недорого, если есть желание – его производили очень много.
Друзья, коллекционируете что-нибудь? Много тратите на пополнение коллекции?
КАДМИЙ
КАДМИЙ (Cadmium) Cd, – химический элемент II группы Периодической системы. Атомный номер 48, относительная атомная масса 112,41. Природный кадмий состоит из восьми стабильных изотопов: 106 Cd (1,22%), 108 Cd (0,88%), 110 Cd (12,39%), 111 Cd (12,75%), 112 Cd (24,07%), 113 Cd (12,26%), 114 Cd (28,85%) и 116 Cd (7,58%). Степень окисления +2, редко +1.
Кадмий был открыт в 1817 немецким химиком Фридрихом Штромейером (Stromeyer Friedrich) (1776–1835).
При проверке оксида цинка, вырабатываемого одной из шенебекских фабрик, появилось подозрение, что он содержит примесь мышьяка. При растворении препарата в кислоте и пропускании через раствор сероводорода выпадал желтый осадок, похожий на сульфиды мышьяка, однако более тщательная проверка показала, что этого элемента нет. Для окончательного заключения образец подозрительного оксида цинка и другие цинковые препараты (в том числе карбонат цинка) с этой же фабрики послали Фридриху Штромейеру, занимавшему с 1802 кафедру химии в Геттингенском университете и должность генерального инспектора ганноверских аптек.
Распространенность кадмия в природе и его промышленное извлечение.
Содержание кадмия в земной коре составляет 1,6·10 –5 %. Он близок по распространенности к сурьме (2·10 –5 %) и в два раза более распространен, чем ртуть (8·10 –6 %). Для кадмия характерна миграция в горячих подземных водах вместе с цинком и другими химическими элементами, склонными к образованию природных сульфидов. Он концентрируется в гидротермальных отложениях. Вулканические породы содержат до 0,2 мг кадмия на кг, среди осадочных пород наиболее богаты кадмием глины – до 0,3 мг/кг, в меньшей степени – известняки и песчаники (около 0,03 мг/кг). Среднее содержание кадмия в почве – 0,06 мг/кг.
У кадмия есть собственные минералы – гринокит CdS, отавит CdCO3, монтепонит CdO. Однако своих месторождений они не образуют. Единственным промышленно значимым источником кадмия являются руды цинка, где он содержится в концентрации 0,01–5%. Кадмий накапливается также в галените (до 0,02%), халькопирите (до 0,12%), пирите (до 0,02%), станните (до 0,2%). Общие мировые ресурсы кадмия оцениваются в 20 млн. т, промышленные – в 600 тыс. т.
Характеристика простого вещества и промышленное получение металлического кадмия.
В сухом воздухе кадмий устойчив. Во влажном воздухе он быстро тускнеет, а при нагревании легко взаимодействует с кислородом, серой, фосфором и галогенами. С водородом, азотом, углеродом, кремнием и бором кадмий не реагирует.
Пары кадмия взаимодействуют с парами воды с выделением водорода. Кислоты растворяют кадмий с образованием солей этого металла. Кадмий восстанавливает нитрат аммония в концентрированных растворах до нитрита аммония. Он окисляется в водном растворе катионами некоторых металлов, например меди(II) и железа(III). С растворами щелочей, в отличие от цинка, кадмий не взаимодействует.
Основные источники кадмия – промежуточные продукты цинкового производства. Осадки металлов, полученные после очистки растворов сульфата цинка действием цинковой пыли, содержат 2–12% кадмия. Во фракциях, образующихся при дистилляционном получении цинка, содержится 0,7–1,1% кадмия, а во фракциях, полученных при ректификационной очистке цинка – до 40% кадмия. Кадмий извлекают и из пыли свинцовых и медеплавильных заводов (она может содержать до 5% и 0,5% кадмия, соответственно). Пыль обычно обрабатывают концентрированной серной кислотой, а затем сульфат кадмия выщелачивают водой.
Из растворов сульфата кадмия действием цинковой пыли осаждают кадмиевую губку, затем ее растворяют в серной кислоте и очищают раствор от примесей действием оксида цинка или карбоната натрия, а также методами ионного обмена. Металлический кадмий выделяют электролизом на алюминиевых катодах либо восстановлением цинком.
Для удаления цинка и свинца металлический кадмий переплавляют под слоем щелочи. Расплав обрабатывают алюминием, чтобы удалить никель, и хлоридом аммония, чтобы избавиться от таллия. Применяя дополнительные методы очистки, можно получить кадмий с содержанием примесей 10 –5 % по массе.
В год производится около 20 тыс. т кадмия. Объем его производства в большой степени связан с масштабами производства цинка.
Важнейшей областью применения кадмия является производство химических источников тока. Кадмиевые электроды используются в батареях и аккумуляторах. Отрицательные пластины никель-кадмиевых аккумуляторов изготовлены из железных сеток с губчатым кадмием в качестве активного агента. Положительные пластины покрыты гидроксидом никеля. Электролитом служит раствор гидроксида калия. На основе кадмия и никеля изготавливают и компактные аккумуляторы для управляемых ракет, только в этом случае в качестве основы устанавливают не железные, а никелевые сетки.
Процессы, протекающие в никель-кадмиевом щелочном аккумуляторе, можно описать суммарным уравнением:
Cd + 2NiO(OH) + 2H2O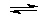
Никель-кадмиевые щелочные аккумуляторы более надежны, чем свинцовые (кислотные). Эти источники тока отличаются высокими электрическими характеристиками, стабильностью работы, длительным сроком эксплуатации. Их можно зарядить всего за один час. Однако никель-кадмиевые аккумуляторы нельзя подзаряжать без полной предварительной разрядки (в этом отношении они уступают металлогидридным аккумуляторам).
Кадмий широко используется для нанесения антикоррозионных покрытий на металлы, особенно в случаях их контакта с морской водой. Кадмируются наиболее важные детали кораблей, самолетов, а также различные изделия, предназначенные для работы в условиях тропического климата. Раньше железо и другие металлы кадмировали погружением изделий в расплавленный кадмий, сейчас кадмиевое покрытие наносят электролитически.
У кадмиевых покрытий есть некоторые преимущества по сравнению с цинковыми: они более устойчивы к коррозии, их легче сделать ровными и гладкими. Высокая пластичность таких покрытий обеспечивает герметичность резьбовых соединений. К тому же кадмий, в отличие от цинка, устойчив в щелочной среде.
Однако у кадмирования есть свои проблемы. При электролитическом нанесении кадмия на стальную деталь в металл может проникнуть содержащийся в электролите водород. Он вызывает у высокопрочных сталей так называемую водородную хрупкость, приводящую к неожиданному разрушению металла под нагрузкой. Для предотвращения этого явления в кадмиевые покрытия вводят добавку титана.
Кроме того, кадмий токсичен. Поэтому, хотя кадмированную жесть применяют довольно широко, для изготовления кухонной утвари и тары для пищевых продуктов использовать ее запрещено.
Примерно десятая часть мирового производства кадмия расходуется на производство сплавов. Кадмиевые сплавы используют главным образом как антифрикционные материалы и припои. Сплав, содержащий 99% кадмия и 1% никеля, применяют для изготовления подшипников, работающих в автомобильных, авиационных и судовых двигателях в условиях высоких температур. Поскольку кадмий недостаточно стоек к действию кислот, в том числе и содержащихся в смазочных материалах органических кислот, иногда подшипниковые сплавы на основе кадмия покрывают индием.
Легирование меди небольшими добавками кадмия позволяет делать более износостойкими провода на линиях электрического транспорта. Медь с добавкой кадмия почти не отличается по электропроводности от чистой меди, но заметно превосходит ее прочностью и твердостью.
Кадмий входит в легкоплавкого сплава Вуда (Wood’s metal), содержащего 50% висмута, 25% свинца, 12,5% олова, 12,5 % кадмия. Сплав Вуда можно расплавить в кипящей воде. Любопытно, что первые буквы компонентов сплава Вуда образуют аббревиатуру ВОСК. Он был изобретен в 1860 не очень известным английским инженером Б.Вудом (B.Wood). Часто это изобретение ошибочно приписывают его однофамильцу – знаменитому американскому физику Роберту Уильямсу Вуду, который родился лишь спустя восемь лет. Легкоплавкие сплавы кадмия используют как материал для получения тонких и сложных отливок, в автоматических противопожарных системах, для спайки стекла с металлом. Припои, содержащие кадмий, довольно устойчивы к температурным колебаниям.
Резкий скачок спроса на кадмий начался в 1940-е и был связан с применением кадмия в атомной промышленности – выяснилось, что он поглощает нейтроны и из него стали делать регулирующие и аварийные стержни атомных реакторов. Способность кадмия поглощать нейтроны строго определенных энергий используется при исследовании энергетических спектров нейтронных пучков.
Соединения кадмия.
Кадмий образует бинарные соединения, соли и многочисленные комплексные, в том числе металлоорганические, соединения. В растворах молекулы многих солей, в частности галогенидов, ассоциированы. Растворы имеют слабокислотную среду вследствие гидролиза. При действии растворов щелочей, начиная с рН 7–8, осаждаются основные соли.
Оксид кадмия CdO получают при взаимодействии простых веществ или прокаливанием гидроксида либо карбоната кадмия. В зависимости от «термической истории» он может быть зеленовато-желтым, коричневым, красным или почти черным. Это частично обусловлено размером частиц, но в большей степени является результатом дефектов кристаллической решетки. Выше 900° С оксид кадмия летуч, а при 1570° С полностью возгоняется. Он обладает полупроводниковыми свойствами.
Оксид кадмия легко растворяется кислотах и плохо – в щелочах, легко восстанавливается водородом (при 900° С), монооксидом углерода (выше 350° С), углеродом (выше 500° С).
Оксид кадмия используют в качестве материала электродов. Он входит в состав смазочных масел и шихты для получения специальных стекол. Оксид кадмия катализирует ряд реакций гидрогенизации и дегидрогенизации.
Гидроксид кадмия Cd(OH)2 выпадает в виде белого осадка из водных растворов солей кадмия(II) при добавлении щелочи. При действии очень концентрированных растворов щелочей он превращается в гидроксокадматы, такие как Na2[Cd(OH)4]. Гидроксид кадмия реагирует с аммиаком с образованием растворимых комплексов:
Кроме того, гидроксид кадмия переходит в раствор под действием цианидов щелочных элементов. Выше 170° С он разлагается до оксида кадмия. Взаимодействие гидроксида кадмия с пероксидом водорода в водном растворе приводит к образованию пероксидов разнообразного состава.
Применяют гидроксид кадмия для получения других соединений кадмия, а также как аналитический реагент. Он входит в состав кадмиевых электродов в источниках тока. Кроме того, гидроксид кадмия используется в декоративных стеклах и эмалях.
Фторид кадмия CdF2 мало растворим в воде (4,06% по массе при 20° С), не растворим в этаноле. Его можно получить действием фтора на металл или фтороводорода на карбонат кадмия.
Фторид кадмия используется в качестве оптического материала. Он входит в состав некоторых стекол и люминофоров, а также твердых электролитов в химических источниках тока.
Хлорид кадмия CdCl2 хорошо растворим в воде (53,2% по массе при 20° С). Его ковалентный характер обусловливает сравнительно низкую температуру плавления (568,5° С), а также растворимость в этаноле (1,5% при 25° С).
Хлорид кадмия получают при взаимодействии кадмия с концентрированной соляной кислотой или хлорированием металла при 500° С.
Хлорид кадмия является компонентом электролитов в кадмиевых гальванических элементах и сорбентов в газовой хроматографии. Он входит в состав некоторых растворов в фотографии, катализаторов в органическом синтезе, флюсов для выращивания полупроводниковых кристаллов. Его используют как протраву при крашении и печатании тканей. Из хлорида кадмия получают кадмиеорганические соединения.
Бромид кадмия CdBr2 образует чешуйчатые кристаллы с перламутровым блеском. Он очень гигроскопичен, хорошо растворим в воде (52,9% по массе при 25° С), метаноле (13,9% по массе при 20° С), этаноле (23,3% по массе при 20° С).
Получают бромид кадмия бромированием металла или действием бромоводорода на карбонат кадмия.
Бромид кадмия служит катализатором в органическом синтезе, является стабилизатором фотоэмульсий и компонентом вирирующих составов в фотографии.
Иодид кадмия CdI2 образует блестящие кристаллы в виде листочков, у них слоистая (двумерная) кристаллическая структура. Известно до 200 политипов иодида кадмия, различающихся последовательностью расположения слоев с гексагональной и кубической плотнейшей упаковкой.
В отличие от других галогенов, иодид кадмия не гигроскопичен. Он хорошо растворяется в воде (46,4% по массе при 25° С). Получают иодид кадмия иодированием металла при нагревании или в присутствии воды, а также действием иодоводорода на карбонат или оксид кадмия.
Иодид кадмия служит катализатором в органическом синтезе. Он является компонентом пиротехнических составов и смазочных материалов.
Сульфид кадмия CdS был, вероятно, первым соединением этого элемента, которым заинтересовалась промышленность. Он образует кристаллы от лимонно-желтого до оранжево-красного цвета. Сульфид кадмия обладает полупроводниковыми свойствами.
В воде это соединение практически не растворяется. К действию растворов щелочей и большинства кислот он также устойчив.
Получают сульфид кадмия взаимодействием паров кадмия и серы, осаждением из растворов под действием сероводорода или сульфида натрия, реакциями между кадмий- и сераорганическими соединениями.
Сульфид кадмия – важный минеральный краситель, раньше его называли кадмиевой желтью.
В малярном деле кадмиевая желть впоследствии стала применяться шире. В частности, ею красили пассажирские вагоны, потому что, помимо прочих достоинств, эта краска хорошо противостояла паровозному дыму. Как красящее вещество сульфид кадмия использовали также в текстильном и мыловаренном производствах. Соответствующие коллоидные дисперсии применяли для получения цветных прозрачных стекол.
В последние годы чистый сульфид кадмия вытесняется более дешевыми пигментами – кадмопоном и цинкокадмиевым литопоном. Кадмопон – смесь сульфида кадмия и сульфата бария. Его получают, смешивая две растворимые соли – сульфат кадмия и сульфид бария. В результате образуется осадок, содержащий две нерастворимые соли:
CdSO4 + BaS = CdS Ї + BaSO4 Ї
Цинкокадмиевый литопон содержит еще и сульфид цинка. При изготовлении этого красителя в осадок выпадают одновременно три соли. Литопон – кремового цвета или цвета слоновой кости.
С добавками селенида кадмия, сульфида цинка, сульфида ртути и других соединений сульфид кадмия дает термически устойчивые пигменты с яркой окраской от бледно-желтой до темно-красной.
Сульфид кадмия придает пламени синюю окраску. Это его свойство используют в пиротехнике.
Кроме того, сульфид кадмия применяется как активная среда в полупроводниковых лазерах. Он случит в качестве материала для изготовления фотоэлементов, солнечных батарей, фотодиодов, светодиодов, люминофоров.
Селенид кадмия CdSe образует темно-красные кристаллы. Он не растворяется в воде, разлагается соляной, азотной и серной кислотами. Получают селенид кадмия сплавлением простых веществ или из газообразных кадмия и селена, а также осаждением из раствора сульфата кадмия под действием селеноводорода, реакцией сульфида кадмия с селенистой кислотой, взаимодействием между кадмий- и селенорганическими соединениями.
Селенид кадмия является люминофором. Он служит в качестве активной среды в полупроводниковых лазерах, является материалом для изготовления фоторезисторов, фотодиодов, солнечных батарей.
Селенид кадмия является пигментом для эмалей, глазурей и художественных красок. Селенидом кадмия окрашивают рубиновое стекло. Именно он, а не оксид хрома, как в самом рубине, сделал рубиново-красными звезды московского Кремля.
Теллурид кадмия CdTe может иметь окраску от темно-серой до темно-коричневой. Он не растворяется в воде, но разлагается концентрированными кислотами. Его получают взаимодействием жидких или газообразных кадмия и теллура.
При нарушении стехиометрии или введении примесей (например, атомов меди и хлора), теллурид кадмия приобретает светочувствительные свойства. Это используется в электрофотографии.
Кадмиеорганические соединения CdR2 и CdRX (R = CH3, C2H5, C6H5 и другие углеводородные радикалы, Х – галогены, OR, SR и др.) обычно получают из соответствующих реактивов Гриньяра. Они термически менее устойчивы, чем их цинковые аналоги, однако в целом менее реакционноспособны (обычно не воспламеняются на воздухе). Их наиболее важной областью применения является получение кетонов из хлорангидридов кислот.
Биологическая роль кадмия.
Кадмий обнаруживается в организмах практически всех животных (у наземных около 0,5 мг на 1 кг массы, а у морских – от 0,15 до 3 мг/кг). Вместе с тем его относят к наиболее токсичным тяжелым металлам.
Кадмий сосредотачивается в организме преимущественно в почках и печени, при этом содержание кадмия в организме к старости повышается. Он накапливается в виде комплексов с белками, которые участвуют в ферментативных процессах. Попадая в организм извне, кадмий оказывает ингибирующее действие на целый ряд ферментов, разрушая их. Его действие основано на связывании группы –SH цистеиновых остатков в белках и ингибировании SH-ферментов. Он может также ингибировать действие цинксодержащих ферментов, замещая цинк. Из-за близости ионных радиусов кальция и кадмия, он может замещать кальций в костной ткани.
Классическим примером хронического отравления кадмием является заболевание, впервые описанное в Японии в 1950-е и получившее название «итай-итай». Болезнь сопровождалась сильными болями в поясничной области, болью в мышцах. Появлялись и характерные признаки необратимого поражения почек. Были зафиксированы сотни смертельных исходов «итай-итай». Заболевание приняло массовый характер в силу высокой загрязненности окружающей среды в Японии в то время и специфики питания японцев – преимущественно рисом и морепродуктами (они способны накапливать кадмий в высоких концентрациях). Исследования показали, что заболевшие «итай-итай» потребляли до 600 мкг кадмия в сутки. В дальнейшем в результате мероприятий по охране окружающей среды, частота и острота синдромов, подобных «итай-итай» заметно снизилась.
В США была обнаружена зависимость между содержанием кадмия в атмосфере и частотой смертельных случаев от сердечно-сосудистых заболеваний.
Считают, что без вреда для здоровья в организм человека в сутки может поступать около 1 мкг кадмия на 1 кг собственного веса. В питьевой воде кадмия не должно содержаться более 0,01 мг/л. Противоядием при отравлении кадмием является селен, однако употребление продуктов, богатых этим элементом, приводит к понижению содержания серы в организме, и в этом случае кадмий снова становится опасным.
 Цветное стекло Риделей
Цветное стекло Риделей






