как понять что диарея бактериальная
Диарея при заболеваниях органов пищеварения
В практике гастроэнтеролога диарея – один из наиболее распространенных симптомов, который может быть признаком многих различных патологических состояний
В практике гастроэнтеролога диарея – один из наиболее распространенных симптомов, который может быть признаком многих различных патологических состояний. С точки зрения существующих диагностических критериев диарея – патологическое состояние, которое подразумевает изменение как формы кала, так и частоты дефекаций. Прежде всего это учащение стула (более 3 раз за сутки), кроме того, выделение жидких каловых масс (водянистых или кашицеобразных) объемом более 200 мл.
Различают острую и хроническую диарею. Симптомы острой диареи могут проявляться от нескольких дней до 4 нед. В большинстве случаев эпизоды острой диареи связаны с вирусной, бактериальной или паразитарной инвазией. При хронической диарее симптомы наблюдаются более 4 нед.
Заболевания органов пищеварения, как правило, сопровождаются хронической диареей. К ним относятся: атрофические гастриты со сниженной секреторной функцией желудка, постгастрорезекционные и постваготомические расстройства, хронический панкреатит с внешнесекреторной недостаточностью поджелудочной железы, билиарные дисфункции и постхолецистэктомический синдром, хронические заболевания печени, патология тонкой кишки, сопровождающаяся развитием синдрома мальабсорбции, бактериальная контаминация тонкой кишки, язвенный колит и болезнь Крона, опухоли тонкой и толстой кишки, ишемический и псевдомембранозный колиты, функциональные заболевания кишечника, гормональноактивные опухоли желудочно-кишечного тракта (ЖКТ).
Различают четыре патогенетических варианта диареи.
Достаточно часто хроническая диарея является клиническим признаком синдрома мальабсорбции. Этот термин уже многие годы широко применяется в зарубежной литературе. Синдром мальабсорбции характеризуется расстройством всасывания в тонкой кишке питательных веществ и нарушением обменных процессов. В основе развития данного синдрома лежат не только морфологические изменения слизистой оболочки тонкой кишки, но и нарушения ферментных систем ЖКТ, двигательной функции кишечника, а также расстройства специфических транспортных механизмов.
В отечественной клинической практике чаще применяют термин «хронический энтерит». Однако гистологическое исследование у большинства таких больных хронического воспаления не выявляет.
Синдром мальабсорбции может быть обусловлен поражением любого из слоев стенки тонкой кишки. Нарушения всасывания бывают частичными (затрудняется абсорбция отдельных нутриентов) или общими (затруднена абсорбция всех продуктов переваривания пищи).
Различают первичную и вторичную мальабсорбцию. В основе первичной мальабсорбции лежат ферментопатии, наследственно обусловленные изменения строения абсорбтивного эпителия (глютеновая болезнь, непереносимость дисахаридов, коллагеновая спру, тропическая спру).
Вторичная мальабсорбция обусловлена повреждениями различных слоев стенки тонкой кишки, а также других органов (болезнь Уиппла, Крона, хронический энтерит, резекция кишки, патология поджелудочной железы, резекция желудка, отравления, лучевые повреждения, амилоидоз, инфекционные и вирусные заболевания, иммунодефицитные состояния).
Напомним о функциональной морфологии тонкой кишки. Она состоит из четырех оболочек: слизистой, подслизистой, мышечной и серозной.
Слизистая оболочка образует спиральные или циркулярные складки, за счет которых всасывающая поверхность возрастает в 2–3 раза. Кроме того, циркулярное расположение складок способствует перемешиванию химуса и задержке его в образующихся нишах. На поверхности слизистой расположено множество ворсинок. Они представлены выпячиваниями собственной пластинки, покрыты столбчатым эпителием, бокаловидными клетками, однослойным каемчатым эпителием, 90% его составляют энтероциты со щеточной ШИК-положительной каемкой, образованной микроворсинками. На поверхности каждого энтероцита расположено 1500–2000 микроворсинок, которые увеличивают всасывающую поверхность кишки в 30–40 раз (до 200 м2). Щеточная каемка характеризуется высокой активностью щелочной фосфатазы. Среди каемчатого эпителия располагаются бокаловидные клетки.
В основании крипт расположены единичные клетки с крупными эозинофильными гранулами. Это клетки Панета, напоминающие ацинарные клетки поджелудочной железы. Есть данные, что клетки Панета должны компенсировать нарушенную экзокринную функцию поджелудочной железы (содержат трипсин, фосфолипазу, ингибитор трипсина). Кроме того, клетки Панета содержат лизоцим, иммуноглобулин А, т.е. выполняют бактерицидную функцию.
Эпителиальные клетки, покрывающие участки кишки, занятые пейеровыми бляшками, отличаются по строению и функции; их называют мембранозными клетками (М-клетками). Микроворсинок на них мало, активность ферментов ниже. М-клетки захватывают и транспортируют антигены из просвета кишки к лимфоидной ткани. Кроме того, в тонкой кишке много эндокринных клеток.
При мальабсорбции наблюдаются симптомы, связанные с дефицитом электролитов, микроэлементов, витаминов. Может развиваться плюригландулярная недостаточность (гипофизарно-надпочечниковая, половые расстройства, снижение функции щитовидной железы). Напротив, функциональные заболевания кишечника никогда не сопровождаются обменными нарушениями, общее состояние больного не страдает. Однако постановка диагноза функционального расстройства (СРК, функциональной диареи) – всегда очень ответственная и серьезная задача, требующая исключения органической патологии кишечника, инфекционных и глистных заболеваний. В дифференциальной диагностике следует исключить так называемые «симптомы тревоги» (потеря веса, лихорадка, кровь в кале, анемия, отягощенный семейный анамнез по раку толстой кишки, лечение антибиотиками). Существуют диагностические критерии, позволяющие дифференцировать СРК и органические заболевания ЖКТ:
Современная диагностика заболеваний органов пищеварения, ассоциированных с диареей, достаточно сложна и включает в себя помимо клинических большой перечень лабораторных и инструментальных методов.
Прежде всего это общеклинический анализ крови и мочи, копрологическое исследование, биохимический анализ крови (общий белок и белковые фракции, глюкоза, липиды крови, электролиты, сывороточное железо, печеночные пробы, панкреатические ферменты), ЭКГ, микробиологическое исследование кала для исключения инфекционного генеза диареи, определение эластазы-1 в кале. Для оценки кислотопродуцирующей функции желудка проводят рН-метрию. Рентгенологическое исследование включает исследование желудка и пассаж бария по тонкой кишке, при необходимости – ирригоскопию.
В стандарт диагностики при диарее входит и УЗИ органов пищеварения (печень, билиарный тракт, поджелудочная железа, кишечник). При хронической диарее проводится эзофагогастродуоденоскопия с биопсией из нисходящего отдела двенадцатиперстной кишки или проксимального отдела тощей кишки для гистологического исследования, качественного определения активности фермента лактазы в биоптате, бактериологического исследования (для диагностики бактериальной контаминации тонкой кишки); для исключения патологии толстой кишки – колоноскопия с осмотром терминального отдела тонкой кишки. В последние годы для оценки состояния кишечника (особенно тонкой кишки) применяются исследования с помощью видеокапсул.
Дыхательный водородный тест с помощью газоанализаторов позволяет определять избыточный бактериальный рост (бактериальную контаминацию) в тонкой кишке, ферментопатии, моторную функцию тонкой кишки.
В настоящее время появился дыхательный углеродный тест с изотопом С 13 для оценки функционального состояния гепатоцитов, внешнесекреторной функции поджелудочной железы, выявления ферментопатий, бактериальной контаминации тонкой кишки и моторной функции ЖКТ. В трудных диагностических случаях для исключения иммунодефицитных состояний проводят оценку иммунного статуса больного (основные субпопуляции иммунокомпетентных клеток, иммуноглобулины в сыворотке крови). Для оценки местного иммунитета в перфузате тонкой кишки определяют острофазные белки, альбумин, α-1-антитрипсин, секреторный иммуноглобулин А. Стандартным методом, рекомендуемым ВОЗ для оценки проницаемости кишечного барьера, является иммуноферментный метод с нагрузкой овальбумином куриного яйца.
В диагностике глютеновой энтеропатии, помимо гистологического исследования биоптата слизистой тонкой кишки, необходимо определение в сыворотке крови антител к глиадину, тканевой трансглютаминазе и определение антиэндомизиальных антител.
Оценку моторной функции кишечника, помимо рентгенологического исследования, можно проводить и с помощью радионуклидного метода после завтрака с радиометкой Тс 99 (сцинтиграфия желудка, тонкой и толстой кишки).
Лечение хронического диарейного синдрома при заболеваниях органов пищеварения должно быть комплексным, обеспечивать нормализацию нутритивного (трофологического) статуса пациента и развитие адаптационно-компенсаторных процессов, что способствует улучшению качества жизни.
Первым и ведущим должно быть назначение диетотерапии. Лечебное питание при диарее включает назначение стандартной диеты, при необходимости – элиминационных диет и смесей для энтерального питания.
Вариант стандартной диеты характеризуется повышенным содержанием белка (110–120 г), физиологической нормой жиров (90 г) и углеводов (300–350 г), витаминов и минеральных веществ в суточном рационе. Энергетическая ценность составляет 2500–2600 ккал. Предусматривается кулинарная обработка продуктов, позволяющая максимально щадить слизистую тонкой кишки и замедлять продвижение пищи. Питание дробное, исключаются продукты с грубой клетчаткой, молоко, консервы, острые и соленые блюда, спиртные напитки.
Элиминационные диеты подразумевают исключение молока при лактазной недостаточности, назначение безглютеновой диеты и исключение продуктов, содержащих «скрытый» глютен (консервы, колбасные изделия, квас, джин, продукты с глютенсодержащими стабилизаторами) при глютеновой энтеропатии.
Назначение смесей для энтерального питания пациентам с клиническими проявлениями синдрома мальабсорбции, с дефицитом массы тела необходимо во всех случаях, когда стандартной диетой не удается обеспечить нутритивную поддержку. Применяют стандартные, полуэлементные, модульные, иммуномодулирующие и специальные метаболические смеси для коррекции метаболических нарушений, как альтернатива лекарственным препаратам (Нутризон, Клинутрен, Берламин Модуляр, Унипит, Пептамен и др.).
Для коррекции обменных нарушений в ряде случаев применяют заместительную терапию, включающую пероральные регидратационные растворы (Регидрон, Гастролит, Глюкосалан и др.), парентеральное введение белков, аминокислотных смесей в сочетании с анаболическими стероидами (Ретаболил), глюкозы, электролитов, витаминов группы В, аскорбиновой кислоты, препаратов железа.
Для подавления роста патогенной микробной флоры в верхних отделах тонкой кишки назначаются антибактериальные препараты широкого спектра действия – сульфаниламиды (Бисептол, Фталазол, Котримоксазол), производные нитрофуранов (Фурагин, Фуразолидон), хинолоны (Нитроксолин), фторхинолоны (Цифран) в средних терапевтических дозах в течение 5–7 дней. Для подавления роста анаэробных бактерий применяют метронидазол 0,5 г 3 раза в день в течение 7–10 дней. Эффективны кишечные антисептики, имеющие широкий спектр действия: Интетрикс по 1 капсуле 3 раза в день – 7–10 дней, Эрсефурил по 200 мг 4 раза в день – 7 дней.
Помимо этого, в настоящее время для деконтаминации тонкой кишки используют препараты, обладающие пробиотическим действием: Энтерол по 1 капсуле 2 раза в день в течение 14 дней, Бактисубтил по 1 капсуле 2–3 раза в день в течение 3–4 нед, а также препараты на основе сенной палочки (Споробактерин, Биоспорин, Бактиспорин).
После проведения антибактериальной терапии эффективно использование пребиотиков (Хилак форте – 40–60 капель 3 раза в день в течение 2–4 нед; Дюфалак в пребиотической дозе 5–10 мл в день в течение 1 мес) для восстановления нормальной микрофлоры кишечника. С этой же целью назначают препараты пробиотического действия (Линекс, Бифидумбактерин форте, Пробифор, Бифиформ, Ацилакт, Колибактерин в средних терапевтических дозах в течение минимум 4 нед), а также синбиотические биокомплексы (Нормофлорин Л, Нормофлорин Б, Нормофлорин Д) курсами по 2–4 нед.
Одним из пробиотиков, широко применяемых в клинической практике, является Линекс — комбинированный препарат, в состав которого входят три вида бактерий: Bifidobacterium infantis v. liberorum, Lactobacillus acidophilus и нетоксигенный молочнокислый стрептококк группы Д Streptococcus faecium. Линекс отвечает современным требованиям: содержит комплекс живых микроорганизмов, играющих важную роль в поддержании кишечного биоценоза, все три штамма бактерий Линекса устойчивы к воздействию агрессивной среды желудка, что позволяет им беспрепятственно достичь всех отделов кишечника, не теряя своей биологической активности. Применение Линекса безопасно в любой возрастной группе пациентов. Микробные компоненты Линекса обладают высокой резистентностью, что позволяет принимать препарат одновременно с антибиотиками и химиотерапевтическими средствами. Взрослым и детям старше 12 лет назначают по 2 капсулы 3 раза в сутки после еды. Курс лечения зависит от причин развития дисбиотических нарушений. В литературе не отмечено случаев побочных действий или передозировки Линекса.
В лечении антибиотикоассоциированной диареи и псевдомембранозного колита препаратами выбора являются ванкомицин, метронидазол, Энтерол. Пациентам с болезнью Уиппла назначают тетрациклин в дозе 1–2 г в день, Бисептол – 6 мг/кг массы тела в течение 5–9 мес с последующим снижением дозы.
Ингибиторы кишечной моторики и секреции назначают короткими курсами или, по требованию, в случаях острой диареи, при СРК.
С древности врачи использовали при диарейном синдроме настойку опия. В настоящее время назначают лоперамид (Имодиум) для уменьшения частоты стула и гиперсекреции слизи в кишечнике – по 1–2 капсуле 1–4 раза в сутки до появления нормального стула или отсутствия дефекации более 12 ч. Наряду с лоперамидом, к регуляторам моторики кишечника относят платифиллин, гиосцина бутилбромид (Бускопан), дротаверин (Но-шпа), которые назначают по 40–80 мг 3 раза в сутки, Метеоспазмил (1–2 капсулы 3 раза в сутки). При гормонально активных опухолях хорошим антидиарейным эффектом обладают аналоги гормона соматостатина (Октреотид, Сандостатин).
Вяжущие, обволакивающие средства сорбируют жидкость, избыток органических кислот, токсинов. К ним относятся препараты, содержащие белую глину, танин, висмут; Неоинтестопан, Таннакомп (обладающий вяжущим, обволакивающим и антибактериальным действием), Альмагель, Смекта, которые назначают на 5–7 дней.
В клинической практике с этой целью используют и лекарственные растения: чернику, черемуху, зверобой, кору дуба, ольховые шишки, кожуру плодов граната в виде отваров.
Энтеросорбенты препятствуют воздействию бактериальных и вирусных агентов, токсинов, осуществляют цитопротекцию. К ним относят Смекту, Энтеросгель, Полифепан, Фильтрум-СТИ, Неоинтестопан, которые назначают в среднем на 10–14 дней, в интервалах между приемами пищи. При холегенной диарее эффективны Холестирамин, Билигнин.
Ферментные препараты назначают для оптимизации процессов полостного пищеварения. При лактазной недостаточности у детей применяют фермент Лактаза Бэби (1 капсулу с каждым кормлением ребенка в возрасте до 1 года; детям до 7 лет – 2–5 капсул с пищей, содержащей молоко). Взрослым пациентам рекомендуют элиминационную диету (с исключением молока). При выборе ферментных препаратов, содержащих панкреатин, необходимо отдавать предпочтение средствам, характеризующимся высоким содержанием липазы, а также обращать внимание на форму выпуска (минимикросферы, устойчивые к действию желудочного сока) (Креон, Панцитрат). Суточная доза ферментных препаратов в лечении синдрома мальабсорбции должна составлять 30000–150000 ЕД (в пересчете на содержание липазы).
Глюкокортикостероидные препараты применяют при тяжелых и средней степени тяжести формах глютеновой энтеропатии (при средней степени тяжести 20–30 мг при пересчете на преднизолон, при тяжелых формах — 50–70 мг в течение 2 нед с постепенным снижением дозы до полной отмены).
Таким образом, диарея может быть признаком многих заболеваний органов пищеварения. Адекватные диагностические мероприятия при диарейном синдроме позволяют врачу назначать оптимальное комплексное, этиотропное и патогенетическое лечение.
Литература
И. Д. Лоранская, доктор медицинских наук, профессор
РМАПО, Москва
Как понять что диарея бактериальная
Диарею инфекционного происхождения наблюдают достаточно часто. Она приводит к значительным экономическим потерям, связанным с временной нетрудоспособностью работников. Эта патология — одна из частых причин смерти детей в возрасте до пяти лет. Защита кишечника от патогенных микроорганизмов осуществляется при помощи желудочного сока, солей жёлчных кислот, иммунных факторов слизистой оболочки, а также веществ, выделяемых нормальной микрофлорой.
Заражение происходит посредством фекально-орального механизма, при употреблении контаминированной еды и воды. Для возникновения инфекции бывает достаточно всего десяти возбудителей (Shigella). Употребление некоторых продуктов питания (молока) или приём лекарственных препаратов (блокаторов Н2-рецепторов гистамина и ингибиторов протонного насоса) способствует снижению защитных свойств желудочного сока.
Бактерии попадают в пищу от инфицированных животных, а также в связи с несоблюдением санитарных норм на скотобойнях и при продаже мяса. Яйца инфицированных сальмонеллой кур также могут быть заражены бактериями. Неправильное хранение и приготовление пищи способствует выживанию и размножению микроорганизмов.
Передача инфекции облегчается в условиях антисанитарии, войн или миграции беженцев. В такой ситуации заболевание распространяется достаточно быстро и характеризуется высокой смертностью. Холера способна к быстрому распространению на территориях многих стран и континентов (пандемия).
Диарея путешественников обычно развивается не позднее 72 ч прибытия в новую страну. Наиболее высок риск развития заболевания в странах Латинской Америки, Африки и Азии. Жидкий водянистый стул наблюдают 2—4 раза в день, при этом кровь и слизь в кале обычно отсутствуют. В большинстве случаев причиной диареи становятся энтеротоксигенные и энтероадгезивные штаммы Escherichia coli.
Основную роль в лечении играет восстановление водно-электролитного баланса в организме, а также назначение антибактериальных препаратов (ко-тримоксазол или ципрофлоксацин).
Диарея, вызванная С. difficile, — одна из самых распространённых внутрибольничных инфекций.
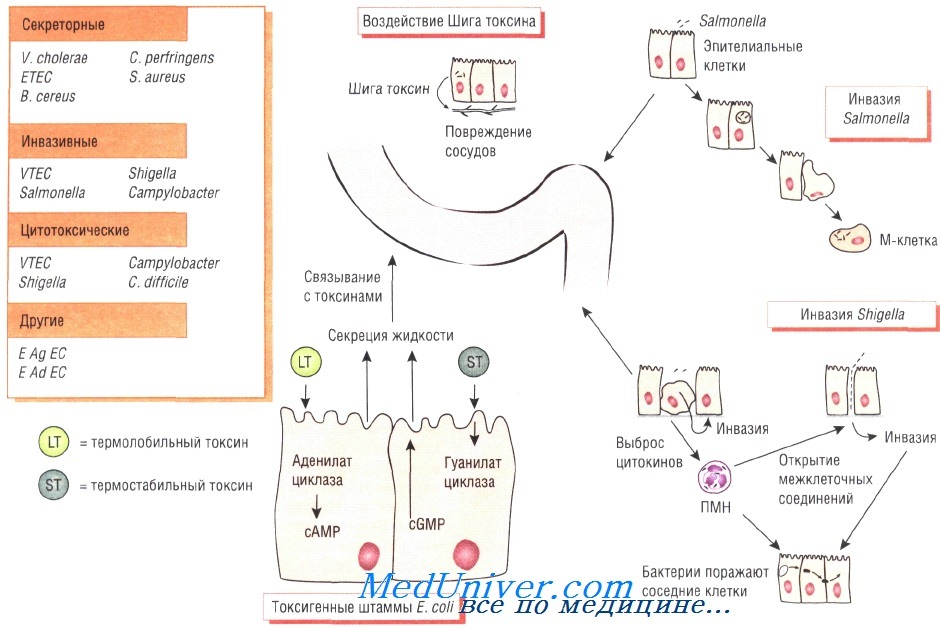
Патогенез бактериальной диареи
Симптомы инфекционной диареи обусловлены определёнными патофизиологическими механизмами, например токсической дисрегуляцией клеток кишечника, приводящей к повышению секреции жидкости или поражению кишечной стенки с последующим разрушением клеток.
Секреторная диарея характеризуется нечастым обильным стулом, возникающим в результате нарушения всасывающей способности кишечника. При дизентерии (шигеллёз) отмечают частый жидкий стул с примесью крови, что связано с расстройством функций кишечника вследствие воспалительного процесса.
Энтерогеморрагические штаммы Е. coli продуцируют Шига токсин, вызывающий кровавый понос и гемолитико-уремический синдром (причина почечной недостаточности у детей). Чаще всего выделяют серотип 0157:Н7. Мишенью для токсина служит эндотелий капилляров.
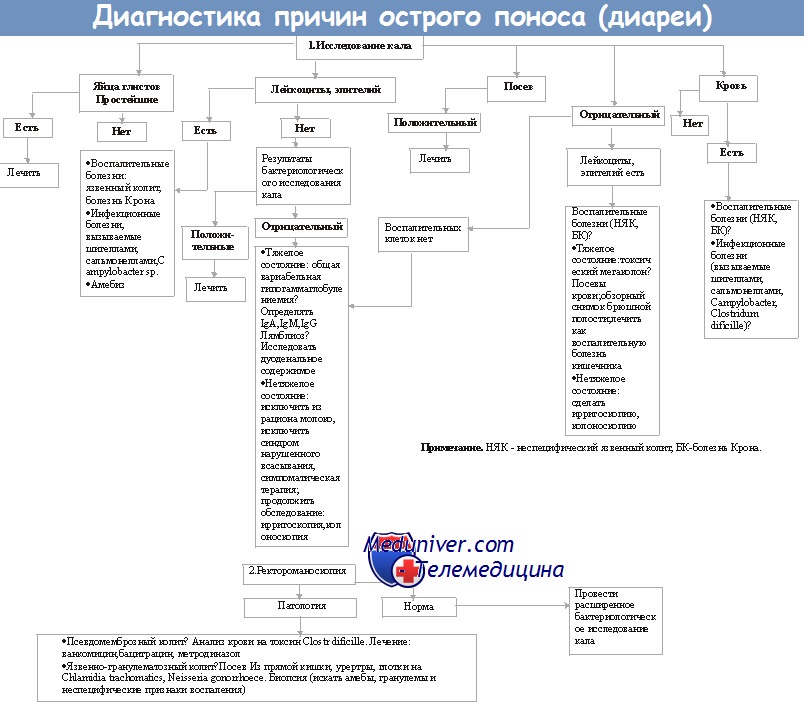
Клинические признаки бактериальной диареи (поноса)
Хотя термин «диарея» и может быть определён как увеличение частоты стула, но это весьма субъективный симптом. При этом отмечают как частый скудный жидкий (характерный признак инфекции толстой кишки), так и нечастый обильный стул (симптом поражения тонкой кишки). При поражении слизистой оболочки кишечника в кале обнаруживают примесь крови, а при нарушении всасывания — жирный стул с неприятным запахом.
Во время диареи достаточно быстро может происходить обезвоживание организма и нарушение электролитного баланса, представляющее серьёзную угрозу жизни пациента (например, при холере). Диарея иногда сопровождается спастическими болями в животе (при инфекции, вызванной представителями рода Campylobacter и Shigella), напоминающими острую хирургическую патологию (острый живот, аппендицит). Температура при диарее повышается не всегда.
В некоторых случаях при сальмонеллёзе развивается септицемия, редко наблюдающаяся при других бактериальных кишечных инфекциях. При кампилобактериозе возможна транзиторная бактериемия. Энтеротоксигенный штамм Escherichia coli 0157 вызывает геморрагический колит, осложняющийся впоследствии почечной недостаточностью и гемолитико-уремическим синдромом.
Снижение уровня кишечной лактазы приводит к развитию вторичной лактозной недостаточности и длительной диарее. Эти нарушения продолжаются в течение нескольких недель, а затем внезапно исчезают. Серьёзные трудности при лечении кишечных инфекций возникают у пациентов со сниженным иммунитетом. При недостаточности IgA часто развивается лямблиоз, а при слабом Т-клеточном иммунитете — сальмонеллёз и криптоспоридиоз.
Диагностика причины диареи (поноса)
Для обнаружения простейших (например, Giardia lamblia) необходимо провести микроскопию образцов кала, а для идентификации микроспоридий и Cryptosporidium parvum — исследование мазков, окрашенных по Цилю—Нильсену.
Для выращивания патогенных микроорганизмов применяют селективные питательные среды, подавляющие рост непатогенной микрофлоры (например, сорбитолсодержащая среда МакКонки для культивирования штаммов Е. coli 0157, секретирующих веротоксин). Для выделения бактерий рода Campylobacter используют среды с содержанием определённых антибиотиков и (или) осуществляют культивирование при температуре 43 °С.
При подозрении на холеру образцы кала помещают в щелочной пептонный бульон (высокий уровень рН создаёт преимущества для роста Vibrio cholerae). Затем культура может быть пересеяна на специфические питательные среды с высоким значением рН, содержащие соли жёлчных кислот. Разработанную для определения вышеуказанных возбудителей сложную систему молекулярно-генетического метода пока не используют в повседневной клинической практике.
При эпидемиологических расследованиях определяют серотипы микроорганизмов. Когда микроорганизм имеет только один серотип (например, Shigella sonnet), в дальнейшем проводят уже молекулярное типирование для подтверждения вспышки заболевания.
Вирусы можно обнаружить с помощью прямой электронной микроскопии, выделения чистой культуры, молекулярногенетического метода и ИФА.
Токсины также могут быть определены в кале больного (например, токсины Clostridium difficile).
Лечение бактериальной диареи (поноса)
Лечение включает проведение адекватной регидратации и восстановление электролитного баланса. Несмотря на то что при секреторной диарее происходит выведение большого объёма жидкости, всё же абсорбция жидкости в кишечнике сохраняется.
Для оральной регидратации, проведение которой способствует заметному снижению смертности пациентов, обычно используют растворы, содержащие натрий (150—155 ммоль/л) и глюкозу (200—220 ммоль/л). Проведение внутривенной регидратации требуется достаточно редко.
Препараты, снижающие моторику кишечника, малоэффективны и, более того, могут быть опасны при назначении маленьким детям. Для уменьшения длительности заболевания при холере и тяжёлой водянистой диарее применяют антибиотики (тетрациклин или ципрофлоксацин).
Лечение тяжёлых форм дизентерии и сальмонеллёза включает назначение ципрофлоксацина или ко-тримоксазола. При развитии почечной недостаточности и гемолитико-уремического синдрома вследствие инфекции, вызванной Е. coli О157, необходимо лечение в условиях стационара.
Профилактика бактериальной диареи (поноса):
• Использование безопасных источников водоснабжения (отсутствие фекального загрязнения от животных и людей).
• Предотвращение попадания патогенных кишечных микроорганизмов от животных в пищевые продукты.
• Тщательная термическая обработка пищи.
• Хранение пищевых продуктов при низкой температуре (для предотвращения размножения возбудителей).
• Раздельное хранение готовой и сырой пищи для исключения перекрёстной контаминации (особенно важно для предприятий общественного питания, где единичное нарушение санитарно-гигиенических норм может привести к массовой вспышке заболевания).
• Тщательный выбор источников пищи и воды для профилактики диареи путешественников.
• Для создания кратковременного иммунитета применяют лицензированные вакцины для профилактики холеры (обладает коротким протективным эффектом) и брюшного тифа. В настоящее время используются 3 парентеральные инактивированные корпускулярные вакцины против брюшного тифа: термоинактивированная (феноловая), сухая, инактивированная ацетоном, и очищенная, содержащая Vi-полисахарид, а также для орального введения — Ту21а-вакцина.
Кроме того, разрабатываются новые (генно-инженерные или рекомбинантные) вакцины, например вакцина, содержащая Vi-антиген, которая во время испытаний продемонстрировала высокую иммуногенность, и живая аттенуированная вакцина (находится на ранней стадии исследования).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021