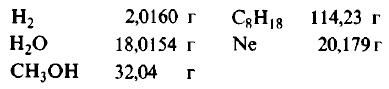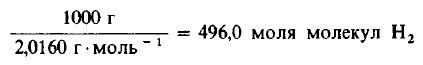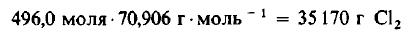как узнать массу молекулы
Молекулы. Химические формулы. Молекулярные массы
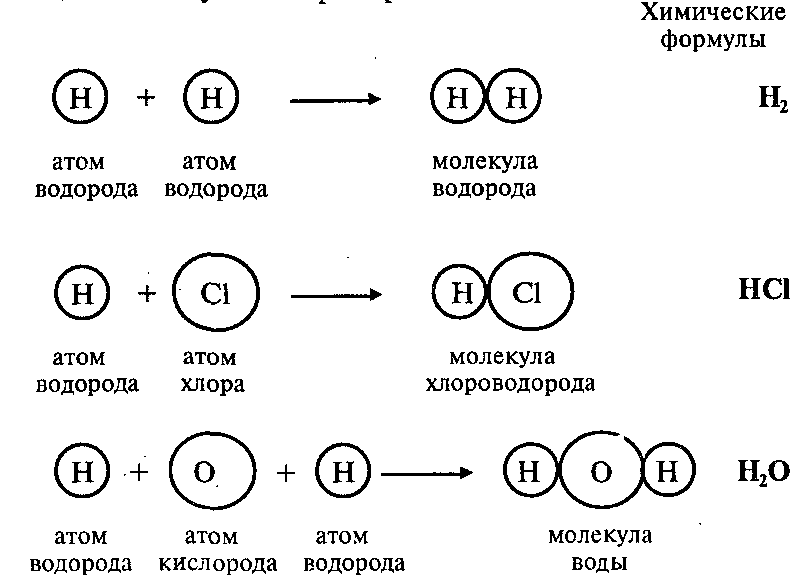
Атомы могут соединяться друг с другом. В результате этого соединения обычно образуются более сложные частицы – молекулы. Например:
Эти примеры показывают, что соединяться друг с другом могут атомы одного элемента и атомы разных элементов. Число атомов, которые соединяются друг с другом, может быть различным.
Состав любой молекулы можно выразить химической формулой.
Так, молекула водорода имеет формулу Н2. Число «2» в этой формуле показывает число атомов водорода в молекуле водорода.
Числа в химических формулах, которые показывают, сколько атомов данного элемента входит в состав молекулы, называются индексами.
Молекула хлороводорода имеет формулу НCl, так как она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет формулу Н2O. Эта формула показывает, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Молекула серной кислоты состоит из двух атомов водорода Н, одного атома серы S и четырех атомов кислорода О. Значит, формула молекулы серной кислоты — H2SO4.
Существуют молекулы, в состав которых входит несколько одинаковых групп атомов. В формулах таких молекул эти группы атомов заключают в скобки, а индекс за скобками показывает число этих групп в молекуле. Например, формула Cu(NO3)2 показывает, что эта молекула состоит из одного атома меди и двух групп атомов NО3, т. е. двух атомов азота и шести атомов кислорода.
Таким образом, химические формулы доказывают качественный и количественный состав молекулы (из атомов каких элементов состоит молекула и сколько этих атомов в молекуле).
Согласно закону постоянства состава (Ж. Пруст, Франция, 1808 г.): Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Так как вещество состоит из одинаковых молекул, то состав молекулы определяет состав всего вещества. Различия в химических свойствах веществ обусловлены различиями в составе и строении молекул, из которых состоят эти вещества. Поэтому можно сделать вывод:
Молекула — это наименьшая частица вещества, которая сохраняет его химические свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается относительная молекулярная масса, которая обозначается символом Мr.
Например, относительная молекулярная масса воды Н2O равна:
Mr(H2О) = Ar(H) + Аr(Н) + Аr(О) = 2Аr(Н) + Аr(О) =2∙1+16=18;
относительная молекулярная масса сульфата железа (III) Fe2(SO4)3 равна: Mr[Fe2(SO4)3] = 2Ar(Fe) + 3Ar(S) + 12Ar(O) = 2∙56+3∙32+12∙16=400;
Относительная молекулярная масса вещества Мr — это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода С.
Например, относительная молекулярная масса воды Mr(H2О) = 18. Это значит, что масса молекулы воды в 18 раз больше 1/12 части массы атома углерода.
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля (ω) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:
где ω(Х) — массовая доля элемента Х; Ar(X) — относительная атомная масса элемента Х; n — число атомов элемента Х в молекуле вещества; Мr — относительная молекулярная масса вещества.
Как узнать массу молекулы
Основной характеристикой атомов и молекул служит относительная атомная масса элемента (сокращенно – атомная масса) и относительная молекулярная масса вещества (сокращенно – молекулярная масса). За единицу атомной массы выбрана 
Атомной массой Аr химического элемента называется отношение массы атома этого элемента к 
Молекулярной массой Mr вещества называется отношение массы молекулы этого вещества к 
Как только что было определено, единица массы, равная 
Количество вещества, в котором содержится число молекул, равное числу атомов в 0,012 кг углерода С, называется молем.
Число молекул, содержащихся в одном моле, называется числом Авогадро. Экспериментально определено, что число Авогадро
 . . |
Лоренцо Романо Амедео Карло АВОГАДРО (1776-1856)
Итальянский физик и химик. Родился в Турине в дворянской семье, получил ученую степень доктора церковного права. В 1800 г. начал самостоятельно заниматься математикой и физикой, а спустя шесть лет получил должность профессора в колледже города Верчелли. Затем стал профессором кафедры математической физики Туринского университета. Авогадро был чрезвычайно скромным человеком, работал в одиночестве, и большую часть его жизни достижения Авогадро были неизвестны в научном мире.
Таким образом, в моле любого вещества содержится число Авогадро молекул. Массу моля, выраженную в килограммах, называют молярной массой и обозначают греческой буквой μ. Масса моля равна произведению NA на массу одной молекулы:
 . . |
 . . |
Отсюда
 . . |
Таким образом, масса любого атома равна
 . . |
а любой молекулы –
 . . |
Произведение 
Подставляя это в формулу
 . . |
получим:
 . . |
или
 . . |
Если вещество состоит из молекул, образованных из атомов различных химических элементов, то молекулярная масса данного вещества равна сумме атомных масс элементов, входящих в состав данного вещества. Так молекулярная масса воды Н2О, состоящая из двух атомов водорода и одного атома кислорода, будет равна
 . . |
Возьмем 1 см 3 Н2О. Его масса 1 г. Один моль воды содержит 18 г. Таким образом, 1 см 3 воды содержит 

Таким образом, в жидкой воде на долю одной молекулы приходится объем
 . . |
 . . |
Масса самой легкой молекулы – молекулы водорода Н2 – равна
 . . |
Это очень маленькая величина, однако, масса электрона в тысячи раз меньше.
Чтобы нагляднее представить себе размеры атомов молекул и их количество в определенном объеме вещества, вот два интересных примера:
1) наименьшие размеры частиц, доступные рассмотрению в оптический микроскоп, содержат примерно 10 миллиардов атомов;
2) если все атомы, находящиеся в 1 см 3 меди, расположить в одну линию плотно друг к другу, то длина такой цепочки будет примерно 14 миллиардов километров. Это примерно в 90 раз больше, чем расстояние от Земли до Солнца.
Относительная атомная и молекулярная масса
Одной из важнейших характеристик любой молекулы и любого атома является его масса. В химии ее принято измерять не в килограммах, а с помощью так называемой а. е. м. – атомной единицы массы.
Как определить массу молекулы?
Хотя идеи о том, что все вещества состоят из мельчайших частиц, то есть атомов, высказывались ещё Демокритом в Античности, доказать подобные гипотезы было невозможно. Однако в начале XIX в. произошел научный прорыв. Джон Дальтон открыл сразу три важных закона:
Объяснить открытые закономерности можно было только с помощью гипотезы об атомной строении вещества. Эти же законы позволяли Дальтону сравнивать массы атомов и молекул между собой. Ученый принял массу атома водорода за единицу (так как он оказался самым легким атомом), и через нее (то есть через водородную единицу) в 1803 г. выразил массы многих других атомов и молекул. Впрочем, оказалось, что значительная часть вычислений была проведена с ошибками.
На тот момент для определения масс атомов чаще всего использовались реакции образования оксидов, то есть кислородных соединений. По этой причине в ходе опытов фактически в качестве единицы измерения использовалась масса не атома водорода, а атома кислорода. Изначально грубые расчеты показывали, что кислородный атом в 16 раз тяжелее водородного атома, то есть его масса, по системе Дальтона, составляла 16 единиц. Однако потом выяснилось, что всё же атом кислорода тяжелее только в 15,874 раза. Эти данные потребовали пересчета всех атомных масс. Но химики поступили проще – они договорились, что теперь масса кислородного атома принимается в точности равной 16 атомным единицам. Так возникла новая, кислородная единицы атомного веса. В результате пересчитывать пришлось лишь массу водорода – она теперь составляла не единицу, а 16:15,874≈ 1,0079 атомных единиц.
Уже в начале XX в. выяснилось, что в природе могут существовать изотопы – разные по массе атомы одного и того же элемента. В частности, в природе встречается три различных стабильных изотопов кислорода (и ещё 10 – нестабильных). Встал вопрос – масса какого из этих изотопов будет приниматься за единицу? Физики стали использовать массу изотопа кислород-16, а химики – среднюю массу всех изотопов (с учетом их распространенности в природном кислороде). Возникли разночтения, которые были решены лишь в 1960-1961 г. Тогда была принята договоренность, что масса изотопа углерода-12 принимается равной 12 атомным единицам массы (а. е. м.). Таким образом появилась углеродная единица.
Молярная масса
Помимо молекулярной массы существует ещё и молярная масса. Она показывает, сколько грамм весит один моль вещества. Фактически молярная масса совпадает со значением молекулярной массы, но измеряется она в других величинах – в г/моль. Например, если атомная масса углерода-12 равна 12 а. е. м., то его молярная масса составит 12 г/моль.
Какова масса одной а. е. м.?
С помощью атомных масс удобно сравнивать друг с другом массы молекул атомов и соединений. Например, если молекула воды весит 18 а. е. м., в молекула углекислого газа – 44 а. е. м., то это значит, что молекула СО2 тяжелее молекулы воды в 44/18 ≈2,444 раза. Но как определить массу атомов и молекул в привычных для нас килограммах?
Это можно сделать, вычислив число Авогадро, которое показывает, сколько молекул содержится в 1 моле вещества. Первые оценки числа Авогадро были проведены лишь в 1865 г., но тогда ученые ошиблись в 15 раз, через 8 лет ошибка уменьшилась в 10 раз. Сегодняшние измерения показывают, что один атом водорода весит всего лишь 1,66•10 –27 кг.
Подведение итогов
Для определения массы атомов и молекул используется а. е. м. – атомная единица массы. Она составляет 1/12 от массы атома изотопа углерода 12 и примерно равна 1,66•10 –27 кг.
Физика. 10 класс
§ 2. Масса и размеры молекул. Количество вещества
В 1,0 см 3 любого газа, находящегося при нормальных условиях (температура t0 = 0,0 °С, давление р0 = 1,0 · 10 5 Па), содержится 2,7 · 10 19 молекул. Чтобы представить, насколько велико это число, предположим, что из отверстия в ампуле вместимостью V = 1,0 см 3 ежесекундно вылетает 100 молекул. Тогда, для того чтобы все молекулы вылетели из ампулы, потребуется 8,6 млрд лет, т. е. промежуток времени, сравнимый с возрастом Вселенной (12–15 млрд лет). Такое огромное число молекул в веществе свидетельствует о том, что их размеры очень малы. Каковы же размеры и масса частиц вещества? Как определить число атомов в любом макроскопическом теле?
Молекулярно-кинетическая теория предоставляет возможность оценить массу и размеры частиц, образующих макроскопические тела. Молекулы, как и атомы, не имеют чётких границ. Если представить молекулу в виде шарика, то её радиус имеет значение от 0,1 нм у простейших до 100 нм у сложных молекул, состоящих из нескольких тысяч атомов. Например, оценочный диаметр молекулы водорода составляет 0,2 нм, а диаметр молекулы воды — 0,3 нм. При таких размерах число частиц в веществе очень велико. Например, в одном грамме воды содержится 3,3 · 10 22 молекул.
Размеры и масса молекулы возрастают с увеличением числа атомов, которые входят в её состав. Атомы и молекулы (кроме многоатомных молекул органических веществ) имеют массу порядка 10 –26 кг. Из-за малых значений выражать массы атомов и молекул в килограммах (кг) неудобно. Поэтому для измерения масс атомов и молекул в химии и физике используют атомную единицу массы (а. е. м.). Атомную единицу массы выражают через массу изотопа углерода :
Массу молекулы (или атома), выраженную в атомных единицах массы, называют относительной молекулярной массой Mr (или относительной атомной массой Ar). Относительная молекулярная (или атомная) масса Mr показывает, во сколько раз масса m0 молекулы (или атома) больше атомной единицы массы:
В периодической системе химических элементов Д. И. Менделеева (см. форзац 2) возле символов элементов указаны и их относительные атомные массы. В большинстве случаев при проведении расчётов значение относительной атомной массы округляют до целого числа, используя правила приближённых вычислений. Так, например, относительная атомная масса водорода равна 1, кислорода — 16, азота — 14.
Количество вещества, содержащегося в макроскопическом теле, определяют числом частиц в нём. Приведённые выше примеры показывают, насколько велико это число. Поэтому при расчётах принято использовать не абсолютное число частиц вещества, а относительное:
т. е. количество вещества ν определяют отношением числа частиц N этого вещества к постоянной Авогадро NA.
В молекулярно-кинетической теории наряду с относительной молекулярной (или атомной) массой используют м олярную массу M — массу вещества, взятого в количестве ν = 1 моль. Молярную массу M определяют отношением массы m вещества к его количеству ν:
Молярную массу вещества также можно вычислить по формуле
1. Во сколько раз число молекул водорода, взятого в количестве νв = 8 моль, больше числа молекул азота, количество вещества которого νа = 4 моль?
| Формула | Физические величины, входящие в формулу | Единицы физических величин |
| ν — количество вещества N — число частиц вещества NA — постоянная Авогадро | моль — моль –1 | |
| М — молярная масса | ||
| m — масса вещества m0 — масса молекулы вещества | кг кг | |
| NA = 6,022·10 23 моль –1 |
1. В каких единицах измеряют массы атомов и молекул?
2. Что такое количество вещества? Назовите единицу этой физической величины.
3. Что такое постоянная Авогадро?
4. Что называют молярной массой вещества?
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
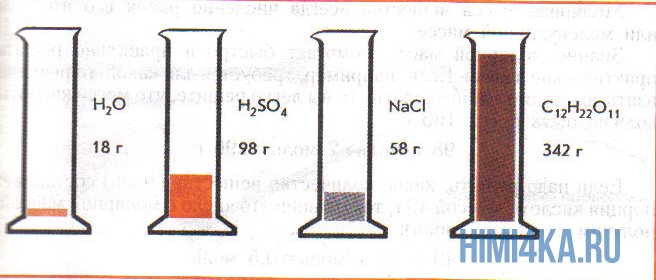
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.