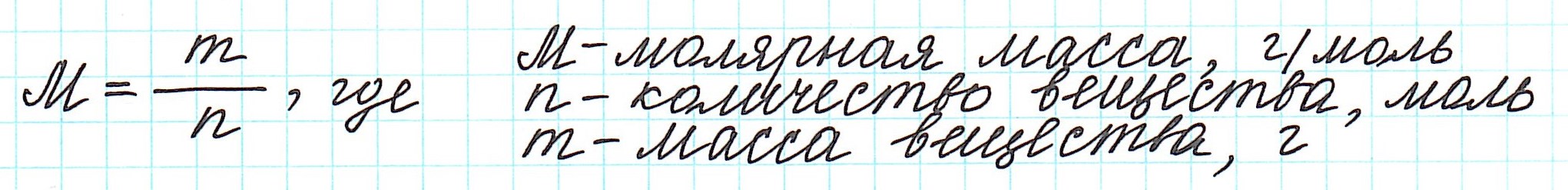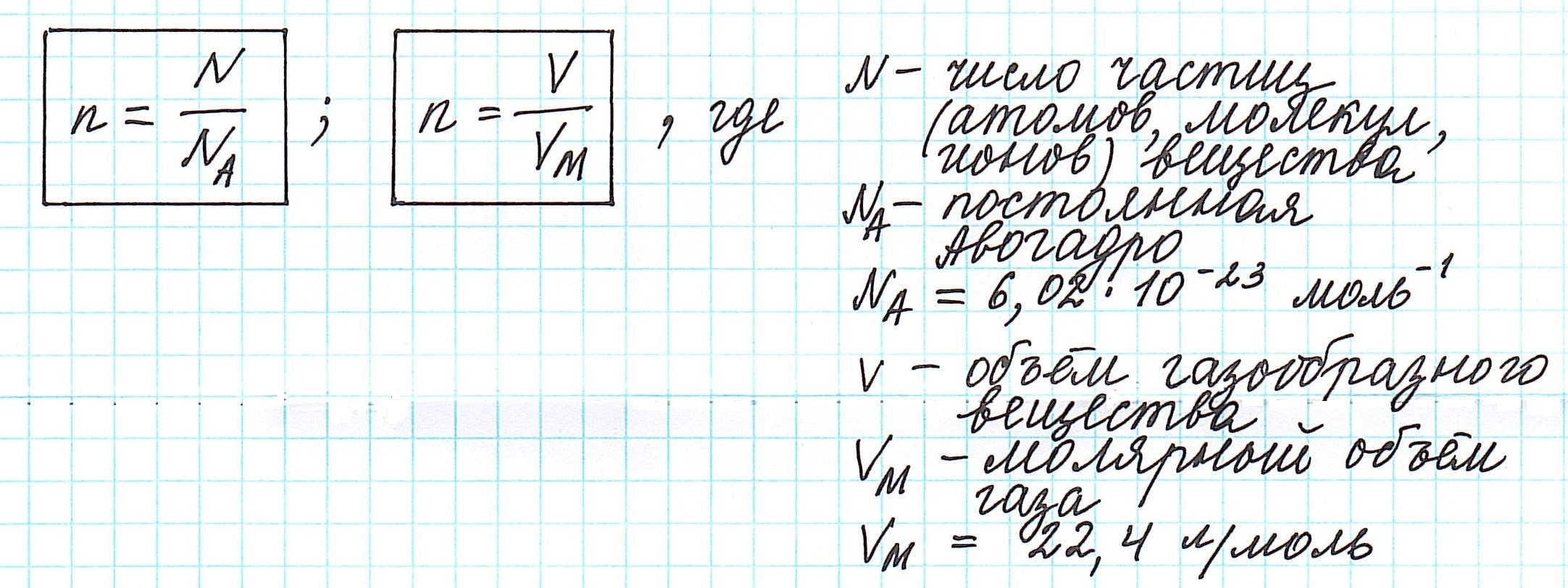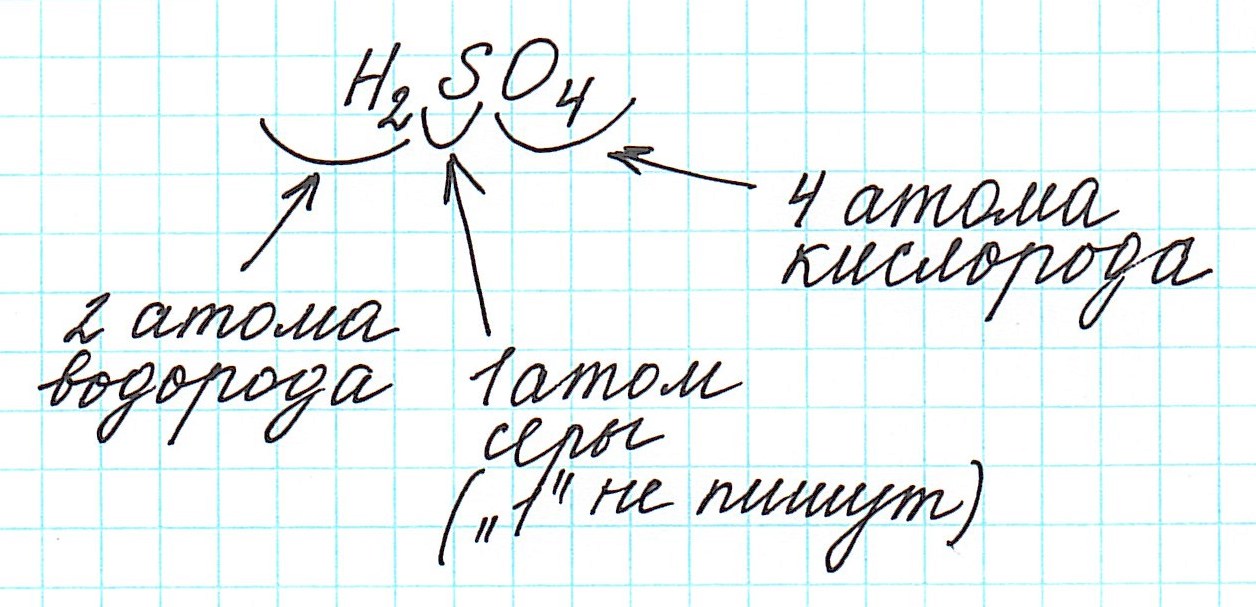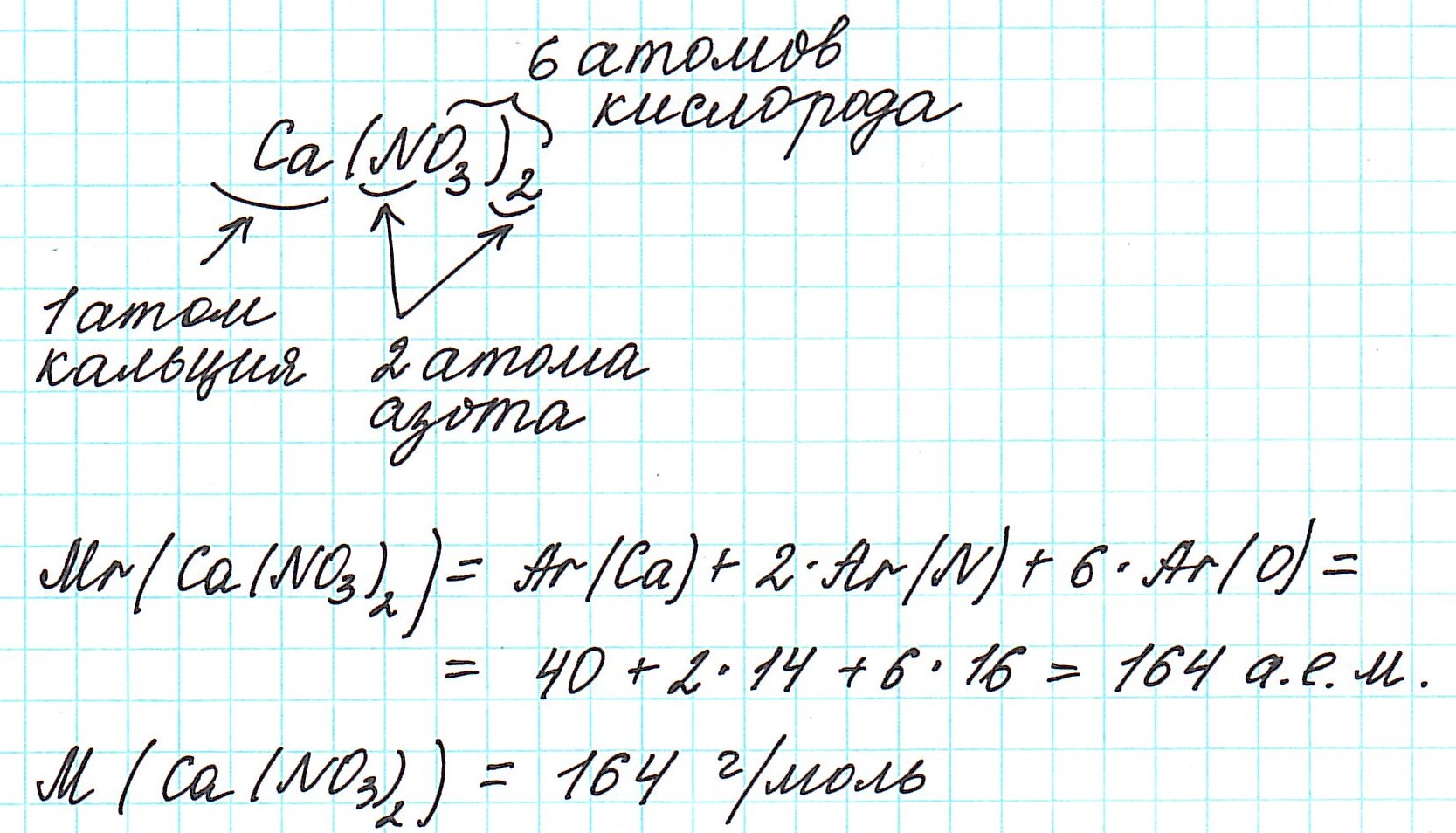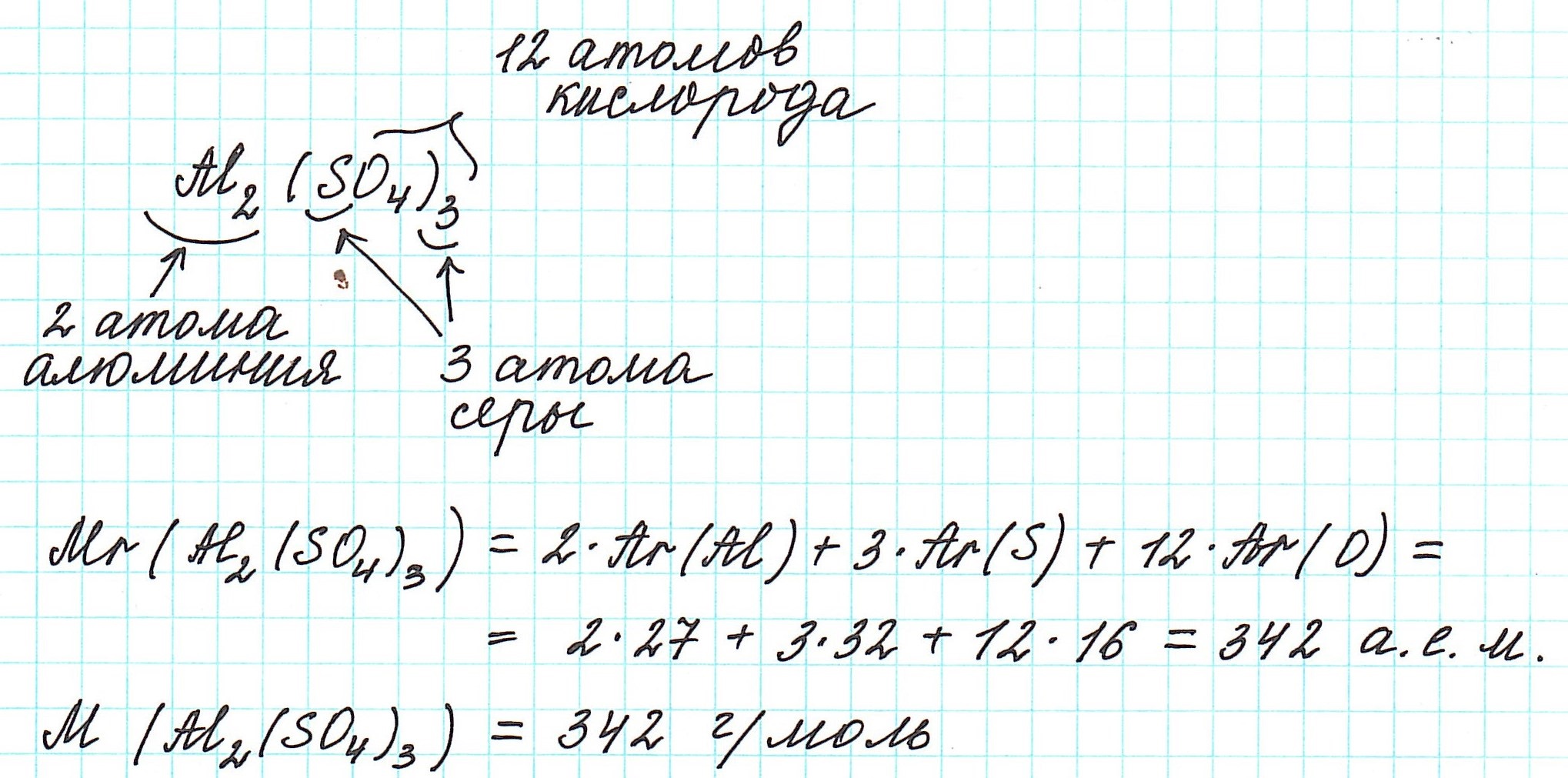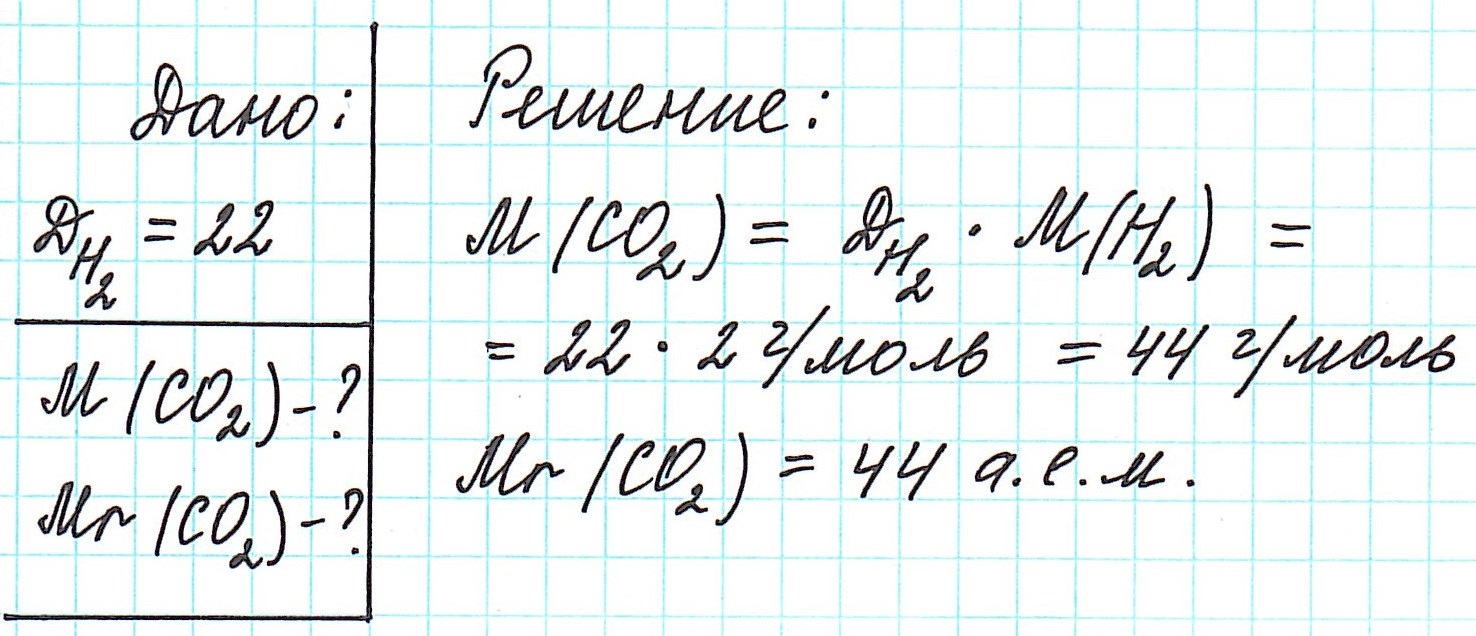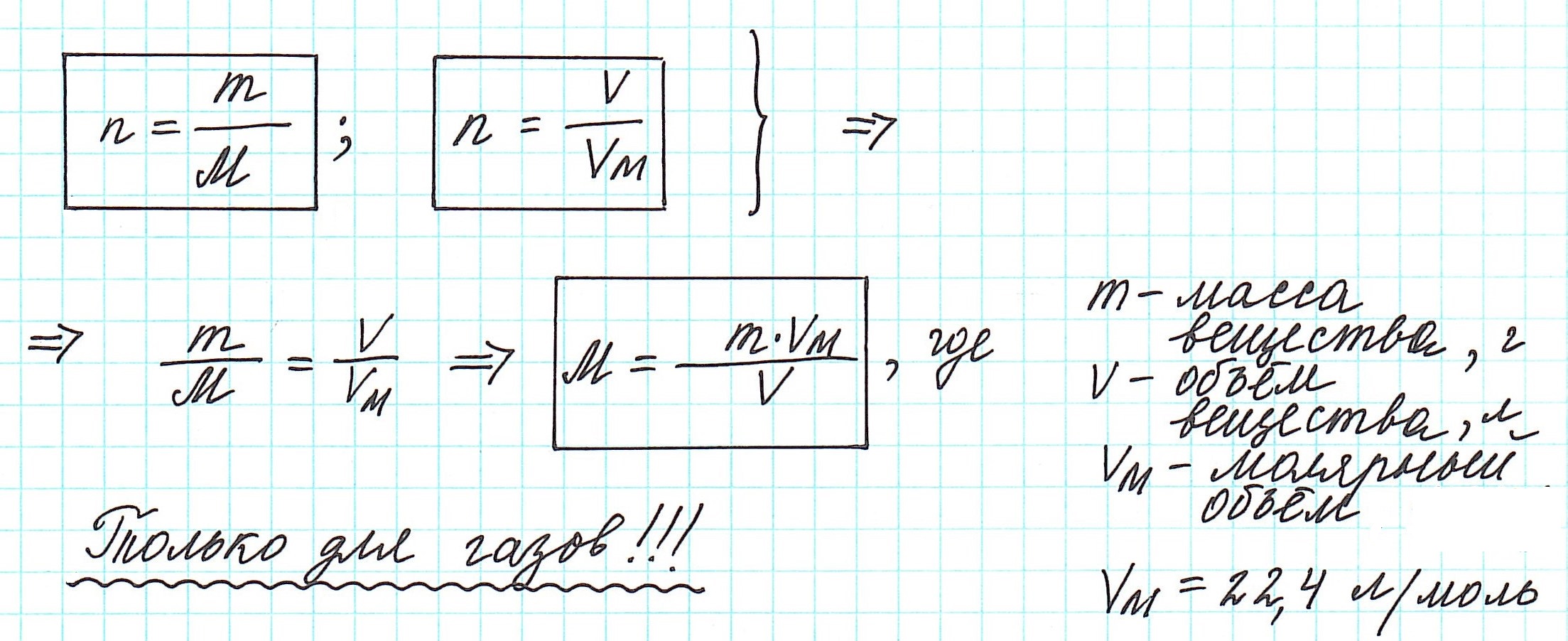В чем выражается относительная молекулярная масса
Относительная молекулярная масса – формула, примеры, таблица (химия, 8 класс)
Для химиков важно знать массы молекул исследуемых ими веществ. Измерять их в килограммах неудобно, поэтому ученые используют а. е. м. – атомные единицы массы.
Понятие атомной единицы массы
На сегодняшний день принята договоренность, что масса атома углерода (а точнее его изотопа углерод-12) в точности равна 12 а. е. м. По этой причине используемую химиками величину иногда называют углеродной единицей. Ранее ученые использовали другие единицы – водородную и кислородную, но они по ряду причин оказались неудобными. Опыты показывают, что 1 а. е. м. равна примерно 1,66•10 –27 кг.
Атомная масса показывает, какую массу имеет тот или иной атом. Найти ее можно в таблице Менделеева. Обычно в этой таблице масса записана как дробное число, очень близкое к какому-либо целому значению. Например, атомная масса водорода составляет 1,000797 а. е. м., у гелия она равна 4,0026 а. е. м., а у кислорода 15,9994 а. е. м. При решении практических задач принято округлять эти значения до целых чисел. То есть надо считать, что у водорода атомная масса равна 1 а. е. м, у гелия – 4 а. е. м., у кислорода – 16 а. е. м. Исключением является хлор, чью массу округляют до значения 35,5 а. е. м.
Важно понимать, что на самом деле у одного и того же элемента атомы могут иметь различную массу. Такие отличающиеся по массе атомы называются изотопами. У изотопов одного элемента одинаковое количество протонов, но различное количество нейтронов. При этом все изотопы одного элемента имеют одинаковые химические свойства.
В таблице Менделеева указан средний вес всех изотопов, при этом учитывается их распространенность в природе. Например, у кислорода есть три стабильных изотопа:
С учетом этого атомная масса кислорода, указанная в таблице Менделеева, рассчитывается так:
(15,9949•99,759 + 16,9991•0,037 + 17,9991•0,204)/100 = 15,9994 а. е. м.
Молекулярная масса
Зная атомные массы отдельных элементов, можно находить и молекулярные массы молекул. Для этого надо всего лишь сложить атомные массы тех атомов, которые входят в состав молекулы.
Например, рассмотрим молекулу метана, она имеет формулу СН4, то есть состоит из 1 атома углерода (который весит 12 а. е. м.) и 4 атомов водорода (каждый массой по 1 а. е. м.). Складываем атомные массы:
12 + 1 + 1 + 1 + 1 = 12 + 4•1 = 16 а. е. м.
Итак, молекула метана имеет молекулярную массу 16 а. е. м.
Заметим, что очень часто возникает путаница из-за молекул простых газов – водорода, кислорода, азота и т. д. Дело в том, что их молекулы состоят из двух атомов, поэтому и масса у них вдвое больше, чем масса атомов. Например, атомная масса элемента кислород – 16 а. е. м., а вот молекула кислорода, имеющая формулу О2, весит уже 16•2 = 32 а. е. м.
Молярная масса
Молекулярные массы веществ тесно связаны с понятием молярной массы. Молярная масса – это масса 1 моля вещества. Численно она совпадает с молекулярной массой, но измеряется в других величинах – в граммах на моль, или в г/моль.
Молярная масса позволяет определять, легче или тяжелее воздуха тот или иной газ. Для этого надо лишь сравнить молярную массу газа с молярной массой воздуха, составляющей 28,98 г/моль. Так, кислород оказывается тяжелее воздуха, так как его молярная масса – 32 г/моль. Азот же легче воздуха, ведь его масса равна 28 г/моль. Здесь следует уточнить, что воздух не является отдельным веществом в химическом смысле слова, то есть никаких «молекул воздуха» не существует (поэтому не существует и понятия «молекулярная масса воздуха»). В реальности воздух – это смесь нескольких газов, преимущественно азота и кислорода. При этом более тяжелые молекулы чаще встречаются в нижних слоях атмосферы, а легкие молекулы – на высоте. По этой причине (но отнюдь не только из-за нее) в горах тяжело дышать – на большой высоте воздух содержит меньше кислорода и больше азота.
Подведение итогов
Молекулярная масса показывает, какую массу имеет та или иная молекула. Для ее вычисления достаточно сложить массы входящих в молекулу атомов. Молекулярная масса численно равна молярной массе, и по ней можно оценить, какой газ легче воздуха, а какой – тяжелее.
Относительная молекулярная масса

Всего получено оценок: 561.
Всего получено оценок: 561.
В химии чрезвычайно важным является понятие «молекулярная масса». Молекулярную массу часто путают с молярной массой. Чем отличаются эти величины, и какими свойствами обладают?
Молекулярная масса
Атомы и молекулы – мельчайшие частицы любых химических вещества. Если постараться выразить их массу в граммах, то получится число, в котором перед запятой будет находиться около 20 нулей. Поэтому измерять массу в таких единицах, как граммы, неудобно. Чтобы выйти из этой ситуации, следует какую-нибудь очень малую массу принять за единицу, а все остальные массы выражать по отношению к ней. В качестве этой единицы используют 1/12 массы атома углерода.
Относительна молекулярная масса – это масса молекулы вещества, которую измеряют в атомных единицах массы. Молекулярная масса равна отношению массы молекулы того или иного вещества к 1/12 части массы атома углерода. Она показывает, во сколько раз масса молекулы определенного вещества больше 1/12 массы атома углерода.
Молекулярную массу часто путают с молярной массой, единицей измерения которой является г/моль. И действительно численно эти две величины абсолютно идентичны, однако размерность у них абсолютно разная.
Относительную молекулярную массу можно найти, сложив между собой атомные массы
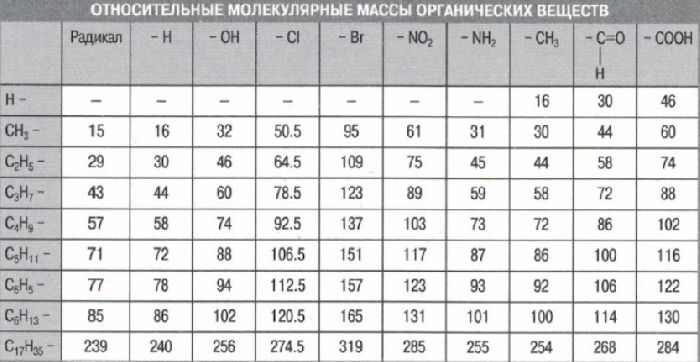
Чтобы вычислить молекулярную массу простых и сложных веществ, необходимо найти сумму относительных атомных масс атомов, входящих в состав молекулы. Например, относительная молекулярная масса воды Mr (H2O), которая состоит, как известно, из двух атомов водорода и одного атома кислорода, равна 1*2+16=18.

Атомная масса
Атомная масса химического элемента – также одно из важнейших обозначений в химии. Атомная масса – это средняя величина из атомных масс устойчивых природных изотопов этого элемента с учетом их относительного содержания в природе (их природного распространения). Так, в природе существуют два устойчивых изотопа элемента хлора Cl с массовыми числами 35 и 37:
Ar(Cl)=(34.97*0.7553)+(36.95*0.2447)=35.45 – именно такая величина принята для элемента хлора в качестве его относительной атомной массы.
Впервые вычисление атомных весов были сделаны Д. Дальтоном. Атомные веса элементов он относил к атомному весу водорода, приняв его за единицу. Однако вычисленные в соответствии с его принципом «наибольшей простоты» вес атома кислорода и некоторых других элементов оказались неверными.

Что мы узнали?
В школьной программе по химии (8 класс) большое внимание уделяется таким понятием, как относительная атомная и молекулярная масса вещества. Учащиеся изучают их отличия и особенности, а также учатся определять массы газов и веществ.
МОЛЯРНАЯ МАССА И ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА: В ЧЕМ ОТЛИЧИЕ И ПОЧЕМУ ОНИ ЧИСЛЕННО РАВНЫ
Как вычислить молярную массу вещества? В каких единицах она измеряется?
А еще есть относительная молекулярная масса. Почему она относительная и численно равна молярной массе? Может быть это одно и то же?
Вот сколько вопросов возникает сразу в отношении такого простого на первый взгляд понятия, как молярная масса.
Разберемся по порядку и научимся ее определять.
Относительная атомная масса
Огромнейший вклад в развитие и обоснование понятия относительная атомная масса внесли в разное время французский ученый Гей-Люссак, итальянский ученый А.Авогадро и шведский ученый Й.Я. Берцелиус.
Не углубляясь в историю вопроса, вспомним, что любой химический элемент представляет собой определенную разновидность атомов. Сегодня мы знаем, что атомы химических элементов имеют свои особые характеристики.
И самая главная из них, определяющая практически все остальные, это заряд ядра. А так как заряд ядра обусловлен присутствием в нем протонов, а заряд одного протона равен +1, то и количество протонов, соответственно, также является важнейшей характеристикой атомов химических элементов.
Основную массу атома составляет ядро, которое кроме протонов содержит еще и нейтроны. Масса последних сопоставима с массой первых. Оболочку атома составляют электроны.
По числу частиц в атоме, а точнее, по их суммарной массе, атомы химических элементов можно условно разделить на тяжелые и легкие. Например, легким элементом является водород, так как его атомы имеют самую маленькую массу. А свинец — это уже тяжелый элемент. Масса его атома в 302 раза тяжелее массы атома водорода.
Но тем не менее, как бы мы не делили все атомы на тяжелые или легкие, абсолютная масса (mA) каждого из них ничтожно мала, как мала и масса составляющих их частиц. Например,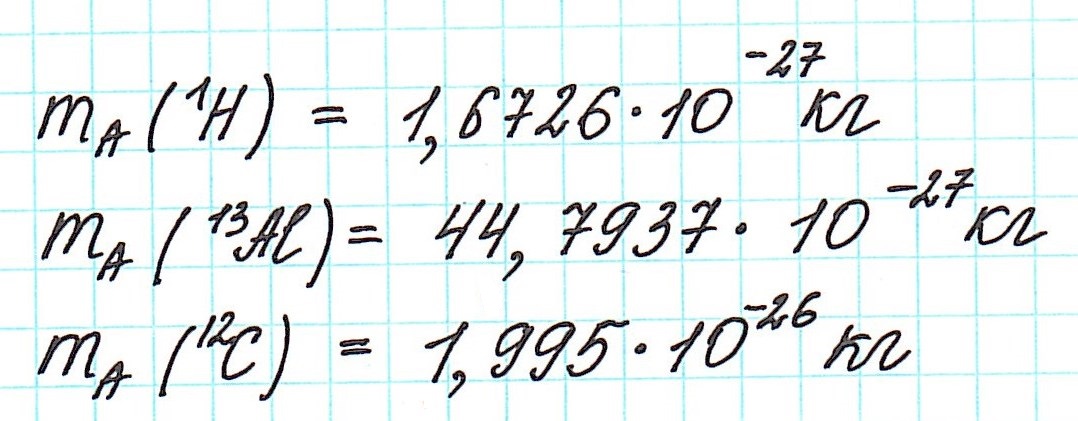
Величина, с которой сравнивают массу атома
Первоначально еще Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого. Позднее появилась так называемая кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что большинство атомов химических элементов образуют соединения с кислородом.
Однако, с развитием атомной физики и эта единица стала крайне неудобной. Все потому, что кислород в природе имеет несколько изотопов (а именно 3 устойчивых, всего же их 16). А изотопы, как известно, отличаются своей атомной массой. Из-за большого разнообразия изотопов и их различной устойчивости кислородная единица утратила свою актуальность.
Почему именно углерод? Да потому, что:
— у углерода всего 2 изотопа: 12 С и 13 С; причем первого 98,9%;
— количество органических веществ (их основу составляет, как известно, именно углерод) в сотни раз больше, чем неорганических;
— при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные массы всех элементов изменились не существенно, что оказалось очень удобным.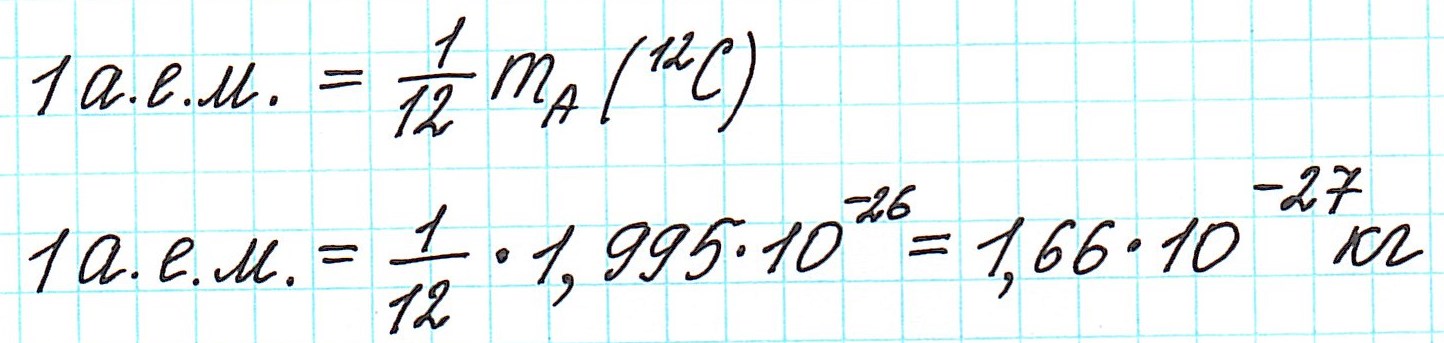
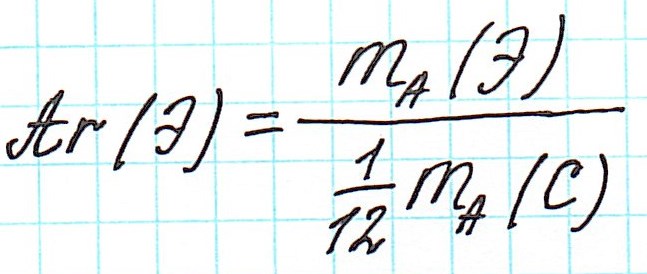
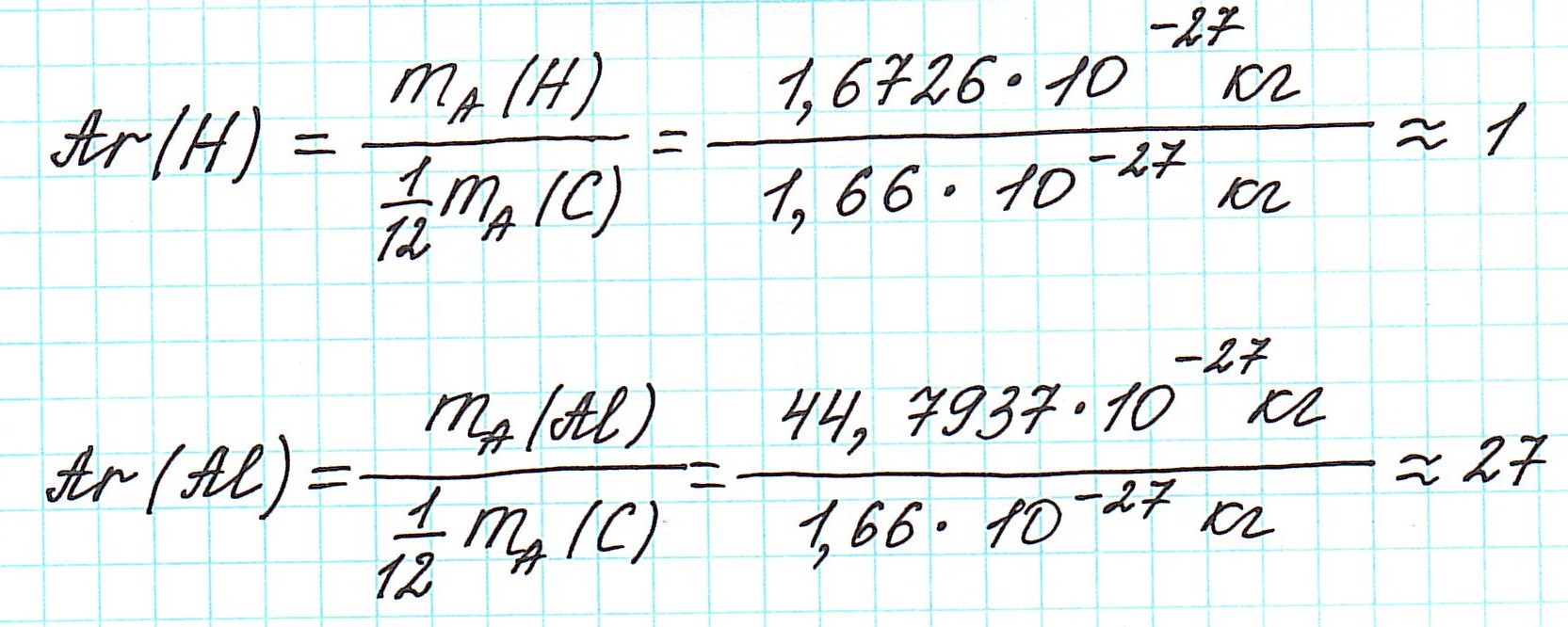
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.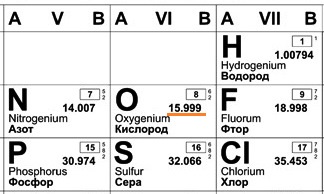
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16 О, на 0,04% из изотопа 17 О и на 0,20% из изотопа 18 О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Относительная молекулярная масса
А как же найти относительную молекулярную массу?
Дело в том, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2SO4, глюкоза C6H12O6 и т.д. И к ним в полной мере можно применить термин «относительная молекулярная масса».
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их относительных атомных масс. Например: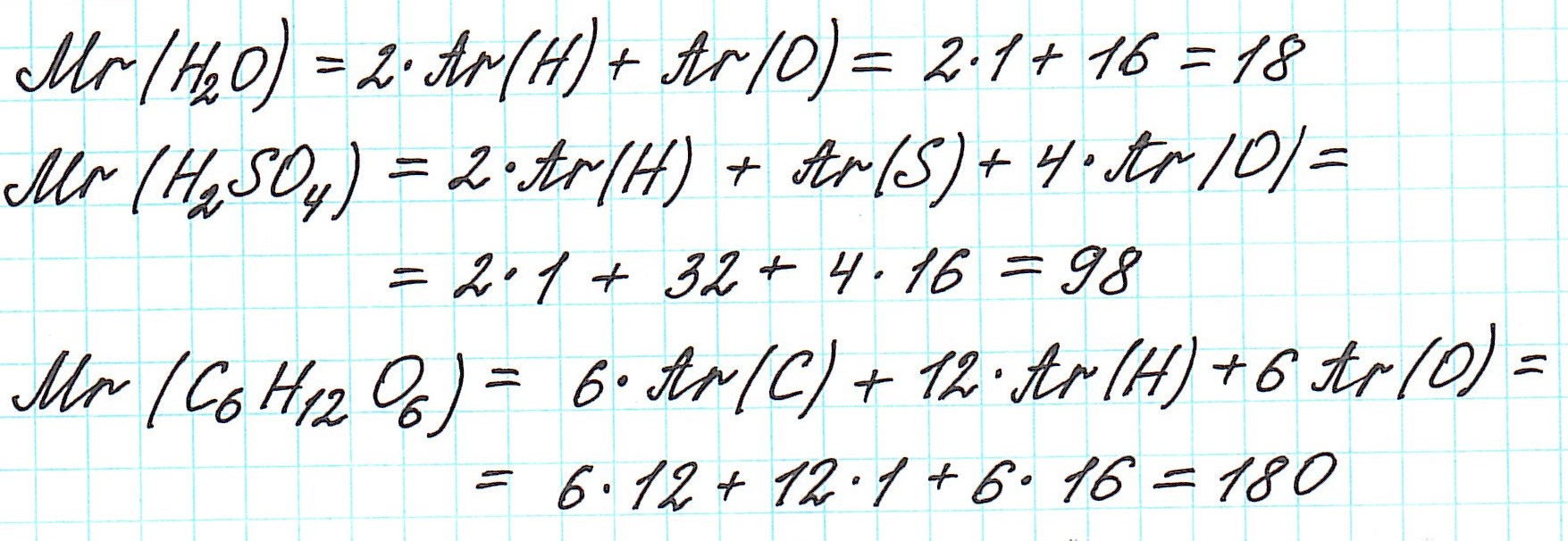
Точно так же, как относительную атомную массу (Ar), относительную молекулярную массу (Mr) будем сопоставлять с 1/12 частью атома изотопа углерода 12 С.
В последующем говорим о Mr.
Количество вещества и молярная масса
В практических расчетах все-таки требуется вычислять массы, взятые в граммах, килограммах ато и в тоннах (если речь идет о каком-то производстве, например).
Как же поступают тогда?
Количество вещества, которое содержит столько же частиц (атомов, ионов, молекул – в зависимости от строения), что и 12 г изотопа углерода 12 С, назвали молем.
Один моль вещества (любого!) всегда содержит 6,02·10 23 его частиц ( постоянная Авогадро ).
Ну, а так как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе.
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль.
Таким образом, молярная масса и количество вещества связаны соотношением:
Можно также определить и такие отношения, связанные с количеством вещества:
Почему же относительная молекулярная и молярная массы равны?
Итак, относительная молекулярная и молярная массы, как следует из их определений – это не одно и то же.
Докажем, каким образом обе массы численно могут быть равны:
Как вычислить молярную массу вещества
Мы уже знаем, что относительная молекулярная масса складывается из относительных атомных масс.
При нахождении относительной молекулярной массы (Mr), а значит и молярной (М), выполняем следующие действия :
1) правильно записываем формулу вещества;
2) анализируем качественный состав (атомы каких элементов составляют вещество) и количественный состав (в каких количествах находятся эти атомы – смотрим по индексам, которые стоят справа внизу от знака химического элемента);
3) в периодической системе химических элементов находим элементы, атомы которых составляют вещество, и округляем относительную атомную массу, стоящую рядом со знаком элемента, до целого числа (! у хлора – до 35,5);
4) складываем относительные атомные массы всех элементов с учетом количества атомов.
Рассмотрим еще примеры:
Как вычислить молярную массу вещества, находящегося в газообразном состоянии
Это означает, что в данных условиях отношение масс газов друг к другу является отношением их молярных масс:


Вычислить молярную массу вещества (а, значит, и относительную молекулярную), находящегося в газообразном состоянии, можно, используя молярный объем газа (VM):
Итак, подведем итог:
Без вычисления молярной массы не обходится решение практически ни одной задачи. Если вы поняли, что такое молярная и относительная молекулярная массы и как их вычислять, но еще не умеете решать задачи с их применением, то самое время научиться.
Разбор простых типовых задач по химии в книге, которую вы можете совершенно БЕСПЛАТНО скачать здесь.
Массовая доля
Что такое массовая доля
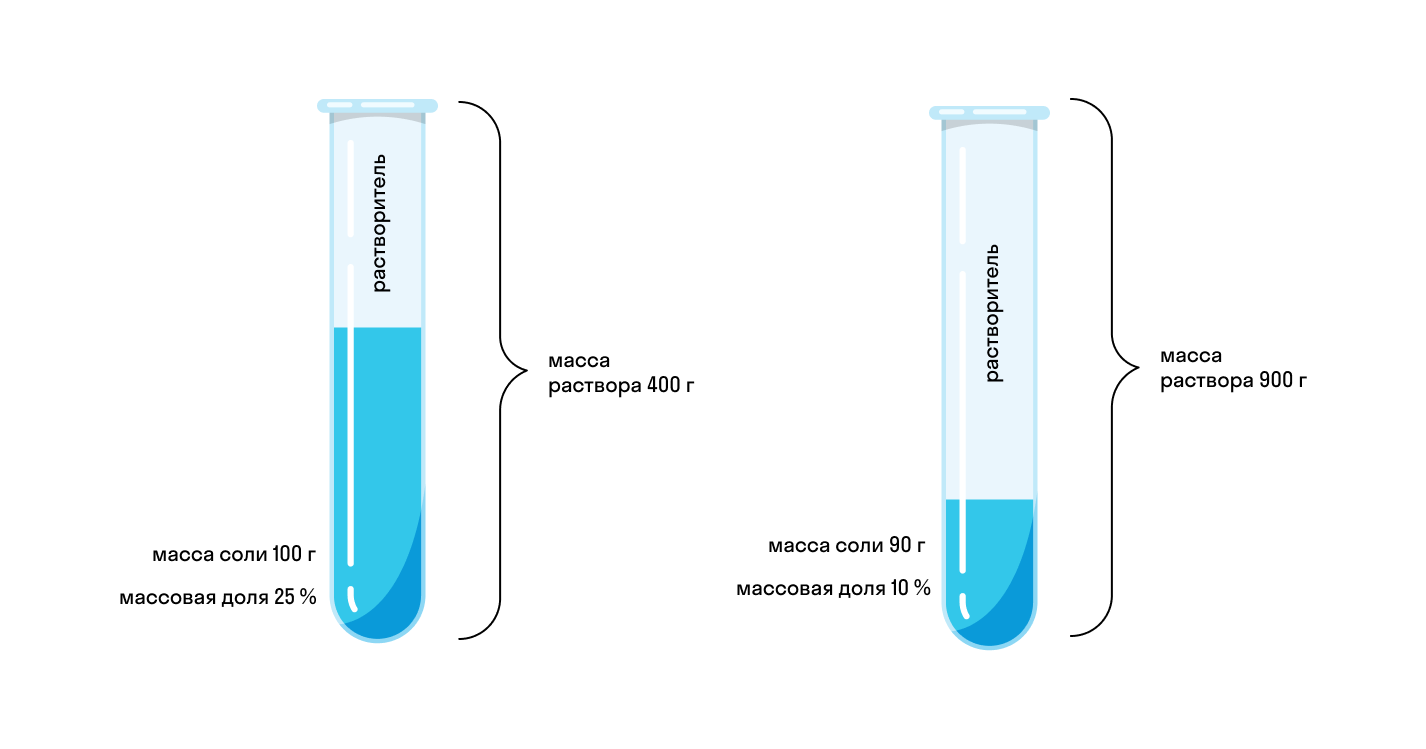
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
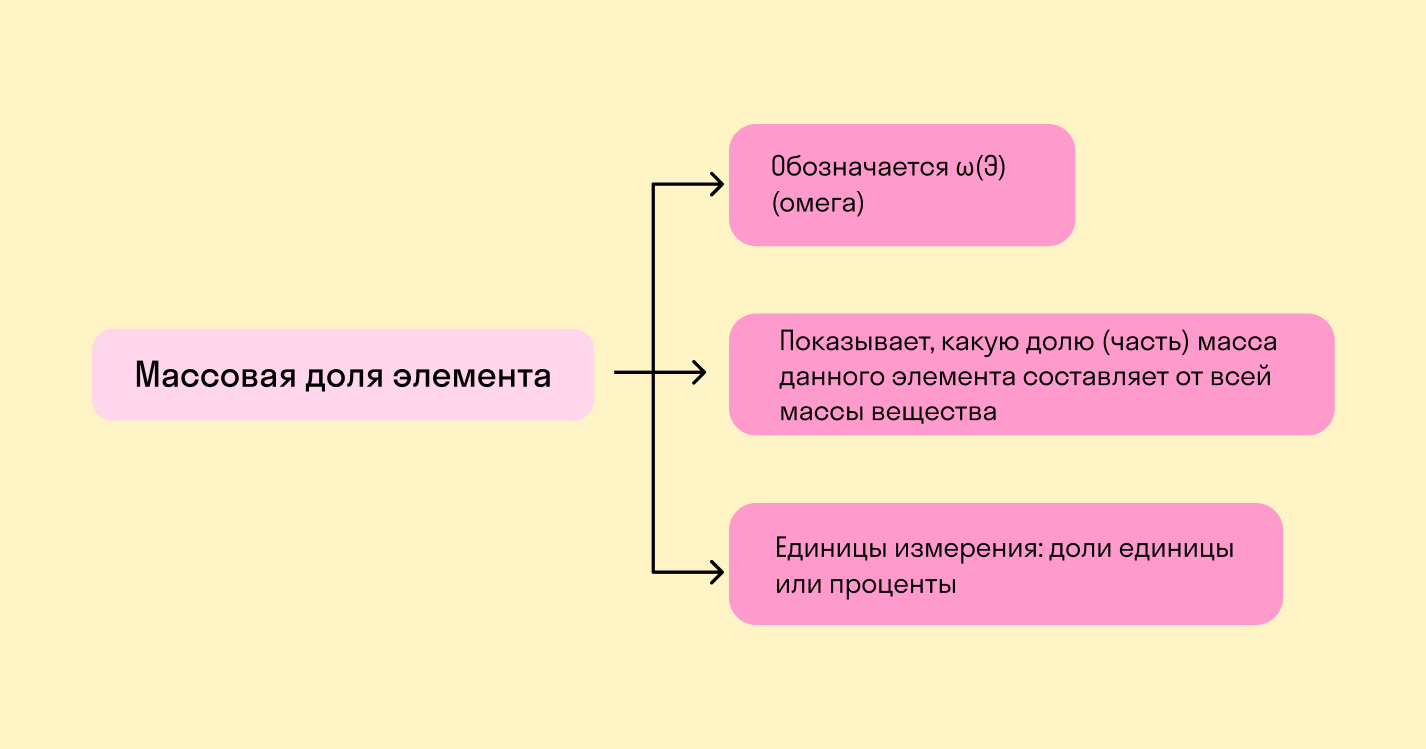
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где — обозначение массовой доли;
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
— количество атомов искомого элемента;
— относительная атомная масса элемента;
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
Решение:
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Решение:
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
Как обозначается массовая доля и в чем она выражается?
В чем разница между молекулярной массой вещества и его молярной массой?
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
Как рассчитать массовую долю вещества в растворе?
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?