Ассоциированные заболевания это что такое
АНЦА-ассоциированные интерстициальные заболевания легких: актуальные вопросы диагностики и лечения
В течение последних лет появляются данные о связи интерстициальных заболеваний легких (ИЗЛ) и АНЦА-ассоциированных васкулитов (ААВ), особенно у пациентов с микроскопическим полиангиитом с наличием антител к миелопероксидазе (МПО-АНЦА). В части случаев ИЗЛ является единственным или ведущим проявлением заболевания, определяющим объем терапии и прогноз жизни больного с ААВ. В статье обсуждаются современные концепции патогенеза, подходы к диагностике и лечению АНЦА-ассоциированных ИЗЛ, а также дальнейшие направления изучения данной аутоиммунной патологии.
Интерстициальные заболевания легких (ИЗЛ) характеризуются развитием про грессирующего диффузного воспалительного и/или фиброзирующего поражения легких и сходными клиникорентгенологическими проявлениями и гистологической картиной. В соответствии с классификацией, принятой Американским торакальным и Европейским респираторным обществами в 2013 г., к ИЗЛ относят более 200 заболеваний, как с установленной этиологией, так и идиопатических [1].
Антинейтрофильные цитоплазматические антитела (АНЦА) являются серологическим маркером АНЦА-ассоциированных васкулитов (ААВ), в том числе микроскопического полиангиита (МПА), гранулематоза с полиангиитом (ГПА) и эозинофильного гранулематоза с полиангиитом (ЭГПА) [2]. Поражение легких – одно из частых проявлений ААВ [3]: у 85-90% пациентов ГПА 4 и 25-55% с МПА 8 имеются отклонения при компьютерной томографии органов грудной клетки (КТ). При ЭГПА клинически значимые изменения в легких (за исключением бронхиальной астмы) встречаются реже [10]. Наиболее клинически значимыми вариантами поражения легких при ААВ, ассоциированными с неблагоприятным исходом, можно считать диффузное альвеолярное кровотечение (ДАК) и узловые образования различных размеров, в том числе с зонами распада [11].
В течение нескольких лет появляются данные о связи ИЗЛ и ААВ, особенно ассоциированным с антителами к миелопероксидазе (МПО-АНЦА) [11]. В части случаев при ААВ наблюдается изолированное поражение легких; кроме того, у небольшой части пациентов с идиопатическими интерстициальными пневмониями наличие АНЦА (чаще МПО-АНЦА, чем антитела к протеиназе-3 (ПР3-АНЦА)) не сопровождается симптомами системного васкулита или предшествует его развитию [12].
В настоящее время имеется ограниченное количество информации относительно подходов к диагностике и лечению АНЦА-ассоциированных интерстициальных заболеваний легких (АНЦА-ИЗЛ), что объясняется их относительной редкостью [12]. В то же время, наличие интерстициального поражения легких при ААВ может негативно влиять на прогноз заболевания и повышать риск летального исхода, что подчеркивает необходимость поиска его оптимального лечения. В статье представлен современный взгляд на классификацию АНЦА-ИЗЛ, а также обсуждаются вопросы патогенеза, диагностики, лечения и направления дальнейшего изучения данной патологии.
Эпидемиология и классификация
ИЗЛ встречаются чаще у пациентов с МПА (до 45%) и реже у пациентов с ГПА (менее 5%); при ЭГПА описаны лишь единичные случаи развития интерстициального поражения легких [13,14]. При АНЦА-ИЗЛ отмечается значительное преобладание МПО-АНЦА (46-71%) по сравнению с ПР3АНЦА (0-29%) [13,15-20].
Распространенность ИЗЛ при ААВ зависит от географического региона: в Европе она составляет 2-3%, что существенно ниже по сравнению со странами Азии (2839%) [21,22]. Это может быть отчасти связано с большей частотой выявления МПО-АНЦА в азиатской популяции [11].
Возрастная структура АНЦА-ИЗЛ несколько отличается от таковой в общей группе ААВ. АНЦА-ИЗЛ, как правило, развиваются у пациентов старше 65 лет, хотя единичные случаи описаны даже у детей [11]. В ряде исследований средний возраст на момент диагностики МПА-ассоциированного ИЗЛ (МПА-ИЗЛ) превышал таковой для общей когорты пациентов с МПА (66 и 55 лет, соответственно) и был сопоставим с возрастом пациентов в дебюте идиопатического легочного фиброза (ИЛФ) [7,8]. В нескольких сериях клинических случаев МПА-ИЗЛ наблюдалось незначительное преобладание мужчин (60-65%), однако это отмечалось не во всех наблюдениях [15,23]. Многофакторный анализ в одном из исследований, включавших 62 пациента с ААВ-ИЗЛ, показал, что мужской пол и возраст старше 65 лет были независимыми предикторами развития легочного поражения [24].
Среди АНЦА-ИЗЛ можно выделить три основные группы. Первая включает пациентов с развернутой клинической картиной МПА, развившейся до поражения легких (8-21%); во вторую входят пациенты с ИЗЛ, дебютировавшим одновременно с системным васкулитом (36-67%); третья объединяет АНЦА-позитивных пациентов с ИЗЛ без признаков поражения других органов (14-85%) [11,17,25]. Последний клинический сценарий представляет особый диагностический интерес в связи с возможностью развития в последующем ААВ в срок от нескольких месяцев до 12 лет [11]. В одном исследовании на момент установления диагноза ИЛФ у 4,0% из 504 пациентов определялись МПОАНЦА, у 3,2% – ПР3-АНЦА. В течение последующих 5 лет сероконверсия произошла еще у 11% исходно АНЦА-негативных пациентов, а у одной четверти больных с МПО-АНЦА развился МПА [25]. Наличие других типов аутоантител, в частности ревматоидного фактора (РФ), повышение СОЭ >40 мм/ч, эозинофилия лаважной жидкости и большой объем поражения легочной ткани по данным КТ служили прогностическими факторами АНЦА-сероконверсии [26].
Патогенез
К настоящему времени предложены несколько потенциальных механизмов развития АНЦА-ИЗЛ. Согласно одной из гипотез, формирование интерстициального легочного фиброза при ААВ может быть следствием рецидивирующих эпизодов ДАК [27]. В пользу данной концепции свидетельствует наличие гистологических признаков острого и/или хронического кровотечения более чем у половины пациентов с АНЦА-ИЗЛ [28]. Важно отметить, что у большинства из них отсутствуют анамнестические данные о ДАК, что указывает на вероятное развитие субклинических эпизодов кровотечений [28,29]. Еще одним подтверждением данной гипотезы являются обнаружение в ткани легких значительного количества сидерофагов – гистологических маркеров хронического альвеолярного кровотечения – у пациентов с АНЦА-ИЗЛ и отсутствие данного признака у пациентов с ИЗЛ в рамках других системных аутоиммунных заболеваний, таких как воспалительные миопатии и системная склеродермия [30].
Согласно второй гипотезе, МПО-АНЦА (но не ПР3АНЦА) могут сами по себе играть роль в патогенезе ИЗЛ [31]. В одном исследовании было показано, что активация нейтрофилов антителами к МПО приводила к выработке большого количества окислительных соединений. К ним, в частности, относится гипохлорит-анион, способный стимулировать пролиферацию фибробластов in vitro. Кроме того, МПО-АНЦА могут способствовать повреждению легочной ткани путем локального высвобождения протеолитических ферментов активированными нейтрофилами. Некоторые из этих ферментов, в частности эластаза, могут вызывать развитие легочного фиброза в опытах на животных [32].
Повреждение, вызванное внеклеточными нейтрофильными ловушками, выделяющимися АНЦА-активированными нейтрофилами при их гибели путем нетоза, также может также вносить вклад в легочный патологический процесс. Внеклеточные нейтрофильные ловушки обладают способностью активировать легочные фибробласты и стимулировать их дифференцировку в миофибробласты – один из основных типов клеток, активно вовлеченных в развитие интерстициального легочного фиброза [33].
Еще одна концепция патогенеза АНЦА-ИЗЛ согласуется с фактом развития ИЗЛ до дебюта ААВ и основывается на том, что наличие ИЗЛ само по себе предрасполагает к появления МПО-АНЦА [24]. У пациентов с ИЛФ в лаважной жидкости в большинстве случаев увеличено количество нейтрофилов [34]. При активации нейтрофилы начинают экспрессировать МПО на своей плазматической мембране, что при наличии тканевого воспаления может запускать развитие аутоиммунной реакции и приводить к секреции МПО-АНЦА, а затем и развитию ААВ. В пользу данной гипотезы свидетельствуют появление МПО-АНЦА и развитие МПА у части пациентов с ИЛФ. В этой связи представляет интерес тот факт, что при ААВ, как и при ИЛФ, одним из факторов риска развития ИЗЛ является курение (частота его составила 59% и 23% у пациентов с МПА, у которых отмечалось и отсутствовало ИЗЛ, соответственно) [25].
В то же время, несмотря на ряд сходств, некоторые механизмы развития ИЛФ не играют значимой роли в патогенезе поражения легких при ААВ. В частности, ключевая роль апоптоза альвеолярных эпителиоцитов вследствие длительного воздействия повреждающих факторов, а также эпителиально-мезенхимального перехода не была подтверждена при АНЦА-ассоциированном интерстициальном легочном фиброзе. И наоборот, роль нейтрофилов и системы комплемента в развитии ИЛФ представляется незначительной по сравнению с таковой при АНЦА-ИЗЛ [35].
Клиническаякартина
Основными симптомами у пациентов с АНЦА-ИЗЛ является одышка (50-73%) и малопродуктивный кашель (21-60%) [36,37]. Кровохарканье (5%) и конституциональные проявления, такие как лихорадка (31%) и снижение массы тела (5%), наблюдаются реже [36]. В ранее опубликованных исследованиях не было выявлено достоверной корреляции между титром АНЦА и тяжестью ИЗЛ [36]. В ряде наблюдений клинические проявления у пациентов с фиброзирующими ИЗЛ и наличием АНЦА не отличались от таковых при ИЛФ [36,37].
В то же время, у пациентов с МПА-ИЗЛ в дебюте обычно преобладают конституциональные симптомы (около 80% случаев) – недомогание (31-63%), лихорадка (52-90%) и снижение массы тела (52-58%), а также внелегочные проявления основного заболевания (70100%) [38,39]. Легочные симптомы включают в себя прогрессирующую одышку (30-100%), кровохарканье (21-49%) и кашель (23-84%) [29,38,39]. Следует отметить, что у пациентов с МПА-ИЗЛ реже выявляют признаки системного воспаления, что выражается в более низком уровне СОЭ, более высоком уровне гемоглобина, и, что важно, в меньшей частоте таких проявлений васкулита, как ДАК, поражение периферической нервной системы и почек [29,40].
Диагностика
Повышение уровня СОЭ и содержания С-реактивного белка (СРБ) в дебюте заболевания у пациентов с МПАИЗЛ отмечается в 95% и 73-79% случаев, соответственно [17]. Более чем у 60% из них выявляют также изменения в общем анализе мочи [25]. В то же время, значительное повышение уровня воспалительных маркеров редко встречается при изолированном АНЦАИЗЛ. При сравнении данной группы с ИЛФ в большинстве исследований различий по уровню СРБ не обнаружено [36,37]. При исследовании сывороточных маркеров легочного повреждения у пациентов с ААВ повышение уровня Krebs von der Lungen (KL)-6 ассоциировалось с наличием ИЗЛ [41]. При ААВ-ИЗЛ отмечается четкая корреляция между наличием МПО-АНЦА и ИЗЛ; у пациентов с ПР3-АНЦА развитие ИЗЛ наблюдается значительно реже [24]. Кроме того при наличии ПР3-АНЦА у пациентов с ИЛФ ни в одном случае не было отмечено развития ААВ [25].
При АНЦА-ИЗЛ чаще всего развиваются вентиляционные нарушения рестриктивного типа – снижение форсированной жизненной емкости легких (ФЖЕЛ) и диффузионной способности легких (DLCO), хотя примерно в трети случаев наблюдается умеренная бронхообструкция [15,36,38]. В динамике отмечается тенденция к дальнейшему снижению вентиляционных параметров по мере прогрессирования ИЗЛ. В одном исследовании у больных с ААВ-ИЗЛ в течение 5 лет отмечалось снижение жизненной емкости легких и (ЖЕЛ) и DLCO на 23% и 46%, соответственно, по сравнению с исходными значениями [42].
При исследовании бронхоальвеолярной лаважной жидкости (БАЛЖ) у пациентов с АНЦА-ИЗЛ выявляют нейтрофилию (40-87%), реже – лимфоцитоз и эозинофилию (20% и 26%, соответственно) [15,36]. Признаки острого или хронического альвеолярного кровотечения обнаруживают в половине случаев [15]. По данным ряда авторов, при АНЦА-ИЗЛ количество нейтрофилов и эозинофилов в БАЛЖ было выше, чем при ИЛФ, однако эти результаты подтверждаются не всеми исследованиями [15,37,43].
Основными изменениями на КТ, ассоциированными с ААВ, являются уплотнение по типу «матового стекла» (23-100%), ретикулярные изменения (41-77%), утолщение междолькового интерстиция (41-71%), зоны консолидации (0-78%) и «сотового легкого» (23-100%). Реже выявляют узловые образования в паренхиме (0-45%) и кисты (27%) [22,39,42]. Может наблюдаться поражение дыхательных путей в форме бронхиолита (55%), утолщения стенок бронхов (44%) и бронхоэктазов (32100%). У большинства пациентов (50-100%) изменения в легких носят симметричный характер [38,42,44].
Согласно международным классификационным критериям идиопатических интерстициальных пневмоний, наиболее частым КТ-паттерном ААВ-ИЗЛ, как при наличии МПО-АНЦА, так и ПР3-АНЦА, является обычная интерстициальная пневмония (ОИП; 38-63%), характеризующаяся ретикулярными изменениями, преимущественно в задних и нижних отделах легких, в сочетании с формированием зон «сотового легкого» и уменьшением объема нижних долей. Несколько реже отмечается неспецифическая интерстициальная пневмония (НСИП; 7-31%) и десквамативная интерстициальная пневмония (14%) (рис. 1). У части пациентов (преимущественно курящих мужчин) описано развитие интерстициального фиброза в сочетании с эмфиземой легких (до 21%) [6,38,39].
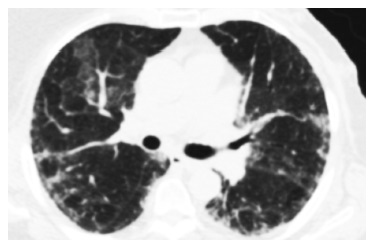
Следует отметить, что в 4-40% случаев изменения в легких при АНЦА-ИЗЛ не соответствуют какому-либо конкретному паттерну интерстициальной пневмонии [36]. В спорных случаях для определения показаний к иммуносупрессивной терапии и ее объема требуется гистологическое подтверждения диагноза. В связи с невозможностью проведения видео-ассоциированной торакоскопической биопсии легкого у части пациентов из-за выраженных вентиляционных нарушений и дыхательной недостаточности может быть также рассмотрено выполнение криобиопсии легкого [24].
Как и в случае рентгенологической картины, основным гистологическим паттерном АНЦА-ИЗЛ является ОИП (46-100%), на втором месте по частоте находится НСИП (7-31%) [36,37]. Следует отметить, что несмотря на невысокую распространенность НСИП, в части случаев при основном паттерне ОИП у пациентов также выявляли отдельные зоны с НСИП-подобной гистологической картиной. Кроме того, в отличие от ОИПИЛФ, при АНЦА-ОИП чаще наблюдаются признаки интерстициального воспаления, поражения мелких дыхательных путей, а также лимфоидные фолликулы [36]. Интересно, что признаки активного васкулита редко определяются в биоптатах легкого у пациентов с АНЦА-ИЗЛ [37].
ИЗЛ при ААВ следует дифференцировать с ДАК – одним из наиболее опасных проявлений системного васкулита [11]. Для КТ-картины ДАК в острой стадии характерно наличие диффузно расположенных зон матового стекла, которые в ряде случаев могут занимать большую часть объема легочной паренхимы, с визуализирующимися заполненными сегментарными и субсегментарными бронхами. Скопления крови в полости альвеол могут также формировать различные по размеру зоны консолидации. В подостром периоде (через 2-3 дня после эпизода кровотечения) для ДАК характерно утолщение междолькового и внутридолькового интерстиция, в ряде случаев – на фоне сохраняющегося уплотнения по типу матового стекла (КТ-симптом «булыжной мостовой»). В исходе ДАК в легких могут формироваться множественные нечеткие центрилобулярные очаги, соответствующие интраальвеолярным скоплениям сидерофагов; вследствие обильных рецидивирующих ДАК может развиться грубый интерстициальный легочный фиброз [6,11].
С учетом активной комбинированной иммуносупрессивной терапии, проводимой большинству пациентов с ААВ, в круг дифференциального диагноза следует включать инфекционные осложнения, в первую очередь, обусловленные оппортунистическими микроорганизмами. Так, пневмония, вызванная Pneumocystis jiroveci, характеризуется появлением обширных зон матового стекла в легочной ткани и может имитировать обострение ИЗЛ (рис. 2) [45].
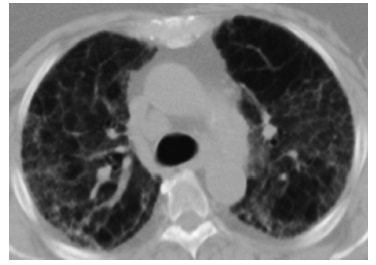
Лекарственное поражение легких, особенно при длительном приеме и высокой кумулятивной дозе цитостатических препаратов, также должно рассматриваться в качестве причины развития ИЗЛ у пациентов с ААВ [11].
Лечение и прогноз
Согласно современным клиническим рекомендациям, лечение ААВ включает индукцию ремиссии с использованием высокоактивных иммуносупрессивных препаратов (высоких доз ГКС в сочетании с циклофосфамидом или ритуксимабом) с последующим переходом на прием поддерживающей терапии для предотвращения рецидива [46]. В то же время, стандартные протоколы терапии не учитывают особенности клинической картины заболевания в отдельных подгруппах пациентов, в том числе при АНЦА-ИЗЛ. Использование иммуносупрессивной терапии при интерстициальном поражении легких в рамках ААВ отчасти основывается на ее доказанной эффективности при ААВ и ИЗЛ, ассоциированных с рядом системных заболеваний соединительной ткани, в частности системной склеродермией и воспалительными миопатиями [11].
Тем не менее, полученные к настоящему моменту данные об эффективности иммуносупрессивной терапии при лечении ААВ-ИЗЛ носят противоречивый характер. С одной стороны, в ряде работ была выявлена клиническая или рентгенологическая положительная динамика у 80% пациентов с ААВ-ИЗЛ, получавших иммуносупрессивную терапию [36]. В исследовании С. Comarmond и соавт. 3-летняя выживаемость пациентов, получавших комбинированную терапию ГКС в сочетании с циклофосфамидом, составила 94% и превышала таковую у больных, которым проводилась монотерапия глюкокортикостероидами – 65% [17]. Имеются указания на зависимость эффективности иммуносупрессивной терапии от паттерна легочного поражения: у пациентов с КТ-картиной НСИП чаще отмечается положительная динамика легочного поражения в ответ на иммуносупрессивную терапию, тогда как у пациентов с ОИП чаще наблюдается прогрессирование ИЗЛ, несмотря на проводимое лечение, что позволяет провести аналогию с ИЛФ [11].
Нерешенным остается вопрос об эффективности иммуносупрессивной терапии при изолированных АНЦА-ИЗЛ, так как большая часть информации была получена из ретроспективных исследований в неоднородных выборках [12]. В ряде исследований было показано, что прогноз при АНЦА-ИЗЛ достоверно не отличается от такового при ИЛФ (средняя выживаемость – 2,5 и 3,5 года с момента установления диагноза, соответственно), вне зависимости от объема проводимой иммуносупрессивной терапии [47]. И наоборот, другие работы продемонстрировали, что выживаемость пациентов с АНЦА-ИЗЛ занимает промежуточное положение между ИЛФ и ААВ без поражения легких [40]. На основании имеющихся данных в 2019 г. группой исследователей из клиники Мэйо (Рочестер, США) была предложена эмпирическая схема лечения МПО-АНЦА-ассоциированного ИЗЛ (табл. 1) [12].
| КТ-паттерн поражения легких | Клинико-лабораторная картина | Лечение |
|---|---|---|
| Примечание: ГКС – глюкокортикостероиды, ММФ – микофенолата мофетил, АЗА – азатиоприн | ||
| ОИП | Изолированное наличие МПО-АНЦА | Наблюдение + ежемесячное проведение общего анализа мочи для исключения гематурии |
| МПО-АНЦА + повышение уровня воспалительных маркеров | Наблюдение + ежемесячное проведение общего анализа мочи для исключения гематури | |
| МПО-АНЦА и МПА | Стандартная терапия МПА | |
| НСИП | Изолированное наличие МПО-АНЦА | ГКС + ММФ/АЗА |
| МПО-АНЦА + повышение уровня воспалительных маркеров | ГКС + ММФ/АЗА | |
| МПО-АНЦА и МПА | Стандартная терапия МПА | |
В будущем для лечения АНЦА-ИЗЛ могут быть использованы антифибротические лекарственные препараты, такие как пирфенидон и нинтеданиб, замедляющие прогрессирование и улучшающие выживаемость пациентов с ИЛФ. Данное предположение основано на том, что в 2019 г. завершено клиническое исследование, продемонстрировавшее эффективность антифибротической терапии у пациентов с фиброзирующими интерстициальными заболеваниями легких, не соответствующими ИЛФ, включая поражение легких в рамках системных заболеваний соединительной ткани [48]. В настоящее время Французской группой по изучению васкулитов проводится открытое исследование эффективности антифибротической терапии у пациентов с ААВ-ИЗЛ (NCT03385668) [24].
Поражение легких может вносить негативный вклад в долгосрочный прогноз пациентов с МПА. Так, в рядеисследований было выявлено повышение смертности в 2-4 раза в подгруппе пациентов ААВ-ИЗЛ по сравнению таковой у больных ААВ без поражения легких [24]. Средняя продолжительность жизни после установления диагноза ААВ-ИЗЛ составляет 3,5-6 лет при уровне 5-летней выживаемости 29-60%, что лишь незначительно превышает соответствующие значения при ИЛФ [36,37]. Основными причинами смерти при ААВ-ИЗЛ являются инфекционные осложнения, обострение ИЗЛ, а также прогрессирующее поражение легких с развитием терминальной дыхательной недостаточности [11].
В то же время в других исследованиях не было выявлено достоверных отличий между выживаемостью пациентов с ААВ и ААВ-ИЗЛ. Одной из вероятных причин этого может быть относительно короткий период наблюдения [24]. Вместе с тем, в когорте из 504 пациентов с ИЛФ 5- и 10-летняя смертность у АНЦАпозитивных пациентов была достоверно выше (61,3% и 85,7%), чем у АНЦА-негативных (37,6% и 70,5%). В данном исследовании, наличие ПР3-АНЦА (по сравнению с МПО-АНЦА), возраст более 65 лет, а также исходное значение DLCO менее 70% были ассоциированы с повышенной смертностью [25].
Заключение
ИЗЛ является одним из вариантов поражения легких при ААВ, оказывающим негативное влияние на течение и прогноз заболевания. У части пациентов ИЗЛ является первым проявлением болезни, развивающимся до появления других симптомов системного васкулита. Таким образом, исследование уровня АНЦА должно проводиться всем пациентам с идиопатическими интерстициальными пневмониями в рамках дифференциального диагноза.
Обсуждая подходы к терапии и тактику дальнейшего наблюдения, АНЦА-ИЗЛ можно разделить на две основные группы. К первой относятся интерстициальные поражения легких при наличии развернутой картины системного васкулита (как правило, МПА), требующего проведения стандартной иммуносупрессивной терапии и наблюдения ревматологами. Вторую составляют случаи ИИП, установленной в качестве первичного диагноза и сочетающейся с АНЦА. У таких пациентов важно оценить уровень воспалительных маркеров, а также провести активный поиск внелегочных, в том числе субклинических, проявлений ААВ, в частности, поражения почек, нервной системы, кожи, дыхательных путей, суставов. При наличии классификационных критериев ААВ необходимо проводить стандартную иммуносупрессивную терапию. Если данные в пользу ААВ отсутствуют, то назначение иммуносупрессивной терапии зависит от КТ-паттерна поражения легких. В части случаев обсуждается использование антифибротических препаратов.
Учитывая относительную редкость патологии, для получения достоверных данных об ее распространен ности в различных регионах, эффективности иммуносупрессивной и антифибротической терапии, определения оптимальной тактики ведения больных с АНЦА-ИЗЛ, требуется создание международных регистров пациентов и проведение проспективных рандомизированных клинических исследований. Кроме того, для сопоставления АНЦА-ИЗЛ с другими вариантами аутоиммунных поражений легких представляется обоснованным включение АНЦА в серологические критерии интерстициальной пневмонии с аутоиммунными признаками [49].
IgG4-ассоциированное заболевание: что изменилось к 2020 году
В 2003 г. была впервые опубликована серия наблюдений пациентов с аутоиммунным панкреатитом и системными проявлениями, у которых при гистологическом исследовании отмечались инфильтрация тканей IgG4-позитивными клетками и фиброз. Разработанная в 2012 г. номенклатура IgG4-ассоциированного заболевания дает представление о полиморфизме клинической картины, который наряду с неспецифичностью лабораторных изменений определяет трудности диагностики этого заболевания. Тем не менее, за последние годы проведено достаточно большое количество исследований, посвященных IgG4-ассоциированному заболеванию, и были разработаны классификационные критерии Американской коллегией ревматологов и Европейской антиревматической лигой, которые могут быть использованы для отбора пациентов в рандомизированные и наблюдательные клинические исследования. В обзоре литературы освещены основные вопросы тактики ведения пациентов с IgG4-ассоциированным заболеванием.
Иммуноглобулин G4 (IgG4)-ассоциированное заболевание характеризуется лимфоплазмоцитарной инфильтрацией тканей с преобладанием IgG4-позитивных клеток и последующим формированием фиброза [1]. Примерно у половины пациентов наблюдаются облитерирующий флебит и эозинофильная инфильтрация, в то время как некроз, гранулематозное воспаление и наличие многоядерных гигантских клеток и нейтрофилов в составе инфильтратов не характерно для этого заболевания [2]. IgG4-ассоциированное заболевание было выделено в качестве самостоятельной нозологической формы в 2003 г., когда у пациентов с аутоиммунным панкреатитом 1 типа были обнаружены признаки системного поражения (вовлечение желчных путей, слюнных желез, забрюшинного пространства), а в 2012 г. была предложена первая международная номенклатура заболевания [3,4]. Тем не менее, классические прояв ле ния IgG4-ассоциированного заболевания, в частности поражение гепатобилиарной системы в сочетании с ретроперитонеальным фиброзом и тиреоидитом Риделя (характеризующимся распространенным фиброзом и часто поражающим, помимо щитовидной железы, окружающие структуры), были описаны еще в 60-х годах прошлого века [5]. Другие частые проявления IgG4-ассоциированного заболевания – по ра жение слезных и слюнных желез, которое называют синдромом Ми ку лича (двустороннее симметричное поражение слюнных и слезных желез, сопровождающееся сни жением их секреторной функции) или опухолью Кюттнера (хронический склерозирующий сиалоаденит) [6,7].
Клинические проявления IgG4-ассоциированного заболевания неспецифичны, что определяет трудности дифференциальной диагностики, в том числе с инфекциями и опухолями, и увеличивает срок от начала болезни до установления диагноза в среднем до 2 лет [8].
За последние годы отмечается значительный рост числа исследований, посвященных данной патологии, а в 2019 г. экспертами Европейской антиревматической лиги (EULAR) и Американской коллегии ревматологов (ACR) были предложены классификационные критерии IgG4-ассоциированного заболевания (табл. 1).
| Шаг 1. Наличие критерия включения: характерные клинические или рентгенологические признаки поражения слюнных, слезных желез, легких, почек, ретроперитонеального пространства, щитовидной железы, твердой мозговой оболочки или лимфоплазмоцитарный инфильтрат неясной этиологии, выявленный в указанных органах | |
| Шаг 2. Отсутствие критериев исключения Клинические: лихорадка, отсутствие эффекта от применения глюкокортикостероидов Лабораторные: лейкопения, тромбоцитопения, эозинофилия, АНЦА, анти-Ro, анти-La, анти-Sm, анти-Jo, анти-Scl-70 и другие специфические антитела, криоглобулины Рентгенологические: признаки инфекционного или онкологического процесса, включающие формирование полостей, некроза, признаков экзофитного роста и т.д. Данные световой микроскопии: признаки малигнизации, воспалительной миофибробластической опухоли, некротизирующего васкулита, гранулематозного воспаления, макрофагально-гистиоцитарной инфильтрации Дополнительные критерии исключения: болезнь Кастелмана, воспалительное заболевание кишечника (если доказано вовлечение панкреатобилиарного тракта), тиреоидит Хашимото (в том случае, если является единственным проявлением) | |
| Шаг 3. Световая микроскопия | |
| Неинформативная биопсия | 0 |
| Плотный лимфоцитарный инфильтрат | +4 |
| Плотный лимфоцитарный инфильтрат и облитерирующий флебит | +6 |
| Плотный лимфоцитарный инфильтрат и муаровый фиброз ± облитерирующий тромбофлебит | +13 |
| Иммуногистохимия | |
| IgG4+/IgG 0–40% и 0-9 IgG4+клеток в поле зрения | 0 |
| IgG4+/IgG ≥41% и 0-9 IgG4+клеток в поле зрения или IgG4+/IgG 0-40% и ≥10 IgG4+клеток в поле зрения | +7 |
| IgG4+/IgG 41-70% и ≥10 IgG4+клеток в поле зрения или IgG4+/IgG+ ≥71% и 10-50 IgG4+клеток в поле зрения | +14 |
| IgG4+/IgG ≥71% и ≥51 IgG4+ клеток в поле зрения | +16 |
| Концентрация IgG4 в сыворотке крови | |
| Исследование не проводилось или концентрация в норме | 0 |
| До 2 норм | +4 |
| 2-5 норм | +6 |
| Более 5 норм | +11 |
| Двухстороннее поражение слезных, околоушных, подъязычных, поднижнечелюстных слюнных желез | |
| Нет поражения слезных и слюнных желез | 0 |
| Поражение одной пары желез | +6 |
| Поражение двух и более пар желез | +14 |
| Грудная клетка | |
| Обследование не проводилось | 0 |
| Перибронхиальные и септальные утолщения | +4 |
| Паравертебральное мягкотканное образование | +10 |
| Поджелудочная железа и желчные пути | |
| Исследование не проводилось | 0 |
| Диффузное увеличение поджелудочной железы | +8 |
| Диффузное увеличение поджелудочной железы и капсулообразное утолщение со сниженной эхогенностью | +11 |
| Описанное выше поражение поджелудочной железы и вовлечение билиарного тракта | +19 |
| Почки | |
| Исследование не проводилось | 0 |
| Гипокомплементемия | +6 |
| Утолщение почечной лоханки или наличие мягкотканного образования | +8 |
| Гипоэхогенные участки в корковом слое почек | +10 |
| Ретроперитонеальное пространство | |
| Исследование не проводилось | 0 |
| Диффузное утолщение стенки абдоминальной аорты | +4 |
| Мягкотканное образование вокруг подвздошных артерий или аорты | +8 |
| Шаг 4. Диагноз соответствует классификационным критериям при наличии входящего критерия, отсутствии критериев исключения и общей сумме баллов ≥20 | |
IgG4-ассоциированное заболевание чаще развивается в среднем и пожилом возрасте. Распространенность его среди мужчин выше, чем среди женщин, хотя частота различных клинических форм может варьироваться в зависимости от возраста и пола. Так, у мужчин чаще встречаются аутоиммунный панкреатит 1 типа, ретроперитонеальный фиброз и тубулоинтерстициальный нефрит, а у женщин – сиалоаденит, дакриоаденит и тиреоидит [8,9].
По данным японских исследователей, количество новых случаев аутоиммунного панкреатита 1 типа c 2007 по 2016 г. увеличилось с 0,28 до 3,1 на 100 тысяч населения, а общее число пациентов с IgG4-ассоциированным заболеванием в Японии в 2009 г. составило 8000 человек 10. Значительный рост заболеваемости отражает увеличение информированности об IgG4ассоциированном заболевании и, соответственно, более частое его распознавание. Точные данные об эпидемиологии IgG4-ассоциированного заболевания в европейской популяции отсутствуют.
Этиология и патогенез
Этиология IgG4-ассоциированного заболевания остается неизвестной, хотя результаты недавно опубликованного японского исследования у 835 пациентов и 1789 здоровых добровольцев свидетельствуют о роли генетической предрасположенности (локусы HLA-DRB1 и FCGR2B) [13]. К потенциальным факторам риска IgG4ассоциированного заболевания относят также курение [14] и воздействие асбеста [15], атопию [16] и злокачественные новообразования [17].
В развитии IgG4-ассоциированного заболения можно выделить две фазы – воспаление и фиброз [18,19]. В воспалительную фазу происходит клональная экспансия патогенных В- и Т-клеток, которые накапливаются в тканях и секретируют различные цитокины, хемокины, факторы роста и ферменты, поддерживающие воспаление и способствующие развитию фиброза [20,21]. На втором этапе лимфоцитарные инфильтраты замещаются отложениями соединительной ткани, что в конечном итоге приводит к нарушению функции пораженного органа. Ответственными за созревание наивных В-клеток в IgG4-секретирующие плазматические клетки считают Т-хелперы, выделяющие интерлейкин-4 [20]. В воспаленных тканях плазматические клетки вызывают активацию CD4- и CD8-цитотоксических Тклеток, повреждающее действие которых связано с выделением различных цитолитических и фиброгенных молекул, таких как перфорин, трансформирующий фактор роста β, интерферон γ, интерлейкин-1 и интерлейкин-6. Кроме того, плазматические клетки участвуют в активации фибробластов и отложении внеклеточного матрикса.
Результаты нескольких исследований свидетельствуют о том, что в развитии иммунного ответа при IgG4-ассоциированном заболевании могут играть роль различные аутоантигены, такие как прохибитин, ламинин 511, галектин 3 и аннексин А11, возможно, в результате нарушения иммунологической толерантности 22. В то же время вклад IgG4 антител, секретируемых плазматическими клетками, в развитие воспаления при IgG4-ассоциированном заболевании остается неопределенным, хотя гипотетически антитела могут участвовать в образовании иммунных комплексов и усиливать повреждение тканей за счет активации комплемента [20]. T. Sasaki и соавт. в опытах на мышах показали, что моноклональные IgG4 антитела против панкреатических клеток, экспрессирующих овальбумин, вызывают воспаление поджелудочной железы только при одновременном введении цитотоксических Т-лимфоцитов [26]. Эти данные могут указывать на синергизм повреждающего действия IgG4 антител и цитотоксических Т-клеток.
Клиническая картина
Клиническая картина IgG4-ассоциированного заболевания неоднородна, а в литературе описано поражение практически всех органов (табл. 2), в том числе слюнных и слезных желез, щитовидной железы, поджелудочной железы, мозговых оболочек, орбиты, желчных протоков, легких, почек, аорты и забрюшинного пространства [27,28]. При анализе первых крупных исследований отмечена разница в частоте основных проявлений заболевания в европейской и азиатской популяциях (табл. 2). Примерно у 40% пациентов отмечаются клинические признаки поражения одного органа, однако со временем в процесс могут вовлекаться другие органы и ткани [2]. Для IgG4-ассоциированного заболевания типично наличие опухолевидных образований (псевдоопухолей) в разных тканях, в том числе орбите, слюнных железах, легких. Заболевание характеризуется медленным прогрессированием, а клинические симптомы могут длительное время отсутствовать, поэтому диагноз нередко устанавливают поздно при наличии необратимых изменений в пораженных органах. При IgG4-ассоциированном заболевании часто снижается масса тела на 5-15 кг, в то время как высокая лихорадка практически всегда отсутствует [2].
| Органы | Wallace et al., 2016 (n=125) | Inoue et al., 2015 (n=235) |
|---|---|---|
| Слюнные железы | 28,0 | 34 |
| Орбита | 22,4 | 4 |
| Поджелудочная железа | 19,2 | 60 |
| Забрюшинное пространство | 18,4 | 4 |
| Легкие | 17,6 | 13 |
| Почки | 12,0 | 23 |
Z. Wallace и соавт. на основании анализа 493 больных из двух международных когортных исследований выделили четыре фенотипа IgG4-ассоциированного заболевания, в том числе поражение гепатобилиарной системы и поджелудочной железы (31%), ретроперитонеальный фиброз, сочетающийся или не сочетающийся с аортитом (24%), поражение головы и шеи (24%) и классический синдром Микулича с системными проявлениями (22%). Интересно отметить, что последняя группа характеризовалась бóльшим числом органных поражений и высокой концентрацией IgG4 в сыворотке крови, в то время как у пациентов с ретроперитонеальным фиброзом титры последних были самыми низкими [8]. Во всей когорте среднее число пораженных органов составило 2,9±1,8. Чаще всего наблюдалось поражение поджелудочной железы и гепатобилиарной системы (47,7%) и слюнных желез (37,7%). У представителей монголоидной расы чаще встречалось поражение органов головы и шеи, а у европеоидов – поражение гепатобилиарной системы и поджелудочной железы и/или ретроперитонеальный фиброз с аортитом [8]. Полу чен ные данные свидетельствуют о том, что расовая принадлежность может ассоциироваться с определенными проявлениями IgG4-ассоциированного заболевания.
В российском исследовании у 52 пациентов основными проявлениями IgG4-ассоциированного заболевания были псевдоопухоли орбиты (65,4%), поражение слюнных желез (46,2%) и ретроперитонеальный фиброз (17,3%) [29]. В то же время аутоиммунный панкреатит 1 типа и склерозирующий холангит встречались всего в 1,9% случаев, т.е. значительно реже, чем в зарубежных исследованиях, проводившихся в европеоидной попу ляции.
W. Zhang и J. Stone предложили выделять два подтипа IgG4-ассоциированного заболевания – пролиферативный и фибротический [2]. Первый характеризуется преимущественным поражением железистых и эпителиальных тканей и развитием лимфаденопатии, дакриоаденита, сиалоаденита, аутоиммунного панкреатита, склерозирующего холангита, тубулоинтерстициального нефрита, поражения легких, синусов и гипофиза. У больных с пролиферативным типом заболевания наблюдаются высокие сывороточные титры IgG4, IgG1 и IgE, гипокомплементемия, эозинофилия и одновременное поражение нескольких органов, часто сопровождающееся атопией [9,30]. Для фибротического типа IgG4-ассоциированного заболевания свойственно вовлечение экстрагландулярных тканей и поражение одного органа или части тела с преобладанием фиброза, например, ретроперитонеальный фиброз, склерозирующий мезентерит, фиброзирующий медиастинит, хотя может наблюдаться и поражение щитовидной железы (тиреоидит Риделя) или мозговых оболочек (гипертрофический пахименингит). Атопические заболевания и перечисленные выше изменения лабораторных показателей обычно отсутствуют. Выделение этих подтипов весьма условно, так как они могут перекрещиваться между собой и, возможно, отражают различные этапы одного воспалительного процесса. Нельзя исключить, что пролиферативные изменения бывает труднее выявить при поражении забрюшинного пространства, брыжейки или средостения, поэтому диагноз устанавливают на более поздней стадии, когда у пациента уже развиваются выраженные фиброзные изменения [2].
Диагноз и дифференциальный диагноз
Первые критерии диагностики IgG4-ассоциированного заболевания были предложены японской группой исследователей в 2011 г. [31]. В качестве ключевых критериев были выделены (1) увеличение сывороточной концентрации IgG4 более 1,35 г/л и (2) >40% IgG4позитивных клеток среди IgG-позитивных плазматических клеток и более 10 IgG4-позитивных плазматических клеток в поле зрения при гистологическом исследовании биоптата пораженной ткани. Для установления “достоверного” диагноза IgG4-ассоциированного заболевания необходимо сочетание характерных клинических признаков (увеличение органа, псевдоопухоль или нодулярное поражение или дисфункция органа) с указанными результатами серологического и иммуногистохимического исследований. При отсутствии результатов гистологического исследования или повышения сывороточной концентрации IgG4 у пациентов с типичными клиническими проявлениями диагноз расценивается как возможный или вероятный, соответственно. Чувствительность предложенных критериев была высокой в диагностике IgG4-ассоциированного заболевания с поражением слюнных желез (синдром Микулича) и почек, однако они не позволяют установить определенный диагноз у пациентов с поражением поджелудочной железы, забрюшинного пространства или головного мозга, учитывая сложность получения биоптата соответствующей ткани. Трактовка результатов нефробиопсии может представлять трудности, так как инфильтрация почечной паренхимы IgG4позитивными клетками может наблюдаться при АНЦА-ассоциированных васкулитах (ААВ), системной красной волчанке или диабетической нефропатии [32,33].
Сывороточная концентрация IgG4 повышается у 5597% больных с IgG4-ассоциированным заболеванием и коррелирует с числом пораженных органов [18]. M. Hao и соавт. изучили диагностическое значение сывороточного содержания IgG4 с помощью мета-анализа 9 исследований случай-контроль, в которые в целом были включены 1235 пациентов с IgG4-ассоциированным заболеванием и 5696 пациентов, составивших контрольную группу [34]. Чувствительность и специфичность концентрации IgG4 более 1,35-1,44 г/л в диагностике IgG4-ассоциированного заболевания составили 87,2% (95% доверительный интервал [ДИ] 85,2-89,0%) и 82,6% (95% ДИ 81,6-83,6%), соответственно. При использовании в качестве “отрезного” значения более высокого содержания IgG4 (2,70-2,80 г/л) специфичность увеличилась до 94,8% (95% ДИ 94,1-95,4%), однако чувствительность снизилась до 63,0% (95% ДИ 60,0-66,0%). Сывороточное содержание IgG4 может быть использовано в качестве скринингового показателя, однако необходимо учитывать возможность его повышения при других аутоиммунных заболеваниях, а также инфекциях и опухолях [18]. M. Ebbo и соавт. при обследовании 59 пациентов с сывороточной концентрацией IgG4 более 1,35 г/л диагностировали IgG4-ассоциированное заболевание только в 10% случаев. В остальных случаях причиной повышения сывороточного уровня IgG4 были повторные инфекции (25%), аутоиммунные заболевания (14%) и другие заболевания, в том числе опухоли, интерстициальные заболевания легких, муковисцидоз, системные васкулиты и др. [35]. При интерпретации результатов лабораторного исследования следует учитывать и ограничения методов исследования (турбидиметрии или нефелометрии). Повышение отношения сывороточных уровней IgG4/IgG (>10%) или IgG4/IgG1 (>24%) может улучшить точность диагностики, особенно при незначительном повышении сывороточной концентрации IgG4 [36].
Другие серологические показатели еще менее специфичны. Возможно умеренное увеличение СОЭ, в то время как концентрация С-реактивного белка (СРБ) обычно нормальная, а ее значительное увеличение скорее заставляет исключать другие заболевания, которые могут имитировать IgG4-ассоциированное заболевание, например, ААВ [37]. Примерно у трети больных наблюдаются эозинофилия и увеличение сывороточной концентрации IgE [28,38,39]. Часто отмечается увеличение титров IgG других подклассов, в том числе IgG1, IgG2 и IgG3, хотя и в меньшей степени, чем IgG4.
Наличие антител к цитоплазме нейтрофилов (АНЦА) в сыворотке крови как критерий исключения IgG4ассоциированного заболевания заслуживает отдельного обсуждения в контексте проблемы дифференциального диагноза между IgG4-ассоциированным заболеванием с серопозитивностью по АНЦА, ААВ с наличием IgG4позитивных клеток или перекрестного синдрома. В литературе описано 17 случаев “перекреста” ААВ и IgG4-ассоциированного заболевания, из них только у трех отмечалась серопозитивность по АНЦА без соответствующих гистологических изменений [40]. По мнению некоторых исследователей, избыточная продукция IgG4 может приводить к развитию ААВ, по аналогии с АНЦА, участвующими в прайминге нейтрофилов и представляющими преимущественно IgG1 подкласс [41]. Наша клиника располагает двумя наблюдениями пациентов с псевдоопухолью орбиты и гистологическими признаками IgG4-ассоциированного заболевания, у которых определялись АНЦА в высоком титре. У обоих пациентов отмечено рецидивирующие течение заболевания, потребовавшее назначение ритуксимаба.
Важное значение в диагностике IgG4-ассоциированного заболевания имеют результаты гистологического и иммуногистохимического исследования, которые позволяют выявить характерные гистологические изменения и увеличение количества IgG4-позитивных плазматических клеток в тканях. На международной конференции в Бостоне в 2011 г. были выделены следующие гистологические признаки IgG4-ассоциированного заболевания: (1) лимфоплазмоцитарная инфильтрация, (2) “муаровый” фиброз и (3) облитеративный флебит [42]. Могут также наблюдаться флебит без облитерации просвета сосуда и увеличение количества эозинофилов, хотя сами по себе эти признаки мало чувствительны и неспецифичны. В то же время эпителиодноклеточные гранулемы, выраженная нейтрофильная инфильтрация и зоны некроза обычно указывают на наличие других заболеваний, в частности гранулематоза с полиангиитом [43]. В большинстве случаев определенный диагноз IgG4-ассоциированного заболевания предполагает наличие по крайней мере двух из трех основных критериев, прежде всего лимфоплазмоцитарной инфильтрации и “муарового” фиброза, хотя в некоторых тканях, в том числе лимфатических узлов, малых слюнных и слезных желез или легких, признаки “муарового” фиброза или облитеративного флебита могут отсутствовать.
Еще одним ключевым диагностическим признаком IgG4-ассоциированного заболевания считают увеличение числа IgG4-позитивных плазматических клеток по крайней мере более 10 в поле зрения. Следует отметить, что “отрезное” значение этого показателя варьируется в значительных пределах (от 10 до 200) в зависимости от пораженного органа и методики получения образца (биопсия или хирургическое вмешательство) [42].
Кроме того, увеличение числа IgG4-позитивных плазматических клеток в тканях при некоторых воспалительных заболеваниях может быть связано с большим общим количеством плазматических клеток [44]. Более надежным показателем считают увеличение отношения IgG4/IgG-позитивных плазматических клеток более 40% [31]. Необходимо учитывать, что отношение IgG4/IgG-позитивных плазматических клеток в тканях может быть повышено при разных аутоиммунных заболеваниях, в частности ревматоидном артрите [45], поэтому диагноз IgG4-ассоциированного заболевания не может основываться только на увеличении числа IgG4-позитивных плазматических клеток в крови или тканях и предполагает наличие соответствующих клинических проявлений и гистологических изменений.
В 2019 г. экспертами ACR/EULAR предложены классификационные критерии IgG4-ассоциированного заболевания, которые были валидированы более чем у 1000 пациентов с этим заболеванием и почти у 800 пациентов с другими состояниями [46]. Эти критерии позволяли дифференцировать IgG4-ассоциированное заболевание от других заболеваний, в том числе злокачественных опухолей, гранулематозов, системных васкулитов, с высокими специфичностью (97,8%) и чувствительностью (82,0%). Более того, разработанные критерии оставались надежными после исключения из алгоритма результатов биопсии или сывороточной концентрации IgG4. Необходимо отметить, что класссификационные критерии предназначены не для диагностики заболевания, а для создания более однородных выборок пациентов в рамках клинических, научных или наблюдательных исследований, поэтому несоответствие пациента предложенным критериям не исключает диагноз IgG4-ассоциированного заболевания. Тем не менее, они представляет большой интерес и для практикующего врача.
Перспективным методом диагностики IgG4-ассоциированного заболевания считают позитронно-эмиссионную томографию/компьютерную томографию (ПЭТ/КТ). Французские исследователи оценили результаты 46 ПЭТ/КТ у 21 больного с IgG4-ассоциированным заболеванием [47]. На момент установления диагноза или рецидива во всех случаях было выявлено патологическое накопление 18F-фтордезоксиглюкозы в органах, которые обычно поражаются при IgG4-ассоцированном заболевании. Как правило, ПЭТ/КТ превосходила стандартные визуализирующие методы по чувствительности в диагностике поражения различных органов, прежде всего артерий, слюнных желез и лимфатических узлов, хотя в некоторых случаях, например, при наличии очагов небольшого размера, результаты исследования были ложноотрицательными. Результаты ПЭТ/КТ до и после лечения обычно коррелировали с ответом на терапию и активностью болезни.
В настоящее время изучаются новые клеточные и гуморальные маркеры, которые могут иметь значение для диагностики (антитела к галектину 3, аннексину А11, ламинину 511 и прохибитину, сывороточный IgG2), оценки активности (сывороточный растворимый рецептор интерлейкина-2, РНК IgG4/IgG, активированные Tfh2 клетки, RANKL, BAFF, APRIL, CD4+ цитотоксические Т-клетки, С5, С5а и др.), фиброза (CCL-18, индекс ELF, GDF-15, M2 макрофаги) и риска развития рецидивов (В-клетки памяти) [18,48].
Лечение
Тактика лечения IgG4-ассоциированного заболевания разработана недостаточно и в основном базируется на мнении экспертов и результатах ретроспективных исследований. В последние годы опубликованы первые проспективные исследования, хотя они в основном были небольшими и нерандомизированными [18]. При выборе лечения необходимо учитывать характер и тяжесть клинических проявлений, а также результаты гистологического исследования. В частности, у пациентов с преобладающими воспалительными изменениями в пораженных органах и тканях можно ожидать большего эффекта от иммуносупрессивной терапии, чем у больных с выраженным фиброзом. В последнем случае более эффективным может оказаться хирургическое вмешательство. M. Lanzillotta и соавт. недавно показали, что отдаленные результаты лечения зависят от клинического фенотипа IgG4-ассоциированного заболевания [49]. У пациентов с поражением органов головы и шеи эффективность иммуносупрессивной терапии была ниже, а рецидивы развивались в более короткие сроки, что привело к увеличению кумулятивной дозы глюкокортикостероидов (ГКС). У пациентов с поражением поджелудочной железы/гепатобилиарной системы и синдромом Микулича с системными проявлениями был значительно повышен риск развития сахарного диабета при лечении ГКС.
В 2015 г. на Втором международном симпозиуме были приняты рекомендации по тактике лечения пациентов с IgG4-ассоциированным заболеванием, которое проводится в два этапа: индукция ремиссии и поддерживающая терапия (табл. 3) [50]. Авторы подчеркнули, что в ряде клинических ситуаций оправдана выжидательная тактика, например, при незначительном увеличении слюнных желез или бессимптомной лимфаденопатии. Тем не менее, с учетом прогрессирующего течения IgG4-ассоциированного заболевания в большинстве случаев оправдано раннее назначение иммуносупрессивной терапии.
| Положения | Согласие экспертов, % | Класс рекомендаций |
|---|---|---|
| 1. Для точной оценки IgG4-ассоциированного заболевания необходимы полный клинический анамнез, результаты физического, лабораторных исследований и соответствующих радиологических исследований | 96 | 4/С |
| 2. Диагноз настоятельно рекомендуется подтверждать с помощью биопсии с целью исключения злокачественных опухолей и других заболеваний, которые могут имитировать IgG4-ассоциированное заболевание | 94 | 5/D |
| 3. Все пациенты с активным IgG4-заболеванием нуждаются в лечении, иногда неотложном. Лечение также требуется части пациентов с бессимптомным IgG4-ассоциированным заболеванием | 87 | 4/С |
| 4. При отсутствии противопоказаний препаратами первой линии у всех пациентов с активным нелеченным IgG4-ассоциированным заболеванием являются глюкокортикостероид | 94 | 2b/B |
| 5. У некоторых, но не всех больных лечение необходимо начинать с комбинации ГКС со стероидосберегающими иммуносупрессивными препаратами, так как монотерапия ГКС в конечном итоге не позволяет контролировать заболевание и сопровождается отдаленными побочными эффектам | 46 | 4/С |
| 6. После успешного завершения индукционной терапии у некоторых пациентов обоснована поддерживающая терапия | 94 | 2b/B |
| 7. В случае развития рецидива после индукции ремиссии показано повторное лечение ГКС. Кроме того, в таких случаях возможно применение иммуносупрессивного препарата для поддерживающей терапи | 81 | 4/C |
В качестве препаратов первого ряда для лечения IgG4 чаще всего применяют ГКС в дозе 30-40 мг/сут в пересчете на преднизолон. В одном ретроспективном и одном рандомизированном исследованиях частота достижения ремиссии была сопоставимой при применении высоких (0,8-1 мг/кг) и средних (0,5-0,6 мг/кг) доз ГКС, хотя рецидивы чаще развивались во второй группе [51,52]. В некоторых случаях, например, для предотвращения необратимого сдавления зрительного нерва при псевдоопухоли орбиты, возможна пульстерапия метилпреднизолоном в дозах 0,5-1 г/сут в течение трех дней [53,54]. Продолжительность индукционной терапии ГКС и тактика снижения дозы в рекомендациях не определены. Обычно лечение ГКС в стартовой дозе продолжают в течение 2-4 недель, после чего ее начинают уменьшать на 5 мг каждые две недели [50]. В одном многоцентровом проспективном исследовании начальную дозу ГКС 0,6 мг/кг/сут снижали на 10% каждые 2 недели, при этом клинический эффект был отмечен у 93% пациентов [53]. Большинство пациентов хорошо отвечают на индукционную терапию ГКС, поэтому их неэффективность может служить основанием для дополнительных исследований с целью подтверждения диагноза [50]. Например, в ретроспективном исследовании, проведенном в клинике Мейо (США), ремиссия была достигнута практически у всех 978 больных с аутоиммунным панкреатитом [56]. Во многих центрах ГКС отменяют через 3-6 мес после начала индукционной терапии, хотя многие японские специалисты рекомендуют продолжать поддерживающую терапию ГКС в низких дозах в течение до 3 лет [57].
В течение 3 лет после установления диагноза рецидивы IgG4-ассоциированного заболевания той же или другой локализации развиваются у 46-90% больных как во время снижения доз ГКС (26-40% больных), так и после их отмены (46-54% больных) [18]. При высокой угрозе рецидива, факторами риска которого считают полиорганное поражение, повышение концентрации IgG4, IgE и эозинофилию периферической крови [16, 28,58], к стартовой терапии ГКС могут быть добавлены различные иммуносупрессивные препараты, в том числе азатиоприн, микофенолата мофетил, метотрексат, лефлуномид, такролимус, циклоспорин А, игуратимод и циклофосфамид, хотя их эффективность убедительно не доказана (табл. 4) [18,59,60]. По данным крупного когортного исследования у 215 пациентов с впервые выявленным IgG4-ассоциированным заболеванием, частота ремиссии через 6 мес после начала комбинированной терапии ГКС и иммуносупрессивными препаратами (чаще всего применяли циклофосфамид и микофенолата мофетил) была выше (92,8%), чем при монотерапии ГКС (79,2%) [58]. В другом проспективном исследовании у 104 пациентов с впервые выявленным IgG4-ассоциированным заболеванием были сопоставлены эффективность и безопасность монотерапии ГКС и комбинации ГКС с циклофосфамидом (50–100 мг/сут в течение 3 месяцев с дальнейшим снижением дозы). В первые месяцы после начала лечения частота достижения ремиссии была сопоставимой в двух группах, однако через 1 год ремиссия значительно чаще сохранялась у больных, получавших комбинированную терапию (88,0% против 59,6%), за счет более низкой частоты рецидивов (12,0% против 38,5%) [60]. У двух пациентов циклофосфамид был заменен на микофенолата мофетил в связи с развитием гепатотоксичности. У трех пациентов были диагностированы инфекции легкой и средней степени тяжести, не потребовавшие отмены препарата.
| Препарат | Индукционная терапия | Поддерживающая терапия | Форма заболевания | Дизайн исследования |
|---|---|---|---|---|
| Примечание: РКИ – рандомизированное контролируемое исследование, ТИН – тубулоинтерстициальный нефрит | ||||
| Азатиоприн | 0,5-2,5 мг/кг/сут | 0,5-2,5 мг/кг/сут | Аутоиммунный панкреатит, ТИН | Серия наблюдений |
| Метотрексат | 15-20 мг/нед | 15-20 мг/нед | Аутоиммунный панкреатит, сиалоаденит, псевдоопухоли | Серия наблюдений |
| Лефлуномид | 10-20 мг/сут | 10-20 мг/сут | Системные формы | Серия наблюдений, РКИ |
| Микофенолата | 1000-1500 мг/сут | 500-1000 мг/сут | Системные формы | РКИ |
| мофетил | 1000-2000 мг/сут | 1000-2000 мг/сут | Ретроспективные | |
| Циклофосфамид | 50-100 мг/сут (3 мес) | 50 мг/сут (>9 мес) | Системные формы | Проспективное |
| Циклоспорин | 100 мг/сут | 100 мг/сут | Поражение легких | Серия наблюдений |
| Такролимус | 1-2,5 мг/сут | 1-2,5 мг/сут | Аутоиммунный панкреатит, системная форма с лимфаденопатией и сиалоаденитом | Серия наблюдений |
| Игуратимод | 50 мг/сут | 50 мг/сут | Легкие формы, преимущественно с сиалоаденитом | Проспективное |
Недавно были опубликованы результаты рандомизированного контролируемого исследования, в котором у 69 пациентов с IgG4-ассоциированным заболеванием сравнивали эффективность монотерапии ГКС (в стартовой дозе 0,6-0,8 мг/кг) и комбинированной терапии ГКС и микофенолата мофетилом в низкой дозе (1,0-1,5 г/сут) [61]. Через 1 мес эффективность двух схем иммуносупрессивной терапии была сопоставимой, однако через 1 год у больных, получавших комбинированную терапию, было отмечено значительное увеличение частоты ремиссии (76,5% против 51,4%) и снижение кумулятивной частоты рецидивов (20,6% против 40,0%).
Целесообразность включения иммуносупрессивных препаратов в схемы стартовой терапии по крайней мере у части пациентов с IgG4-ассоциированным заболеванием была подтверждена при мета-анализе 15 когортных исследований в целом у 1169 больных [64]. У пациентов, получавших комбинированную терапию, было отмечено значительное увеличение вероятности достижения ремиссии по сравнению с монотерапией ГКС (отношение шансов 3,36; 95% ДИ 1,44-7,83) или базисными противовоспалительными препаратами (55,31; 95% ДИ 13,73-222,73).
Генно-инженерные биологические препараты (ГИБП), как правило, назначают при неэффективности иммуносупрессивных средств (табл. 5), хотя они, в частности ритуксимаб, вероятно, могут быть и альтернативой стандартным схемам терапии. Ритуксимаб был первым ГИБП, использованным при IgG4-ассоциированном заболевании как для индукционной, так и поддерживающей терапии. В проспективном исследовании ритуксимаб (две дозы по 1000 мг) применяли у 30 больных с IgG4-ассоциированным заболеванием [65]. Двадцать шесть пациентов не получали ГКС, в то время как остальные прекращали их прием в течение 2 месяцев. Частота ответа на лечение составила 97%. Через 6 мес полная ремиссия была отмечена у 47% больных, а через 12 мес – у 40%. Таким образом, в этом исследовании применение ритуксимаба в виде одного цикла позволяло достичь ответа на лечение у значительной части больных даже без сопутствующей терапии ГКС. M. Ebbo и соавт. применяли ритуксимаб у 33 пациентов с IgG4-ассоциированным заболеванием [66]. Частота клинического ответа на лечение составила 93,5%, причем примерно в половине случаев удалось отменить ГКС. Тем не менее, в среднем через 19±11 мес после ведения препарата у 41,9% пациентов развился рецидив заболевания. Поддерживающая терапия ассоциировалась с увеличением безрецидивной выживаемости (р=0,02). Терапия ритуксимабом нередко сопровождалась развитием тяжелых инфекций (8 случаев у 4 пациентов) и гипогаммаглобулинемии (у 3). В другом исследовании эффективность и безопасность поддерживающей терапии ритуксимабом оценивали у 14 больных, ответивших на введение препарата [67]. Семь из них получали ритуксимаб только в случае рецидива, а 7 пациентов – каждые 6 мес. Через 18 мес безрецидивная выживаемость в первой группе была значительно ниже, чем во второй (29% и 100%, соответственно; р=0,006). Инфекционные осложнения зарегистрировали у 6 из 14 больных (по 3 в каждой группе). В России опубликованы положительные результаты применения ритуксимаба у 7 больных с IgG4-ассоциированным заболеванием [68].
| Патологическое звено | Препарат | Дизайн исследовани |
|---|---|---|
| В-лимфоциты | Ритускимба | Проспективные |
| Бортезомиб | Клиническое наблюдение | |
| Инбилтизумаб | РКИ (IIb фаза) | |
| Т-лимфоциты | Абатацепт | Открытое проспективное, клинические наблюдения |
| Блокаторы ИЛ-4/13 | Дупилумаб | Клиническое наблюдение |
| Ингибиторы ФНО-α | Инфликсимаб | Клиническое наблюдение |
В целом приведенные данные свидетельствуют об эффективности как индукционной, так и поддерживающей терапии ритуксимабом у пациентов с IgG4-ассоциированным заболеванием. Соответственно, этот препарат может использоваться в случае неэффективности ГКС или как альтернатива последним при наличии противопоказаний к их применению. В то же время обращает на себя внимание достаточно высокая частота осложнений терапии ритуксимабом. Необходимы дополнительные исследования, чтобы определить место и оптимальные схемы применения ритуксимаба в лечении IgG4-ассоциированного заболевания, в частности показания к поддерживающей терапии.
С учетом важной роли Т-клеточного звена в патогенезе заболевания возможной альтернативой ритуксимабу может быть абатацепт, однако его применение ограничивается описанием клинических наблюдений при синдроме Микулича и аутоиммунном панкреатите [69].
При проведении клинических исследований важное значение имеет стандартизированная оценка результатов лечения. У пациентов с IgG4-ассоциированным заболеванием применение унифицированных критериев особенно важно, учитывая разнообразие форм заболевания. С этой целью разработан индекс ответа на лечение (IgG4-RD RI) по аналогии с Бирмингемским индексом активности васкулита (BVAS) [70]. IgG4-RD RI рассчитывается в баллах с учетом активности и необратимого повреждения различных органов (мозговые оболочки, гипофиз, орбита и слезные железы, слюнные железы, щитовидная железа, лимфатические узлы, легкие, аорта и крупные сосуды, забрюшинное пространство, средостение и брыжейка, поджелудочная железа, печень и желчные протоки, почки, кожа, другие), наличия симптомов, необходимости в неотложном лечении и сывороточного уровня IgG4. Несмотря на определенные недостатки, этот индекс сегодня все шире используется в клинических исследованиях и обычной практике [71].
Заключение
Интерес к IgG4-ассоциированному заболеванию за последнее время значительно увеличился. В настоящее время мы располагаем достаточно большим количеством данных о клинических и морфологических проявлениях этого заболевания и классификационными критериями, которые представляют интерес не только для исследователей, но и практикующих врачей. Разработан индекс активности IgG4-ассоциированного заболевания, который может быть использован в клинических исследованиях для определения ответа на лечение. Активно изучаются новые клеточные и гуморальные биомаркеры, которые могут найти применение для диагностики, оценки активности и фиброза и мониторирования эффективности лечения. Показана информативность ПЭТ/КТ в диагностике IgG4-ассоциированного заболевания, хотя более широкое применение этого метода сдерживается его высокой стоимостью. В будущем можно ожидать увеличения количества рандомизированных клинических исследований различных схем иммуносупрессивной терапии. ГКС в средних дозах остаются препаратами первой линии в лечении IgG4-ассоциированного заболевания. Эти препараты позволяют достичь ремиссии у большинства пациента, однако после снижения дозы или отмены ГКС нередко развивается рецидив, в то время как длительная поддерживающая терапия ГКС ассоциируется с высоким риском нежелательных эффектов. Применение иммуносупрессивных препаратов или ГИБП, прежде всего ритуксимаба, позволяет улучшить результаты лечения у части больных с IgG4-ассоциированным заболеванием, хотя показания к их назначению и схемы терапии нуждаются в уточнении.