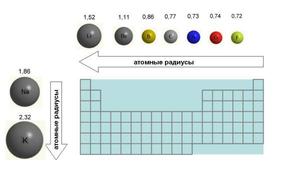
Атомные радиусы что это
Атомный радиус: что такое и как определить
Чтобы разобраться в вопросе, что в современной науке называется радиусом атома, вспомним, что из себя представляет сам атом. По классическим представлениям в центре атома находится ядро, состоящее из протонов и нейтронов, а вокруг ядра каждый на своей орбите вращаются электроны.
Радиус атома в физике
Поскольку в данной модели строения атома электроны являются пространственно ограниченными частицами, т. е. корпускулами, логично считать атомным радиусом (а. р.) расстояние от его ядра до самой дальней, или внешней, орбиты, по которой вращаются так называемые валентные электроны.
Однако по современным, квантовомеханическим представлениям, определить данный параметр нельзя так однозначно, как это делается в классической модели. Здесь электроны уже не представляются в виде частиц-корпускул, а получают свойства волн, т. е. пространственно-неограниченных объектов. В такой модели точно определить положение электрона просто невозможно. Здесь эта частица уже представляется в виде электронной орбитали, плотность которой меняется, в зависимости от расстояния до ядра атома.
Итак, в современной модели строения атома его радиус нельзя определить однозначно. Поэтому в квантовой физике, общей химии, физике твердого тела и других смежных науках эту величину сегодня определяют как радиус сферы, в центре которой находится ядро, внутри которой сосредоточено 90-98% плотности электронного облака. Фактически это расстояние и определяет границы атома.
Если рассмотреть Периодическую таблицу химических элементов (таблицу Менделеева), в которой приведены атомные радиусы, можно увидеть определенные закономерности, которые выражаются в том, что в пределах периода эти числа уменьшаются слева направо, а в пределах группы они увеличиваются сверху вниз. Такие закономерности объясняются тем, что внутри периода при движении слева направо заряд атома возрастает, что увеличивает силу притяжения им электронов, а при движении внутри группы сверху вниз все больше заполняется электронных оболочек.
Атомный радиус в химии и кристаллографии
Какие бывают виды
Данная характеристика сильно варьируется, в зависимости от того, в какой химической связи состоит атом. Поскольку все вещества в природе в подавляющем своем большинстве состоят из молекул, понятие а. р. используют для определения межатомных расстояний в молекуле. А данная характеристика зависит от свойств входящих в молекулу атомов, т. е. их положения в Периодической системе химических элементов. Обладая разными физическими и химическими свойствами, молекулы образуют все огромное разнообразие веществ.
По сути, эта величина очерчивает сферу действия силы электрического притяжения ядра атома и его внешних электронных оболочек. За пределами этой сферы в действие вступает сила электрического притяжения соседнего атома. Существует несколько типов химической связи атомов в молекуле:
Соответственно этим связям таким же будет и атомный радиус.
Как зависит от типа химической связи
При ковалентной связи АР определяется как половина расстояния между соседними атомами в одинарной химической связи Х—Х, причем Х — это неметалл, ибо данная связь свойственна неметаллам. Например, для галогенов ковалентный радиус будет равен половине межъядерного расстояния Х—Х в молекуле Х2, для молекул селена Se и серы S — половине расстояния Х—Х в молекуле Х8, для углерода С он будет равен половине кратчайшего расстояния С—С в кристалле алмаза.
Данная химическая связь обладает свойством аддитивности, т. е. суммирования, что позволяет определять межъядерные расстояния в многоатомных молекулах. Если связь в молекуле двойная или тройная, то ковалентный АР уменьшается, т. к. длины кратных связей меньше одинарных.
При ионной связи, образующейся в ионных кристаллах, используют значения ионного АР для определения расстояния между ближайшими анионом и катионом, находящимися в узлах кристаллической решетки. Такое расстояние определяется как сумма радиусов этих ионов.
Существует несколько способов определения ионных радиусов, при которых отличаются значения у индивидуальных ионов. Но в результате эти способы дают примерно одинаковые значения межъядерных расстояний. Эти способы или системы были названы в честь ученых, проводивших в этой области соответствующие исследования:
При металлической связи, возникающей в кристаллах металлов, АР принимаются равными половине кратчайшего расстояния между ними. Металлический радиус зависит от координационного числа К. При К=12 его значение условно принимается за единицу. Для координационных чисел 4, 6 и 8 металлические радиусы одного и того же элемента соответственно будут равны 0.88, 0.96 и 0.98.
Если взять два разных металла и сравнить металлические радиусы их элементов, то близость этих значений друг к другу будет означать необходимое, но недостаточное условие взаимной растворимости этих металлов по типу замещения. Например, жидкие калий К и литий Li в обычных условиях не смешиваются и образуют два жидких слоя, потому что их металлические радиусы сильно различаются (0.236 нм и 0.155 нм соответственно), а калий К с цезием Cs образуют твердый раствор благодаря близости их радиусов (0.236 нм и 0.268 нм).
Ван-дер-ваальсовы АР используют для определения эффективных размеров атомов благородных газов, а также расстояний между ближайшими одноименными атомами, принадлежащими разным молекулам и не связанными химической связью (пример — молекулярные кристаллы). Если такие атомы сблизятся на расстояние, меньшее суммы их ван-дер-ваальсовых радиусов, между ними возникнет сильное межатомное отталкивание. Эти радиусы определяют минимально допустимые границы контакта двух атомов, принадлежащих соседним молекулам.
Кроме того, данные АР используют для определения формы молекул, их конформаций и упаковки в молекулярных кристаллах. Известен принцип «плотной упаковки», когда молекулы, образующие кристалл, входят друг в друга своими «выступами» и «впадинами». На основе этого принципа интерпретируются данные кристаллографии и предсказываются структуры молекулярных кристаллов.
Видео
Это полезное видео поможет вам понять, что такое радиус атома.
Атомный радиус, как он измеряется, как он изменяется в периодической таблице, примеры
атомный радиус это важный параметр для периодических свойств элементов таблицы Менделеева. Это напрямую связано с размером атомов, поскольку на большем радиусе они больше или громоздче. Кроме того, это связано с электронными характеристиками того же.
Пока атом имеет больше электронов, тем больше его размер и атомный радиус. Оба определяются электронами валентной оболочки, потому что на расстояниях за пределами их орбит вероятность обнаружения электрона приближается к нулю. В окрестности ядра происходит обратное: увеличивается вероятность нахождения электрона.
Верхнее изображение представляет собой упаковку ватных шариков. Обратите внимание, что каждый из них окружен шестью соседями, не считая другого возможного верхнего или нижнего ряда. Способ уплотнения ватных шариков будет определять их размеры и, следовательно, их радиусы; как это происходит с атомами.
Элементы в соответствии с их химической природой так или иначе взаимодействуют со своими собственными атомами. Следовательно, величина атомного радиуса варьируется в зависимости от типа присутствующей связи и твердой упаковки ее атомов..
Как измеряется атомный радиус?
На основном изображении можно легко измерить диаметр ватных шариков, а затем разделить его на два. Однако сфера атома не полностью определена. Почему? Потому что электроны циркулируют и диффундируют в определенных областях пространства: орбитали.
Поэтому атом можно рассматривать как сферу с неощутимыми краями, о которых невозможно точно сказать, в какой степени они заканчиваются. Например, на верхнем изображении центральная область около ядра выглядит более интенсивной, а ее края размыты.
Изображение представляет двухатомную молекулу E2 (как Cl2, H2, О2, и т.д.). Предполагая, что атомы являются сферическими телами, если расстояние было определено d что разделяет оба ядра в ковалентной связи, то было бы достаточно разделить его на две половины (d/ 2) получить атомный радиус; точнее, ковалентный радиус E для E2.
А если Е не образует с собой ковалентных связей, но это металлический элемент? то d это будет указано числом соседей, которые окружают Е в его металлической структуре; то есть по координационному числу (N.C) атома в упаковке (помните ватные шарики основного изображения).
Определение межъядерного расстояния
Определить d, это межъядерное расстояние для двух атомов в молекуле или упаковке, это требует методов физического анализа.
Одной из наиболее часто используемых является дифракция рентгеновских лучей, в которой пучок света облучается через кристалл, и изучается дифракционная картина, возникающая в результате взаимодействия электронов с электромагнитным излучением. В зависимости от упаковки могут быть получены различные дифракционные картины и, следовательно, другие значения d.
Если атомы «плотно» в кристаллической решетке, они будут представлять разные значения d по сравнению с тем, что они имели бы, если бы они были «удобными». Кроме того, эти межъядерные расстояния могут колебаться в значениях, поэтому атомный радиус фактически состоит из среднего значения таких измерений.
Как связаны атомный радиус и координационное число? В. Гольдшмидт установил взаимосвязь между ними, в которой для N.C. из 12 относительное значение равно 1; от 0,97 для упаковки, где атом имеет N.C, равный 8; 0,96 для N.C, равного 6; и 0,88 для N.C. из 4.
единицы
Из значений для N.C, равных 12, было построено много таблиц, сравнивающих атомные радиусы всех элементов периодической таблицы..
Поскольку не все элементы образуют такие компактные структуры (N.C меньше 12), соотношение В. Гольдшмидта используется для расчета их атомных радиусов и выражения для одной и той же упаковки. Таким образом, измерения атомных радиусов стандартизированы.
Как это меняется в периодической таблице?
На протяжении периода
Слева направо в тот же период, ядро добавляет протоны и электроны, но последние ограничены тем же уровнем энергии (главное квантовое число). Как следствие, ядро оказывает увеличивающийся эффективный заряд ядра на валентные электроны, который сжимает атомный радиус..
Таким образом, неметаллические элементы в тот же период имеют тенденцию иметь атомные (ковалентные) радиусы меньше, чем металлы (металлические радиусы).
По убыванию группой
При спуске по группе включаются новые уровни энергии, которые позволяют электронам иметь больше места. Таким образом, электронное облако преодолевает большие расстояния, его размытая периферия все больше отдаляется от ядра, и, следовательно, радиус атома расширяется.
Сокращение лантаноидов
Электроны внутреннего слоя помогают экранировать эффективный заряд ядра на валентных электронах. Когда орбитали, составляющие внутренние слои, имеют много «дырок» (узлов), как и в случае f-орбиталей, ядро сильно сжимает атомный радиус из-за плохого экранирующего эффекта орбиталей..
Этот факт подтверждается сокращением лантаноидов в период 6 периодической таблицы. От La до Hf происходит значительное сжатие атомного радиуса, создаваемого орбиталями f, которые «заполняются» при прохождении через блок f: у лантаноидов и актиноидов.
Аналогичный эффект можно наблюдать и с элементами блока p периода 4. На этот раз произведение слабого экранирующего эффекта орбиталей d, которые заполняются при пересечении периодов переходных металлов..
примеров
Для периода 2 периодической таблицы атомные радиусы ее элементов:
Обратите внимание, что металлический литий имеет наибольший атомный радиус (257 мкм), в то время как фтор, расположенный в крайней правой части периода, является наименьшим из них (64 мкм). Атомный радиус уменьшается слева направо за тот же период, и перечисленные значения показывают его.
Литий, образуя металлические связи, его радиус металлический; и фтор, поскольку он образует ковалентные связи (F-F), его радиус является ковалентным.
А если вы хотите выразить атомные радиостанции в единицах ангстрема? Просто разделите их на 100: (257/100) = 2,57Å. И так далее с остальными ценностями.
Атомный радиус
Важной характеристикой атома является его размер, т. е. атомный радиус. Размер отдельного атома не определен, поскольку внешняя его граница размыта за счет вероятностного нахождения электронов в различных точках околоядерного пространства. В силу этого, в зависимости от типа связи между атомами различают металлические, ковалентные, ван-дер-ваальсовы, ионные и др. атомные радиусы.
«Металлические» радиусы (rme) найдены путем деления пополам кратчайших межатомных расстояний в кристаллических структурах простых веществ с координационным числом 12. При других значениях к.ч. учитывается необходимая поправка.
Значения ковалентных радиусов (rcov) рассчитаны как половина длины гомоатомной связи. В случае невозможности определить длину одинарной гомоатомной связи, значение rcov атома элемента A получают вычитанием ковалентного радиуса атома элемента B из длины гетероатомной связи A-B. Ковалентные радиусы зависят, главным образом, от размеров внутренней электронной оболочки.
Длина связи дана в ангстремах (1 Å = 0.1 нм = 100 пм).
| Элемент | rme | rcov | rw | rcmp |
| H | 0.46 | 0.37 | 1.20 | 0.25 |
| He | 1.22 | 0.32 | 1.40 | — |
| Li | 1.55 | 1.34 | 1.82 | 1.45 |
| Be | 1.13 | 0.90 | — | 1.05 |
| B | 0.91 | 0.82 | — | 0.85 |
| C | 0.77 | 0.77 | 1.70 | 0.70 |
| N | 0.71 | 0.75 | 1.55 | 0.65 |
| O | — | 0.73 | 1.52 | 0.60 |
| F | — | 0.71 | 1.47 | 0.50 |
| Ne | 1.60 | 0.69 | 1.54 | — |
| Na | 1.89 | 1.54 | 2.27 | 1.80 |
| Mg | 1.60 | 1.30 | 1.73 | 1.50 |
| Al | 1.43 | 1.18 | — | 1.25 |
| Si | 1.34 | 1.11 | 2.10 | 1.10 |
| P | 1.30 | 1.06 | 1.80 | 1.00 |
| S | — | 1.02 | 1.80 | 1.00 |
| Cl | — | 0.9 | 1.75 | 1.00 |
| Ar | 1.92 | 0.97 | 1.88 | — |
| K | 2.36 | 1.96 | 2.75 | 2.20 |
| Ca | 1.97 | 1.74 | — | 1.80 |
| Sc | 1.64 | 1.44 | — | 1.60 |
| Ti | 1.46 | 1.36 | — | 1.40 |
| V | 1.34 | 1.25 | — | 1.35 |
| Cr | 1.27 | 1.27 | — | 1.40 |
| Mn | 1.30 | 1.39 | — | 1.40 |
| Fe | 1.26 | 1.25 | — | 1.40 |
| Co | 1.25 | 1.26 | — | 1.35 |
| Ni | 1.24 | 1.21 | 1.63 | 1.35 |
| Cu | 1.28 | 1.38 | 1.40 | 1.35 |
| Zn | 1.39 | 1.31 | 1.39 | 1.35 |
| Ga | 1.39 | 1.26 | 1.87 | 1.30 |
| Ge | 1.39 | 1.22 | — | 1.25 |
| As | 1.48 | 1.19 | 1.85 | 1.15 |
| Se | 1.60 | 1.16 | 1.90 | 1.15 |
| Br | — | 1.14 | 1.85 | 1.15 |
| Kr | 1.98 | 1.10 | 2.02 | — |
| Rb | 2.48 | 2.11 | — | 2.35 |
| Sr | 2.15 | 1.92 | — | 2.00 |
| Y | 1.81 | 1.62 | — | 1.80 |
| Zr | 1.60 | 1.48 | — | 1.55 |
| Nb | 1.45 | 1.37 | — | 1.45 |
| Mo | 1.39 | 1.45 | — | 1.45 |
| Tc | 1.36 | 1.56 | — | 1.35 |
| Ru | 1.34 | 1.26 | — | 1.30 |
| Rh | 1.34 | 1.35 | — | 1.35 |
| Pd | 1.37 | 1.31 | 1.63 | 1.40 |
| Ag | 1.44 | 1.53 | 1.72 | 1.60 |
| Cd | 1.56 | 1.48 | 1.58 | 1.55 |
| In | 1.66 | 1.44 | 1.93 | 1.55 |
| Sn | 1.58 | 1.41 | 2.17 | 1.45 |
| Te | 1.70 | 1.35 | 2.06 | 1.40 |
| I | — | 1.33 | 1.98 | 1.40 |
| Xe | 2.18 | 1.30 | 2.16 | — |
| Cs | 2.68 | 2.25 | — | 2.60 |
| Ba | 2.21 | 1.98 | — | 2.15 |
| La | 1.87 | 1.69 | — | 1.95 |
| Ce | 1.83 | — | — | 1.85 |
| Pr | 1.82 | — | — | 1.85 |
| Nd | 1.82 | — | — | 1.85 |
| Pm | — | — | — | 1.85 |
| Sm | 1.81 | — | — | 1.85 |
| Eu | 2.02 | — | — | 1.80 |
| Gd | 1.79 | — | — | 1.80 |
| Tb | 1.77 | — | — | 1.75 |
| Dy | 1.77 | — | — | 1.75 |
| Ho | 1.76 | — | — | 1.75 |
| Er | 1.75 | — | — | 1.75 |
| Tm | 1.74 | — | — | 1.75 |
| Yb | 1.93 | — | — | 1.75 |
| Lu | 1.74 | 1.60 | — | 1.75 |
| Hf | 1.59 | 1.50 | — | 1.55 |
| Ta | 1.46 | 1.38 | — | 1.45 |
| W | 1.40 | 1.46 | — | 1.35 |
| Re | 1.37 | 1.59 | — | 1.35 |
| Os | 1.35 | 1.28 | — | 1.30 |
| Ir | 1.35 | 1.37 | — | 1.35 |
| Pt | 1.38 | 1.28 | 1.75 | 1.35 |
| Au | 1.44 | 1.44 | 1.66 | 1.35 |
| Hg | 1.60 | 1.49 | 1.55 | 1.50 |
| Tl | 1.71 | 1.48 | 1.96 | 1.90 |
| Pb | 1.75 | 1.47 | 2.02 | 1.80 |
| Bi | 1.82 | 1.46 | — | 1.60 |
| Po | — | — | — | 1.90 |
| At | — | — | — | — |
| Rn | — | 1.45 | — | — |
| Fr | 2.80 | — | — | — |
| Ra | 2.35 | — | — | 2.15 |
| Ac | 2.03 | — | — | 1.95 |
| Th | 180 | — | — | 1.80 |
| Pa | 1.62 | — | — | 1.80 |
| U | 1.53 | — | 1.86 | 1.75 |
| Np | 1.50 | — | — | 1.75 |
| Pu | 1.62 | — | — | 1.75 |
| Am | — | — | — | 1.75 |
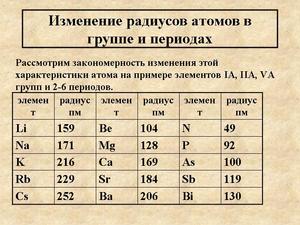
Общая тенденция изменения атомных радиусов такова. В группах атомные радиусы возрастают, так как с увеличением числа энергетических уровней увеличиваются размеры атомных орбиталей с большим значением главного квантового числа. Для d-элементов, в атомах которых заполняются орбитали предшествующего энергетического уровня, эта тенденция не имеет отчетливого характера при переходе от элементов пятого периода к элементам шестого периода.
В малых периодах радиусы атомов в целом уменьшаются, так как увеличение заряда ядра при переходе к каждому следующему элементу вызывает притяжение внешних электронов с возрастающей силой; число энергетических уровней в то же время остается постоянным.
Изменение атомного радиуса в периодах у d-элементов носит более сложный характер.
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.