как узнать ион элемента
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
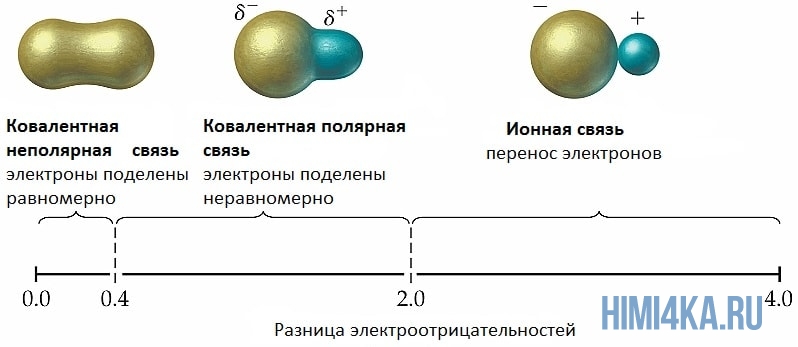
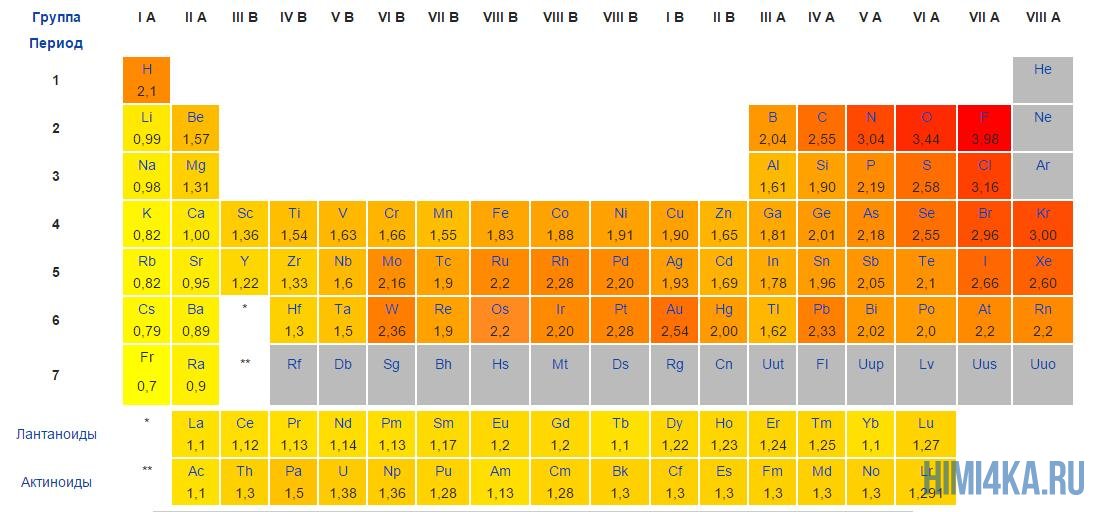
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
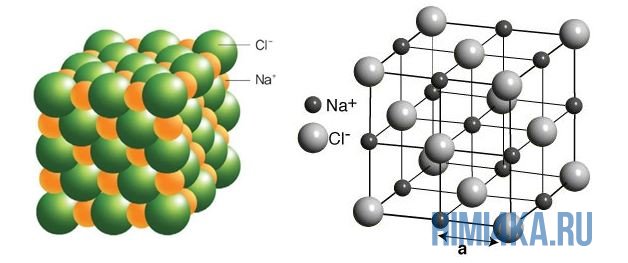
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
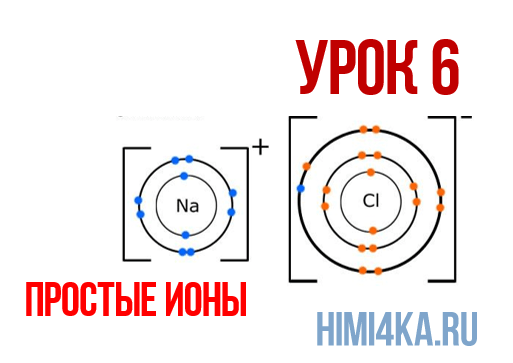
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Как узнать ион элемента
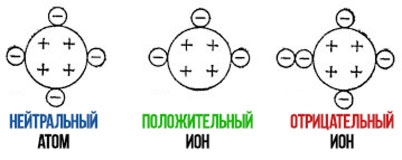
Как правило, атомы являются нейтральными, потому что они имеют такое же количество протонов (положительно заряженных частиц), что и электроны или отрицательно заряженные частицы. Однако многие атомы нестабильны, поэтому они образуют ионы (атомы или молекулы с положительным или отрицательным зарядом), теряя или приобретая электроны. Есть два типа ионов: катионы, которые заряжены положительно, потому что электроны потеряны, и анионы, которые имеют отрицательный заряд, потому что электроны получены.
Определить протоны и электроны
Посмотрите на периодическую таблицу, чтобы определить, сколько протонов и электронов имеет атом, чтобы он был сбалансирован. Например, атом натрия имеет 11 протонов и электронов, потому что его атомный номер равен 11.
Вычесть электроны из протонов
Рассмотрим валентность электронов
Стабильные атомы должны иметь восемь валентных электронов. Когда атомы проходят химические реакции или образуют связи, они получают, теряют или делят электроны, чтобы поддерживать восемь валентных электронов. Натрий имеет два электрона на первом уровне и восемь электронов на втором, что оставляет один электрон во внешнем слое. Для натрия, имеющего восемь валентных электронов, он теряет один в своем внешнем слое, поэтому второй слой, имеющий восемь электронов, становится внешним слоем, а атом является положительно заряженным ионом.
Соблюдайте Правило Металла / Неметалла
Применить числа окисления
Как узнать ион элемента
Ио́н (др.-греч. ἰόν — идущее) — одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения атомом или молекулой одного или нескольких электронов. Ионизация (процесс образования ионов) может происходить при высоких температурах, под воздействием электрического поля, ионизирующего излучения и т.п.
В виде самостоятельных частиц, ионы встречаются во всех агрегатных состояниях вещества — в газах (в частности, в атмосфере), в жидкостях (в расплавах и растворах), в кристаллах и в плазме (в частности, в межзвёздном пространстве).
Заряд иона кратен заряду электрона. Понятие и термин «ион» ввёл в 1834 году Майкл Фарадей, который, изучая действие электрического тока на водные растворы кислот, щелочей и солей, предположил, что электропроводность таких растворов обусловлена движением ионов. Положительно заряженные ионы, движущиеся в растворе к отрицательному полюсу (катоду), Фарадей назвал катионами, а отрицательно заряженные, движущиеся к положительному полюсу (аноду) — анионами.
Являясь химически активными частицами, ионы вступают в реакции с атомами, молекулами и между собой. В растворах ионы образуются в результате электролитической диссоциации и обусловливают свойства электролитов.
См. также
Источники
Смотреть что такое «Ион» в других словарях:
ИОН — У этого термина существуют и другие значения, см. Ион (значения). «ИОН» Тип Частная компания … Википедия
ион — Атом или группа атомов, который за счет потери или приобретения одного или более электронов приобрел электрический заряд. Если ион получен из атома водорода или атома металла, он обычно положительно заряжен; если ион получен из атома неметалла… … Справочник технического переводчика
Ион — а, муж. Разг. к (см. Иона).Отч.: Ионович, Ионовна; разг. Ионыч. Словарь личных имён. Ион См. Ивон. День Ангела. Справочник по именам и именинам. 2010 … Словарь личных имен
Ион — (Ion, Ιων). Сын Ксуфа, родоначальник ионийского племени. (Источник: «Краткий словарь мифологии и древностей». М.Корш. Санкт Петербург, издание А. С. Суворина, 1894.) ИОН (Ίων), в греческой мифологии афинский царь, сын Креусы. Отцом И. большинство … Энциклопедия мифологии
ИОН — ИОН, йон муж. лад, толк, смысл, пригодность. Он несуразый, иону в нем нет. Окно не к иону было прорублено, я его и заделал. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
ИОН — (от греч. ion идущий), электрически заряж. ч ца, образующаяся при потере или присоединении эл нов атомами, молекулами, радикалами и т. д. И. соответственно могут быть положительными (при потере эл нов) и отрицательными (при присоединении эл нов) … Физическая энциклопедия
ион — сущ., кол во синонимов: 17 • адденд (1) • амфион (2) • анион (1) • … Словарь синонимов
ИОН — [icov идущий] атом (или гр. атомов комплексный ион), несущий положительный (катион) или отрицательный (анион) электрический заряд и являющийся самостоятельной или относительно самостоятельной составной частью (строительной единицей) к лов или… … Геологическая энциклопедия
Ион — Ион, Ion, с Хиоса, ок. 490 ок. 421 гг. до н. э., греческий поэт. Часто бывал в Афинах, хотя и не поселился там навсегда. Состоял в дружеских отношениях с Тимоном и Фемистоклом, знал также Эсхила и Софокла. Первую трагедию поставил в 451 г. Нам… … Античные писатели
ИОН — в греческой мифологии внук Эллина, сын Ксуфа (или Аполлона); родоначальник племени ионийцев. Стал афинским царем; его сыновья Гоплет, Гелеонт, Эгикорей, Аргад эпонимы четырех древнейших фил Аттики … Большой Энциклопедический словарь
Ион — (Аин) (возм., руины ), город и равнина, находящиеся сев. истока Иордана (3Цар 15:20; 4Цар 15:29). И. был завоеван арам. (сир.) царем Венададом, а позднее Тиглатпаласаром III (библ. Феглаффелласар). В 3Цар 15:20 названия местностей перечислены в… … Библейская энциклопедия Брокгауза
Как узнать ион элемента
7.1. Что такое химические связи
В предыдущих главах вы познакомились с составом и строением изолированных атомов различных элементов, изучили их энергетические характеристики. Но в окружающей нас природе изолированные атомы встречаются крайне редко. Атомы почти всех элементов » стремятся» соединиться, образуя молекулы или другие более сложные химические частицы. Принято говорить, что при этом между атомами возникают химические связи.
Химические связи – взаимодействия, которые соединяют атомы в единые более сложные химические частицы.
В образовании химических связей участвуют электроны. Каким образом это происходит, вы узнаете, изучив эту главу. Но прежде нам надо ответить на вопрос, почему атомы образуют химические связи. На этот вопрос мы можем ответить, даже не зная ничего о природе этих связей: » Потому что это энергетически выгодно!» А вот, отвечая на вопрос, откуда при образовании связей возникает выигрыш в энергии, мы постараемся понять, как и почему химические связи образуются.
Как и электронное строение атомов, подробно и строго научно химические связи изучает квантовая химия, а мы с вами можем только воспользоваться некоторыми важнейшими выводами, сделанными учеными. При этом для описания химических связей мы будем пользоваться одной из простейших моделей, предусматривающей существование трех типов химической связи (ионной, ковалентной и металлической).
Вспомните – грамотно пользоваться любой моделью можно, только зная границы применимости этой модели. Модель, которой мы будем пользоваться, тоже имеет свои границы применимости. Например, в рамках этой модели нельзя описать химические связи в молекулах кислорода, большинства бороводородов и некоторых других веществ. Для описания химических связей в этих веществах используют более сложные модели.

7.2. Типы химических связей
Чтобы понять, за счет чего может возникнуть выигрыш в энергии, рассмотрим систему, состоящую из двух разноименно заряженных частиц а– и б + (рис. 7.1). Расстояние между частицами l (состояние I). Так как разноименно заряженные частицы притягиваются, то такая система обладает потенциальной энергией, которая может выделиться при сближении этих частиц. В результате система перейдет в состояние II с меньшей энергией. Именно это и происходит при образовании химической связи между ионами. Ведь получившиеся разноименно заряженные ионы притянутся друг к другу, между ионами возникнет ионная связь и образуется ионный кристалл. Выигрыш в энергии при образовании связи компенсирует затраты на образование ионов.
Если же у атомов близкие склонности отдавать (или принимать) электроны, то передать электроны друг другу они не могут, и им остается только попытаться использовать и свои, и чужие электроны совместно, не отдавая и не принимая их полностью. Это – вторая возможность атома образовать завершенную электронную оболочку. В этом случае при образовании связи также компенсируются все энергетические затраты, но причины здесь более сложные.
Посмотрим, в каких случаях и как атомы осуществляют эти возможности.
Электронные
формулы
исходных атомов
Уравнения
передачи
электронов
Электронные
формулы
образующихся ионов
Структурная
формула
вещества(*)
Простейшая
формула
вещества
Cl – [Ne]3s 2 3p 5
(Na

Br – [Ar,3d 10 ]4s 2 4p 5
Br + e– = Br–
(Ca 2 

CaBr2
S – [Ne]3s 2 3p 4
S + 2e– = S 2–
(Fe2

*)В структурных формулах веществ с ионными связями указываются формальные заряды: 


1. Если связываемые атомы сильно отличаются по размерам, то маленькие атомы (склонные принимать электроны) отнимут электроны у больших атомов (склонных отдавать электроны), и образуется ионная связь. Энергия ионного кристалла меньше, чем энергия изолированных атомов, поэтому ионная связь возникает даже тогда, когда атому не удается, отдавая электроны, полностью завершить свою электронную оболочку (незавершенным может остаться d— или f-подуровень). Рассмотрим примеры.
2. Если связываемые атомы маленькие(ro 1А), то все они более или менее склонны отдавать свои электроны, а склонность принимать чужие электроны у них незначительна. Поэтому образовать между собой ионную связь эти большие атомы тоже не могут. Ковалентная связь между ними также оказывается невыгодной, так как электронная плотность в больших по размеру внешних электронных облаках незначительна. В этом случае при образовании из таких атомов химического вещества происходит обобществление валентных электронов всех связываемых атомов (валентные электроны становятся общими для всех атомов), и образуется металлический кристалл (или жидкость), в котором атомы связаны металлической связью.
Как определить, связи какого типа образуют атомы элементов в определенном веществе?
По положению элементов в естественной системе химических элементов, например:
1. Хлорид цезия CsCl. Атом цезия (IА группа) большой, легко отдает электрон, а атом хлора (VIIА группа) маленький и легко его принимает, следовательно, связь в хлориде цезия ионная.
2. Диоксид углерода CO2. Атомы углерода (IVА группа) и кислорода (VIА группа) не сильно отличаются по размерам – оба маленькие. По склонности принимать электроны они отличаются незначительно, следовательно связь в молекуле CO2 ковалентная.
3. Азот N2. Простое вещество. Связываемые атомы одинаковые и при этом маленькие, следовательно, связь в молекуле азота ковалентная.
4. Кальций Са. Простое вещество. Связываемые атомы одинаковые и довольно большие, следовательно связь в кристалле кальция металлическая.
5. Барий-тетраалюминий BaAl4. Атомы обоих элементов достаточно велики, особенно атомы бария, поэтому оба элемента склонны только отдавать электроны, следовательно, связь в этом соединении металлическая.

2.Почему благородные газы состоят не из молекул, а из атомов?
3.Определите тип химической связи в бинарных соединениях: а) KF, K2S, SF4; б) MgO, Mg2Ba, OF2; в) Cu2O, CaSe, SeO2. 4.Определите тип химической связи в простых веществах: а) Na, P, Fe; б) S8, F2, P4; в) Mg, Pb, Ar.
7.З. Ионы. Ионная связь
В предыдущем параграфе вы познакомились с ионами, которые образуются, когда отдельные атомы принимают или отдают электроны. В этом случае число протонов в атомном ядре перестает быть равным числу электронов в электронной оболочке, и химическая частица приобретает электрический заряд.
Но в состав иона может входить и не одно ядро, как в молекуле. Такой ион представляет собой единую систему, состоящую из нескольких атомных ядер и электронной оболочки. В отличие от молекулы общее число протонов в ядрах не равно общему числу электронов в электронной оболочке, отсюда – электрический заряд иона.
Какие бывают ионы? То есть, чем они могут различаться?
По числу атомных ядер ионы делятся на простые (или одноатомные), то есть содержащие одно ядро (например: K



По знаку заряда ионы делятся на катионы и анионы.
Катионы – положительно заряженные ионы
Анионы – отрицательно заряженные ионы.
Примеры катионов: K 







По значению заряда ионы делятся на однозарядные (K 








Итак, ион РО4 3 

Кроме этого, ионы различаются еще и своими размерами. Размер простого иона определяется радиусом этого иона или ионным радиусом. Размер сложных ионов охарактеризовать труднее. Радиус иона, как и радиус атома, непосредственно измерить невозможно (как вы понимаете, четких границ у иона нет). Поэтому для характеристики изолированных ионов используют орбитальные ионные радиусы (примеры – в таблице 17).
Как определить заряд иона
Вам понадобится
Инструкция
4. Суммарный заряд иона получается в итоге алгебраического суммирования заряд ов входящих в него протонов и электронов. Число электронов в ионе может превышать число протонов, и тогда ион будет негативным. Если число электронов поменьше числа протонов, то ион будет правильным.
Совет 2: Как определить заряд ядра
Вам понадобится
Инструкция
1. Ядро атома состоит из 2-х типов частиц – протонов и нейтронов. Нейтроны являются электронейтральными частицами, то есть их электрический заряд равен нуля. Протоны являются одобрительно заряженными частицами и их электрический заряд равен +1.
4. Заряд ядра дозволено также определить по частоте спектральных линий характеристического излучения атома. Согласно закону Мозли: sqrt(v/R) = (Z-S)/n, где v – спектральная частота характеристического излучения, R – непрерывная Ридберга, S – непрерывная экранирования, n – основное квантовое число.Таким образом, Z = n*sqrt(v/r)+s.
Видео по теме
Совет 3: Как определять ионы
Впереди лабораторная работа, а необходимые навыки и знания по распознаванию химических веществ не наработаны. А может в химической лаборатории нечаянно отклеились этикетки с наименованиями соединений. Знание верно определять химические вещества в силу своей специфичности может теснее не понадобиться позже окончания учебных заведений. Но но эти познания могут потребоваться собственному ребенку, тот, что придет за подмогой. Что тогда ему ответить?
Вам понадобится
Инструкция
2. Кислоты. Все кислоты объединяет то, что в их состав входит ион водорода. Именно его наличие обусловливает кислые свойства. Добротной реакцией на эту группу веществ дозволено считать индикаторы, то есть в кислой среде лакмус становится красным, а метиловый оранжевый – розовым.
3. Основания. Вещества этой группы также дозволено определить с подмогой индикатора. Характерную реакцию дает фенолфталеин, тот, что в щелочной среде становится малиновым. Это происходит за счет присутствия гидроксид-ионов.
4. Металлы. Дабы определить ионы металлов, для этого надобно воспользоваться спиртовкой либо горелкой. Возьмите медную проволочку, на одном конце сделайте петельку 6-10 мм в диаметре и внесите в пламя. Фактически сразу увидите, что оно купило окраску прекрасного зеленого цвета. Это происходит как раз за счет ионов меди. Тот же самый итог будет отслеживаться, если проволочку вначале обмакнуть в соли меди (хлорид меди, нитрат меди, сульфат меди), а потом внести в пламя.
5. Дабы определить присутствие ионов щелочных металлов (натрия и калия) и щелочно-земельных (кальция и бария) необходимо также внести соответствующие растворы солей в пламя спиртовки. Ионы натрия окрасят пламя в ясно-желтый цвет, ионы кальция – в кирпично-алый. Ионы бария, входящие в состав веществ дадут желто-зеленое окрашивание, а ионы калия – фиолетовое.
6. Для определения ионов кислотных остатков существует целый ряд добротных реакций. Сульфат-ион дозволено определить, предпочтя в качестве реагента ион хлора, что в итоге даст белый осадок. Дабы узнать, что в пробирке находится карбонат-ион, возьмите всякую разбавленную кислоту и в результате увидите вскипание. Добавочно пропустите образовавшийся углекислый газ через известковую воду, отслеживая при этом помутнение.
7. Дабы определить ортофосфат-ион, довольно прилить в пробирку с ним нитрат серебра, в итоге реакции будет отслеживаться выпадение желтого осадка. Для распознавания солей аммония необходимо провести реакцию с растворимыми щелочами. Визуального слежения не будет, но но появится малоприятный запах мочевины за счет образовавшегося аммиака.
8. Для распознавания галоген-ионов (хлора, брома, йода) реагентом для всех 3 является нитрат серебра и во всех случаях произойдет выпадение осадка. В итоге ион хлора с нитратом серебра даст белый осадок (хлорида серебра), ион брома – бело-желтый осадок (бромида серебра), а ион йода – осадок желтого цвета (образуется йодид серебра).
Видео по теме
Обратите внимание!
При выполнении даже самых примитивных навыков непременно соблюдайте правила техники безопасности
Полезный совет
Имеется довольно много реакций, в которых реагентом выступает нитрат серебра. Если это вещество попадет на поверхность стола либо одежду, то удалить пятнышка не удастся.
Совет 4: Как определить заряд у элемента
В обыкновенных условиях атом электрически нейтрален. При этом ядро атома, состоящее из протонов и нейтронов, заряжено одобрительно, а электроны несут негативный заряд. При избытке либо недостатке электронов атом превращается в ион.
Инструкция
1. Всякий химический элемент имеет свой неповторимый заряд ядра. Именно заряд определяет номер элемента в периодической системе. Так, ядро водорода имеет заряд +1, гелия +2, лития +3, бериллия +4 и т.д. Таким образом, если вестим элемент, заряд ядра его атома дозволено определить из таблицы Менделеева.
2. От того что при обыкновенных условиях атом электрически нейтрален, число электронов соответствует заряду ядра атома. Негативный заряд электронов компенсируется позитивным зарядом ядра. Электростатические силы удерживают электронные облака возле атома, что обеспечивает его стабильность.
3. При воздействии определенных условий у атома дозволено отнимать электроны либо присоединять к нему добавочные. Если отнять электрон от атома, атом превращается в катион – одобрительно заряженный ион. При избыточном числе электронов атом становится анионом – негативно заряженным ионом.
4. Химические соединения могут иметь молекулярную либо ионную природу. Молекулы также электрически нейтральны, а ионы несут в себе определенный заряд. Так, молекула аммиака NH3 нейтральна, а вот ион аммония NH4+ заряжен одобрительно. Связи между атомами в молекуле аммиака ковалентные, образованные по обменному типу. Четвертый атом водорода присоединяется по донорно-акцепторному механизму, это тоже ковалентная связь. Аммоний образуется при взаимодействии аммиака с растворами кислот.
5. Главно понимать, что заряд ядра элемента не зависит от химических перевоплощений. Сколько электронов ни добавляй и ни отнимай, заряд ядра останется тем же. К примеру, атом O, анион O- и катион O+ характеризуются одним и тем же зарядом ядра +8. При этом атом имеет 8 электронов, анион 9, катион – 7. Само ядро дозволено изменить только путем ядерных перевоплощений.
Совет 5: Как определить электрический заряд
Электрический заряд – это величина, характеризующая способность физического тела быть источником электромагнитного поля и принимать участие во взаимодействии с другими сходственными источниками. Еще древние греки нашли, что если кусок янтаря потереть о шерсть, то он приобретет способность притягивать легкие предметы. Янтарь на древнегреческом языке именовался «электрон».
Инструкция
1. Школьникам, постигавшим физику в старших классах, наверно знаком примитивный прибор – электрометр. Он состоит из металлического стержня с круглым горизонтально расположенным выступом. На данный выступ насажена стрелка, которая может вольно вращаться. Что произойдет, если к металлическому стержню электрометра прикоснется заряженное тело? Часть заряда как бы перетечет на стержень и стрелку. Но от того что эти заряды одноименные, то они будут отталкивать друг друга. И стрелка отклонится от изначального расположения на определенный угол. С подмогой градуированной шкалы его замеряют и рассчитывают величину заряда. Легко дозволено осознать, что чем огромнее заряд, тем огромнее будет угол отклонения стрелки электрометра, и напротив. Разумеется, с поддержкой такого примитивного прибора дозволено произвести лишь примерное определение величины заряда. Если надобна высокая точность, используются эмоциональные электронные электрометры.
2. Можете воспользоваться законом Кулона: F = kq1q2/r^2, где F – сила взаимодействия между двумя заряженными телами, q1 и q2 – величины их зарядов, r – расстояние между центрами этих тел, а k – показатель пропорциональности. Иными словами, если у вас есть тело, заряд которого q1 вам знаменит, то, поднеся второе тело, заряд которого q2 нужно определить на расстояние r и силу взаимодействия F с поддержкой эмоционального прибора-динамометра, вы легко вычислите желанный заряд q2 по формуле: q2 = Fr^2/(kq1).
3. Также допустимо вычистить величину заряда, измерив силу тока в цепи. Дело в том, что суммарная величина заряда, протекшего через поперечное сечение какого-нибудь проводника, вычисляется по формуле: Q = IT, где I – сила тока в амперах, а Т – время в секундах. Для этого навыка вам потребуется секундомер и амперметр – прибор для определения силы тока. Соберите электрическую цепь, куда включен амперметр, включите ток, запишите показание амперметра. Разомкните цепь, единовременно отключив секундомер. Запишите, сколько времени ток был в цепи. И по вышеуказанной формуле подсчитайте суммарный электрический заряд.
Видео по теме
Полезный совет
Представление о позитивном и негативном заряде ввел Б. Франклин в середине 18-го столетия. А сам термин «электрический заряд» был впервой использован Шарлем Кулоном в 1785-м году, тот, что как бы объединил слова «электрон» и «заряд». В честь этого ученого названа основная единица электрического заряда – 1 кулон.