В чем биологический смысл позитивной и негативной селекции т клеток в тимусе
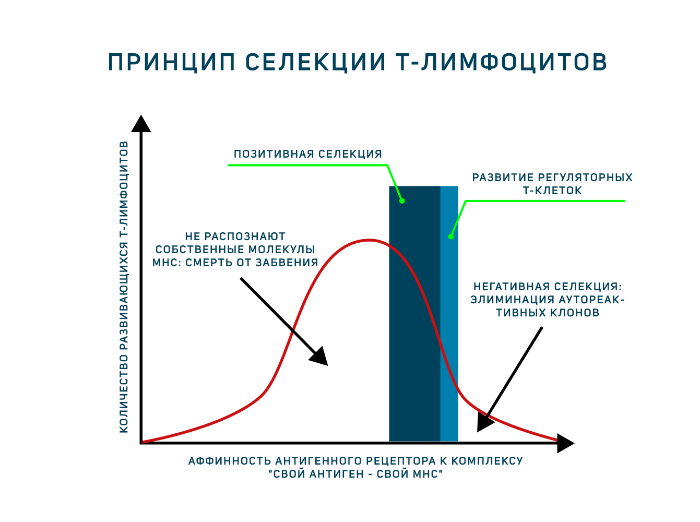
Позитивная и негативная селекция в тимусе
Предшественники Т-лимфоцитов на ранних этапах дифференцировки в тимусе подвергаются позитивной и негативной селекции. Не прошедшие селекцию предшественники подвергаются апоптозу. При негативной селекции элиминируются клетки, распознающие аутоантигены. Механизмы представления аутоантигенов в тимусе до настоящего времени мало изучены, а данные о становлении этого процесса в раннем онтогенезе практически отсутствуют. В отличие от тимуса, в периферических органах и тканях иммунной системы происходит представление чужеродных антигенов, и в этом процессе участвуют иммунные протеасомы. Целью данной работы являлась проверка предположения об участии иммунных протеасом в представлении аутоантигенов в тимусе, а также изучение становления процесса негативной селекции в раннем онтогенезе. Количественную оценку экспрессии субъединиц иммунных протеасом LMP7 и LMP2 в тимусе проводили с помощью Вестерн-блоттинга в пре- и постнатальном онтогенезе у крыс. Распределение иммунных протеасом в клетках тимуса анализировали с помощью иммуногистохимии. Параллельно оценивали динамику уровня апоптоза в тимусе на тех же этапах онтогенеза с помощью проточной цитофлуориметрии. Иммуногистохимически показано, что экспрессия иммунных протеасом наблюдается не в тимоцитах, а, вероятнее всего, в эпителиальных и дендритных клетках тимуса, которые являются антиген-представляющими для Т-клеток. Этот факт дает основание полагать, что негативная селекция в тимусе происходит с участием иммунных протеасом. Обе иммунные субъединицы иммунных протеасом обнаруживаются в тимусе, начиная с 18-го эмбрионального дня (Э). Причем количество этих субъединиц на Э18 невелико и возрастает к Э21, а затем остается на том же уровне до 19-го постнатального дня (П19). В то же время, на Э18 в тимусе регистрируется высокий уровень апоптоза, который снижается к Э21 и далее остается неизменным до П30. Полученные данные свидетельствуют о том, что негативная селекция в тимусе может происходить у плодов уже на Э18, а к Э21 усиливается до уровня, характерного для постнатальных животных. Высокий уровень апоптоза, наблюдаемый на Э18 связан, по-видимому, не столько с процессами негативной селекции, сколько с активной миграцией предшественников Т-лимфоцитов в тимус накануне Э18, а, как известно, количество локусов для мигрирующих предшественников в тимусе ограничено. Таким образом, впервые была показана экспрессия иммунных протеасом в тимусе, участвующих в представлении аутоантигенов при негативной селекции, в перинатальном онтогенезе. Становление процесса негативной селекции у крыс происходит еще в пренатальном онтогенезе.
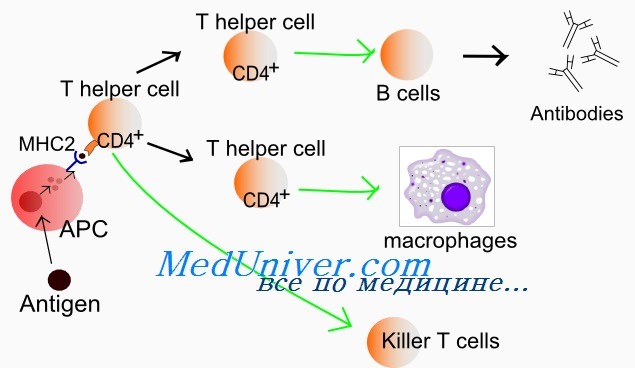
Позитивная селекция: погибают тимоциты, не связавшие ни одного из доступных комплексов MHC-пептид. В результате позитивной селекции в тимусе погибает около 90% тимоцитов.
Негативная селекция уничтожает клоны тимоцитов, связывающих комплексы MHC-пептид со слишком высокой аффинностью. Негативная селекция элиминирует от 10 до 70% клеток, прошедших позитивную селекцию.
Центральная толерантность Т-лимфоцитов
Селекция Т-лимфоцитов
Положительная селекция Т-лимфоцитов
Установлено, что стволовые клетки мигрируют из костного мозга в тимус, проникая в орган в зоне кортико-медулярного перехода. В дальнейшем прибывшие клетки перемешаются в поверхностный слой корковой зоны, где проходят начальные этапы дифференцировки под опекой клеток-нянь (рис. 34, 35). В дальнейшем пре-Т-лимфоциты спускаются в глубь коркового слоя тимуса, где вступают в контакт с тимическими эпителиальными клетками. Последние экспрессируют молекулы гистосовместимости собственного организма и подвергают созревающие Т-лимфоциты процессу положительной (позитивной) селекции. Суть положительной селекции состоит в том, что выживают только те Т-лимфоциты, которые способны распознавать молекулы гистосовместимости собственного организма, что необходимо для их дальнейшего эффективного участия в иммунном ответе. Причем сохраняют жизнеспособность только Т-клетки со средним сродством к молекулам HLA I и II. Остальные клетки (а это большинство) подвергаются спонтанному апоптозу, поскольку не получают активированного сигнала на выживание. Материал с сайта http://wiki-med.com
Отрицательная селекция Т-лимфоцитов
В дальнейшем выжившие Т-лимфоциты опускаются в мозговой слой тимуса, где проходят этап отрицательной (негативной) селекции. При этом они взаимодействуют с тимическими дендритными клетками, экспрессирующими комплексы молекул гистосовместимости с пептидами, полученными из разнообразных молекул собственного организма. В результате подобного взаимодействия выживают только те Т-лимфоциты, чей антигенраспознающий рецептор не способен распознавать указанные комплексы, а остальные гибнут путем индуцированного апоптоза что достигается за счет продукции глюкокортикоидов. За счет механизма отрицательной селекции осуществляется профилактика аутоиммунных заболеваний.
В целом выживает лишь около 2-5% всех клеток, прибывших в тимус для дифференцировки, что свидетельствует о чрезвычайно жестком отборе Т-лимфоцитов и высокой степени надежности механизма формирования центральной иммунной толерантности. Однако все же в тимусе представлены не все имеющиеся аутоантигены, поэтому необходимо осуществление механизмов поддержания толерантности на периферии.
В чем биологический смысл позитивной и негативной селекции т клеток в тимусе
Предшественники, прекоммитированные к развитию в Т-лимфоциты, непрерывно мигрируют от костного мозга в вилочковую железу, однако их число, по-видимому, очень мало. Незрелые предшественники Т-клеток поступают в область коры вилочковой железы, где созревают в функциональные субпопуляции Т-клеток. Особенностью развития тимоцитов является высокая скорость пролиферации.
У человека возможно и экстратимическое созревание Т-клеток, однако для оптимального развития Т-лимфоцитов необходимо наличие неповрежденной вилочковой железы.
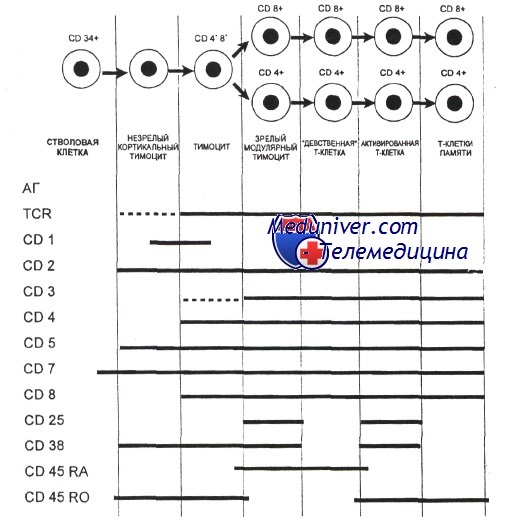
Различные стадии развития тимоцита можно определить по изменению экспрессии поверхностных и цитоплазматических молекул, рецепторов цитокинов и состояния реаранжировки генов Т-клеточного рецептора. Т-клеточный рецептор (TCR) распознает только короткие пептиды, которые заполняют полость в молекулах первого или второго класса главного комплекса гистосовместимости (МНС I и II, МНС комплекс у человека обозначается как HLA). Презентация таких пептидов Т-лимфоцитам обеспечивается антигенпредставляющими клетками.
TCR — гетеродимерный комплекс, сформированный при ассоциации а-и бета- или у- и S-субъединиц. Каждая из этих субъединиц кодируется отдельным геном. Т-клетки с рецепторами типов ар и уq являются различными линиями, которые разделяются до начала реаранжировки гена TCR.
Наименее зрелые клетки-предшественники в вилочковой железе экспрессируют антиген CD7. Некоторые из них экспрессируют также CD44. CD44, рецептор для гиалуроновой кислоты, — один из факторов, определяющих перемещение предшественников Т-клеток в вилочковую железу. Из этих предшественников далее образуются CD2+/CD7+ клетки, в цитоплазме которых присутствует CD3. Белковый комплекс CD3 обеспечивает передачу сигналов через TCR.
Пептидные цепи CD3-комплекса начинают синтезироваться на стадии про-Т-лимфоцита, и их экспрессия предшествует появлению на мембране TCR.
Т-лимфоциты уq-линии первыми начинают экспрессировать рецептор CD3, но на них нет молекул CD4 или CD8. Несколько позднее на поверхности клеток, экспрессирующих рецептор типа аb, начинают одновременно экспрессироваться антигены CD4 и CD8. К этому времени заканчивается реаранжировка генов а- и р-цепей, и на поверхности клеток экспрессируется рецепторный комплекс TCR ab/CD3.
По мере того как клетки, экспрессирующие CD4+, CD8+ и TCR (так называемые дважды положительные клетки), проходят от коры к мозговому веществу вилочковой железы, они созревают в CD4+ хелперные или CD8+ цитотоксические Т-клетки. Клетки, которые созревают до стадии CD4+ или CD8+, составляют менее 5% тимоцитов. Эти лимфоциты покидают вилочковую железу и заполняют вторичные лимфоидные ткани (лимфатические узлы, селезенку, лимфоидную ткань, ассоциированную со слизистыми оболочками).
Т-лимфоциты с рецептором уq и CD5+B1-клетки являются функционально аналогичными популяциями, которые развиваются параллельно. Т-клетки с рецептором типа уq найдены в различных тканях, включая селезенку, эпидермис и эпителий слизистой оболочки матки, влагалища и языка. Предполагается, что эта популяция клеток может исполнять роль иммунного надзора в перечисленных тканях.
Формирование комплекса Т-клеточного рецептора и положительная и отрицательная селекция в вилочковой железе
Как и гены иммуноглобулинов, гены Т-клеточного рецептора собираются из различных сегментов, находящихся первоначально в зародышевой конфигурации. Гены Т-клеточного рецептора подвергаются процессу соматической реаранжировки, при которой кодирующие сегменты присоединяются друг к другу, а присутствующие между ними интронные последовательности удаляются. Вариабельность соединений и вставок обеспечивает возникновение различий TCR и приводит к огромному количеству различных последовательностей гипервариабельного участка TCR. Репертуар различных TCR считается даже большим, чем репертуар молекул Ig (по оценкам, репертуар ab-TCR составляет 1015, а для yq-TCR — 1018). В отличие от В-лимфоцитов, Т-лимфоциты не секретируют свои рецепторы.
Дважды позитивный тимоцит проходит через многоступенчатый процесс, известный как тимическая селекция. На первой фазе, называемой положительной селекцией, TCR дважды позитивного тимоцита взаимодействуют с молекулами МНС, которые экспрессируются эпителиальными клетками в коре вилочковой железы. Тимоциты, способные распознавать комплекс антигена с молекулой HLA, ускользают от апоптоза и вступают в дальнейшую дифференцировку, в то время как тимоциты, не способные к такому взаимодействию, погибают.
Поскольку рекомбинации, затрагивающие возникновение TCR, являются случайными, в вилочковой железе могут развиваться и пройти позитивную селекцию Т-клетки, экспрессирующие TCR, специфичные к чужеродным и собственным антигенам. Существует вероятность, что Т-клетки, реактивные к собственным структурам организма, будут взаимодействовать с аутоантигенами в тканях, что может привести к нежелательным аутоиммунным реакциям. Для предотвращения этого дважды положительные клетки подвергаются второй фазе отбора, которая называется негативной селекцией. В ходе этой фазы дважды положительные клетки взаимодействуют с комплексом МНС-пептид, экспрессированным на поверхности дендритной клетки.
Т-клетки, TCR которых взаимодействует с комплексом МНС-пептид с высокой аффинностью, подвергаются апоптозу. В ходе негативной селекции удаляются Т-клетки, экспрессирующие TCR, обладающие реактивностью к собственным антигенам.
Дважды положительные клетки, пережившие негативную селекцию, снижают экспрессию корецепторов CD4 или CD8, что приводит к развитию или CD4+CD8″ или CD4″CD8+ (моноположительных) Т-лимфоцитов. При этом Т-лимфоциты, распознающие антигены, представляемые молекулами МНС II класса, сохраняют экспрессию корецептора CD4+, a Т-лимфоциты, распознающие антигены, представляемые молекулами МНС I класса, сохраняют экспрессию корецептора CD8+. Эти клетки покидают вилочковую железу и образуют периферические зрелые CD4+ и CD8+ Т-клетки.
Клетки и цитокины, регулирующие развитие Т-клеток
Вилочковая железа состоит из корковой и медуллярной областей, различающихся по количеству тимоцитов и составу стромальных клеток. Стромальные клетки вилочковой железы влияют на развитие тимоцитов как посредством прямых межклеточных взаимодействий, так и секрецией растворимых медиаторов.
Тимоциты и клетки тимического эпителия экспрессируют ряд поверхностных клеточных детерминант, некоторые из которых вовлечены в адгезию этих клеточных популяций друг к другу. Рецептор CD2 на тимоцитах определяет связывание с детерминантой CD58 (LFA-3) и межклеточной адгезионной молекулой-1 (ICAM-1), представленными на клетках тимического эпителия. Взаимодействия между развивающимися лимфоцитами и стромой могут активировать обе популяции. Например, связывание тимоцитов со стромой может стимулировать продукцию ИЛ-1 стромальными клетками и повышать экспрессию рецептора ИЛ-2 на тимоцитах.
ИЛ-7 стимулирует полиферацию тимоцитов, и фактор стволовых клеток увеличивает этот эффект. Эпителиальные клетки вилочковой железы у человека являются источником цитокинов ИЛ- 1а и b, ИЛ-3, ИЛ-6, ИЛ-8, колониестимулирующих факторов (Г-КСФ и ГМ-КСФ), лейкозингибирующего фактора (LIF) и TGF-p, а также гормонов тимозина или тимопоэтина, оказывающих влияние на пролиферацию и дифференцировку тимоцитов.
Цитокины, необходимые для развития Т-клеток, могут продуцироваться самими Т-клетками. Тимоциты производят IFN-y, ФНО-а, ИЛ-2, ИЛ-3 и ИЛ-4.
Естественные киллерные клетки. Естественные киллеры (NK) обладают способностью спонтанно лизировать некоторые опухолевые клетки-мишени. Человеческие NK-клетки экспрессируют CD16 и CD56, но не имеют TCR или CD3. По морфологическим характеристикам эти клетки представляют собой большие гранулярные лимфоциты (в них присутствуют крупные цитоплазматические гранулы). NK-клетки имеют гемопоэтическое происхождение и развиваются в костном мозге, но пока мало известно об их предшественниках.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Роль телец Гассаля тимуса человека в позитивной и негативной селекции тимоцитов
Статья просмотрена: 3258 раз
Библиографическое описание:
Беловешкин, А. Г. Роль телец Гассаля тимуса человека в позитивной и негативной селекции тимоцитов / А. Г. Беловешкин. — Текст : непосредственный // Молодой ученый. — 2012. — № 7 (42). — С. 334-338. — URL: https://moluch.ru/archive/42/5144/ (дата обращения: 28.12.2021).
Введение. Известно, что тимус представляет собой первичный орган иммунной системы, в котором происходит дифференцировка предшественников Т-лимфоцитов в зрелые клетки. Процесс дифференцировки обеспечивается сложным трехмерным микроокружением тимуса, состоящим из различных клеточных популяций, активно взаимодействующих как между собой посредством ряда хемокинов, адгезионых молекул и иных механизмов [3].
Одним из наименее изученных компонентов тимуса являются тельца Гассаля, которые представляют собой концентрические скопления эпителиальных клеток в мозговом веществе долек тимуса. Тельца Гассаля взаимодействуют с различными типами клеток, но их взаимодействие с тимоцитами до настоящего времени остается недостаточно изученным [4]. Так, Blau [5] считал, что тельца обладают фагоцитарной активностью и способны разрушать гибнущие тимоциты. Эта теория получила широкое распространение и явно, или неявно поддерживается большим количеством исследователей. Bodey [3] объясняет зернистость в эпителиальных клетках фрагментами разрушенных тимоцитов, не приводя удовлетворительных доказательств в поддержку этой точки зрения. Также в пользу его предположения интерпретировались такие факты как быстрое попадание ДНК тимоцитов в просвет телец и высокая активность лизосомальных ферментов в клетках телец Гассаля [3]. Несмотря на многочисленные исследования, так и не был описан механизм попадания тимоцитов в тельца Гассаля. Наряду с описанной теорией, существуют и противоположные мнения, которые доказывают, что тельца Гассаля напротив, способствуют дозреванию тимоцитов. Некоторые исследователи обращают внимание на высокую плотность тимоцитов возле телец Гассаля. Senelar [12] описал контакты клеток телец с тимоцитами и выдвинул предположение, что тельца являются местами дозревания тимоцитов.
Таким образом, существует ряд противоречий в описании как структурных особенностей взаимодействия тимоцитов с тельцами Гассаля, так и в интерпретации полученных данных. Целью настоящего исследования было выявление закономерностей взаимодействия тимоцитов и телец Гассаля тимуса человека и интерпретировать полученные результаты в свете современных научных данных.
Материалы и методы. Объектом исследования служил операционный материал тимуса, удаленный по хирургическим показаниям. Операции проводились в Минском детском кардиохирургическом центре по поводу минимальных сердечно-сосудистых пороков у детей в возрасте 1-4 месяца, в анамнезе которых отсутствовали инфекционные заболевания, иммунодефицитные состояния, прием стероидных гормонов, иммунодепрессантов.
Электронно-микроскопическое исследование проводилось на электронном микроскопе JEM 100 CX (Япония). Образцы фиксировались в 2,5% растворе глютаральдегида и 1% растворе четырехокиси осмия и заливались в аралдит. Срезы изготавливали на ультратоме ЛБК (Швеция) и контрастировали цитратом свинца.
Полученные результаты. Использование маркера CD 3, который является общим для всех Т-лимфоцитов, показало, что лимфоциты в мозговом веществе распределены достаточно равномерно, однако периферический слой телец Гассаля окружен лимфоцитами плотно (рисунок 1а). В полости телец тимоциты, за редким исключением, отсутствуют. Часто можно обнаружить CD 3-положительные клетки между эпителиоцитами телец. Таким образом, тимоциты не вносят существенного вклада в строение телец и структурное взаимодействие между ними выражено незначительно.
Тем не менее, исследование определенных субпопуляций тимоцитов показало их концентрацию возле телец Гассаля (рисунок 1б, 1в). Плотность тимоцитов субпопуляций CD 25 и С D 30 встречаются возле телец Гассаля намного чаще, чем в других отделах мозгового вещества. При ультраструктурном исследовании на периферии тельца Гассаля обнаруживается тесное взаимодействие тимоцитов с микроворсинками эпителиальных клеток. Ультрамикроскопическое исследование выявило большое количество тимоцитов возле периферических клеток, причем отростки тимоцитов контактируют с микроворсинками эпителиальных клеток и мембраной многочисленных дендритных клеток. Часто можно наблюдать непосредственный контакт клеточных мембран. Данные наблюдения могут свидетельствовать о тесном взаимодействии данных типов клеток.
Рис. 1. Различные субпопуляции тимоцитов в мозговом веществе тимуса. Иммуногистохимическая реакция на CD 3 (А), CD 25 (В), CD 30 (Б), гистохимическая реакция на нуклеиновые кислоты (Г). Обозначения: 1 – тельце Гассаля, 2 – имуннореактивные тимоциты, 3 – апоптотические тимоциты. Увеличение 1000х.
Рис. 2. Апоптоз тимоцитов и тельца Гассаля мозгового вещества тимуса. Электронно-микроскопическое исследование. Апоптотическое тельце (А), макрофаг с фагоцитированным апоптотическим тимоцитом (Б), апоптотические тельца в полости (В) и в стенке (Г) тельца Гассаля. Обозначения: 1 – апоптотическое тельце, 2 – эпителиальная клетка тельца, 3 – полость тельца, 4 – тимоциты, 5 – макрофаг. Увеличение 10000х.
Следующим важным наблюдением было обнаружение большого количества тимоцитов на различных стадиях апоптоза (рис. 2). Апоптотические тимоциты встречаются возле телец Гассаля намного чаще, чем в других отделах мозгового вещества. При гистологических методах окраски, хорошая визуализация апоптоза достигается при использовании гистохимических методов окраски на нуклеиновые кислоты (рисунок 1г). Ультрамикроскопически можно обнаружить апоптотические тимоциты как в виде отдельных апоптотических телец, так и в виде клеток с конденсированным хроматином. Топография апопоптотических тимоцитов различна: преимущественно они встречаются непосредственно возле периферического слоя телец Гассаля, реже – между эпителиальными клетками и еще реже – в полости телец регрессивного типа (рисунок 2). При этом часто обнаруживаются апоптотические тельца в цитоплазме макрофагов (рисунок 2б). Ранее [1] мы упоминали, что CD 68-положительные макрофаги в мозговом веществе сконцентрированы возле телец Гассаля всех стадий развития, а не только возле стареющих форм, в разрушении которых они принимают участие. Таким образом, объяснением этого наблюдения, может быть фагоцитоз макрофагами погибающих апоптозом тимоцитов. Плотность макрофагов в мозговом веществе намного ниже, чем в корковом веществе, что, на наш взгляд, отражает различия в интенсивности апоптоза в данных зонах.
Обсуждение полученных результатов. Полученные результаты подтверждаются данным исследования апоптоза в тельцах с помощью TUNEL- метода [ 7 ]. Он показал, что все CD 3-положительные клетки в тельцах являются апоптотическими, причем принадлежат они различным субпопуляциям ( CD 4+ CD 8+ CD 4+ CD 8+). Таким образом, тельца участвуют в утилизации различных типов аутореактивных тимоцитов. Doulek также показал, что тельца – это единственное место апоптоза в мозговом веществе тимуса. Движение тимоцитов in vivo с помощью двухфотонной микроскопии позволяет проследить движение отдельных клеток [4]. Показано, что после взаимодействия с дендритными клетками, тимоцит не сразу подвергается апоптозу а еще некоторое время мигрирует по мозговому веществу. Для объяснения полученных данных необходимо привлечь исследования по хемокинам, регулирующим миграцию тимоцитов.
Заключение. Таким образом, при исследовании взаимодействия телец с тимоцитами было выявлены несколько структурных закономерностей взаимодействия телец Гассаля и тимоцитов.
1. Тимоциты принимают незначительное участие в морфогенезе телец Гассаля, редко встречаясь между эпителиальными клетками телец, и, еще реже, в полости телец.
2. Обнаружены ультраструктурные данные, свидетельствующие о тесном взаимодействии эпителиальных клеток телец и тимоцитов.
2. Концентрация CD 25+ и CD 30+ субпопуляций тимоцитов возле телец Гассаля выше, чем в других отделах мозгового вещества.
2. Наблюдался высокий уровень апоптоза тимоцитов возле телец Гассаля и поглощение апоптотических телец макрофагами.
Следовательно, результаты настоящего исследовании и данные литературы свидетельствуют о том, что тельца Гассаля оказывают разнообразное влияние на развивающиеся тимоциты. Они являются компонентом системы по утилизации аутореактивных клеток, синтезируют хемокины, влияющие на миграцию тимоцитов, осуществляют прямую антигенпрезентацию. Предлагаемый алгоритм взаимодействия клеток в рамках негативной селекции позволяет интерпретировать полученные экспериментальные данные и укладывается в рамки современных представлений о процессах позитивной и негативной селекции в мозговом веществе тимуса человека.
Беловешкин А.Г., Стельмах И.А. // Участие макрофагов в процессе разрушения телец Гассаля тимуса человека. БГМУ: 90 лет в авангарде медицинской науки и практики: сб. научных трудов, Минск: ГУ РНМБ, 2001, т.1, стр. 88-89.
Annunziato Francesco, Paola Romagnani, Lorenzo Cosmi, Chiara Beltrame, Macrophage-Derived Chemokine and EBI1-Ligand Chemokine Attract Human Thymocytes in Different Stage of Development and Are Produced by Distinct Subsets of Medullary Epithelial Cells: Possible Implications for Negative Selection The Journal of Immunology 1, 2000 vol. 165 no. 1 238-246.
Borgne Marie Le, Ena Ladi, Ivan Dzhagalov, Paul Herzmark, Ying Fang Liao, Arup K Chakraborty Ellen A Robey The impact of negative selection on thymocyte migration in the medulla Nature Immunology 10, 823 – 830 (2009).
Blau J N. A phagocytic function of Hassall’s corpuscles. Nature. 1965; 208:564.
Bhatia S K, Tygrett L T, Grabstein K H, Waldschmidt T J. The effect of in vivo IL-7 deprivation on T cell maturation. J Exp Med. 1995; 181: 1399.
Douek Daniel C. and Daniel M. Altmann. T-cell apoptosis and differential human leucocyte antigen class II expression in human thymus Immunology. 2000 February; 99(2): 249–256.
Romagnani Paola, Francesco Annunziato, Elena Lazzeri, Lorenzo Cosmi. The Journal of Immunology \\ Interferon-inducible protein 10, monokine induced by interferon gamma, and interferon-inducible T-cell alpha chemoattractant are produced by thymic epithelial cells and attract T-cell receptor (TCR) CD8+ single-positive T cells, TCR + T cells, and natural killer-type cells in human thymus. – 2001 – Vol. 168 – рр 2609-2617.
He W, Zhang Y, Deng Y, Kabelitz D. Induction of TCR-gamma delta expression on triple-negative (CD3-4-8-) human thymocytes. Comparative analysis of the effects of IL-4 and IL-7. J Immunol. 1995 Apr 15; 154(8):3726-31.
Развитие Т-лимфоцитов
Т-лимфоциты несут на себе поражающее воображение разнообразие рецепторов, позволяющее распознавать практически любые чужеродные субстанции, с которыми может столкнуться организм. Путь от гемопоэтической стволовой клетки к 10 7 –10 9 клонов Т-лимфоцитов с уникальными антиген-связывающими последовательностями — удивительное достижение эволюции. Многостадийное развития Т-лимфоцитов может выглядеть пугающим и запутывающим со страниц учебников. Однако, если вы дадите ему второй шанс, вы увидите, что это красивый и слаженный процесс.
Как и остальные клетки крови, Т-лимфоциты берут свое начало в костном мозге от гемопоэтической стволовой клетки. Такие клетки-предшественницы имеют мало общего со зрелыми функциональными Т-лимфоцитами: они не имеют антигенных рецепторов (TCR) и не умеют узнавать чужеродные антигены. Их ждет сложный путь развития, который осилят немногие, однако те, которые выживут, создадут армию, готовую к любой угрозе. Для развития Т-лимфоцитов в нашем теле формируется специальный орган — тимус. Создав достаточный репертуар рецепторов, тимус подвергается инволюции и практически не детектируется после пубертатного периода. Численность Т-лимфоцитов во взрослом организме в основном поддерживается делением зрелых клеток.
Для миграции в тимус клетки, чья судьба — стать Т-лимфоцитом, используют хемокиновый рецептор CCR9, лиганд для которого — CCL25 — секретируют клетки тимуса. Достигнув тимуса, предшественники Т-лимфоцитов становятся тимоцитами. Первым делом они получают сигнал от эпителиальных клеток тимуса через рецептор Notch-1, который окончательно определяет их судьбу в пользу Т-лимфоцита.
Следующая задача тимоцитов — активная пролиферация. Скорость деления тимоцитов крайне высока, поскольку 95 %–98 % этих клеток погибает. Дело в том, что судьба развивающегося Т-лимфоцита по умолчанию — апоптоз, спасти от которого его может только успешное прохождение нескольких раундов отбора. Сигнал для первого раунда деления — интерлейкин 7, который выделяют эпителиальные и другие клетки тимуса. Мутации в гене ИЛ-7 или его рецептора приводят к тяжелым иммунодефицитам. Пролиферация приводит к созданию большого пула клеток, которые называют дважды негативными клетками, поскольку они не несут на себе корецепторы CD4 и CD8. Большинство из них (90 %) дадут начало αβ Т-лимфоцитам, а 10 % — γδ Т-лимфоцитам.
После этого тимоциты приступают к перестройке генов антигенных рецепторов. Это тот самый момент, когда из небольшого количества генов возникает всё разнообразие антигенных рецепторов — миллионы и миллиарды. В ходе этого процесса участки генов антигенных рецепторов перестраиваются случайным образом. Ключевое слово здесь — случайный, поскольку процесс формирования рецепторов, способных эффективно распознавать чужеродные антигены, никак не зависит от этих антигенов и происходит задолго до встречи с ними!
До сих пор тимоциты содержали гены TCR в зародышевой конфигурации, т. е. не подвергшиеся перестройке. Такие гены не могут образовать TCR. Тимоциты начинают с перестройки генов одной из двух цепей TCR — β-цепи. После этого тимоциты проходят через первую контрольную точку. В случае успешной перестройки клетка экспрессирует β-цепь, которая вместе с инвариантной α-цепью формирует на поверхности клетки pre-TCR. Такой рецептор активируется без участия лиганда и передает в клетку сигналы для дальнейшего развития. Остальные клетки не проходят отбор: в случае неудачной перестройки pre-TCR не экпрессируется и клетка подвергается апоптозу в отсутствие сигналов к выживанию.
Активация pre-TCR поставляет в клетку важные сигналы для дальнейшего развития:
В отличие от цепи-партнера, α-цепь может подвергаться многократной перестройке, и большинство тимоцитов успешно с ней справятся. После перестройки α-цепи тимоциты наконец экспрессируют на своей поверхности полный αβ TCR. Однако впереди главная проверка, пройти которую суждено немногим.
Задачи последнего этапа отбора:
Особую роль в негативной селекции играет белок AIRE (аутоиммунный регулятор), который заставляет клетки тимуса экспрессировать в небольших количествах антигены, в норме присутствующие только в определенных тканях. Это позволяет сформировать толерантность к тканеспецифичным антигенам, встречающимся только за пределами тимуса. Мутация в белке AIRE приводит к развитию аутоиммунного полиэндокринного синдрома. AIRE содержится в эпителиальных клетках медуллы. При этом известно, что наиболее эффективно негативная селекция осуществляется при презентации антигена дендритными клетками и макрофагами, а не стромой тимуса. В новом исследовании был показан перенос антигенов из эпителиальных клеток тимуса в дендритные клетки, которые их и презентируют!
Одновременно с позитивной и негативной селекцией осуществляется проверка, соответствует ли корецептор распознаваемому классу МНС — т. е. происходит дифференцировка в функциональные подклассы. Выживают только клетки с правильной комбинацией: CD8 + MHC I — цитотоксические Т-лимфоциты и CD4 + MHC II — Т-хелперы.
Последнее, что должен сделать лимфоцит перед тем, как покинуть тимус — это изменить тип сигналинга через антигенный рецептор. Если незрелые Т-лимфоциты с высоким родством к антигену погибают, то зрелые — активируются (молекулярные основы такой принципиальной разницы не ясны). Теперь лимфоциты готовы заселить периферические лимфоидные органы и нести оборону. Зрелые Т-лимфоциты покидают тимус, используя градиент сфингозин-1-фосфата, — липида, присутствующего в высоких концентрациях в крови и лимфе, для хемотаксиса в кровяное русло. Для хоуминга во вторичные лимфоидные ткани они используют CD62L (L-селектин).
γδ Т-лимфоциты несут менее разнообразные антигенные рецепторы, по-видимому, не зависящие от МНС. Они не экспрессируют корецепторы CD4, CD8. γδ Т-лимфоциты выступают в роли первой линии обороны против часто встречающихся бактерий в эпителиальных и слизистых тканях и скорее относятся ко врожденной иммунной системе, чем к адаптивной.
Источники: